Содержание
- 2. Тема урока: «Простые вещества – неметаллы. Аллотропия»
- 3. Цели урока: Получить представление о простых веществах – неметаллах; Познакомиться с общими физическими свойствами неметаллов и
- 4. Проверка домашнего задания. 1. Где в периодической системе находятся элементы, соответствующие простым веществам металлам?
- 5. 2. Каковы общие физические свойства металлов?
- 6. 3. По каким физическим свойствам различаются металлы?
- 7. 4. Какое из веществ названных в приведённом ниже стихотворении, не относится к металлам? Семь металлов создал
- 8. Изучение новой темы. «Простые вещества – неметаллы. Аллотропия»
- 9. Неметаллы - это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами
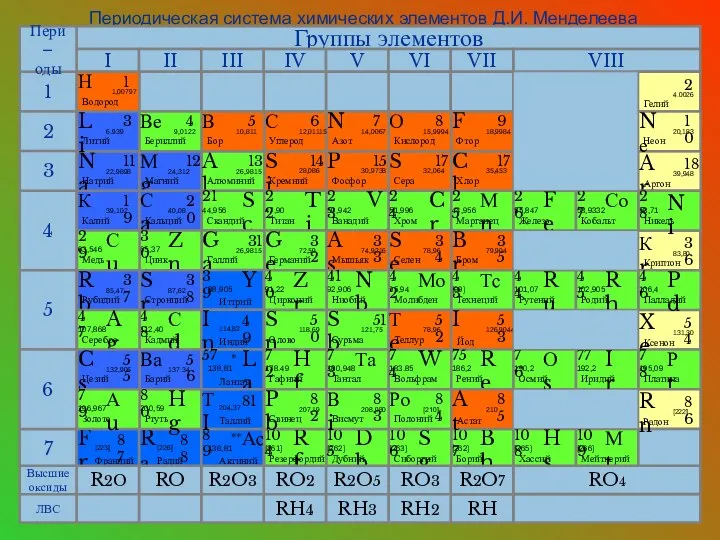
- 10. Периодическая система химических элементов Д.И. Менделеева
- 12. Газообразные вещества неметаллы: О2 - N2 - H2 - Cl2 - F2 -
- 13. N2 Cl2 F2 В начало
- 14. благородные газы: He - Ne - Ar - Kr - Xe - Rn - Инертные газы
- 15. Строение внешнего электронного слоя атомов гелия и неона +2 He ) 2 +10 Ne ) )
- 16. Применение гелия, неона и аргона.
- 17. Единственное жидкое вещество - Br2.
- 18. Твердые вещества: S – P – I2 – C – Si -
- 19. Аллотропия – способность атомов одного химического элемента образовывать несколько простых веществ. Причины аллотропии: Различное число атомов
- 20. Аллотропия кислорода. Кислород и озон
- 21. Модификации кислорода. О2- кислород; бесцветный газ; не имеет запаха; плохо растворим в воде; температура кипения-182,9 С;
- 22. Аллотропия фосфора. Красный и белый фосфор Р (красный фосфор) (белый фосфор) Р4
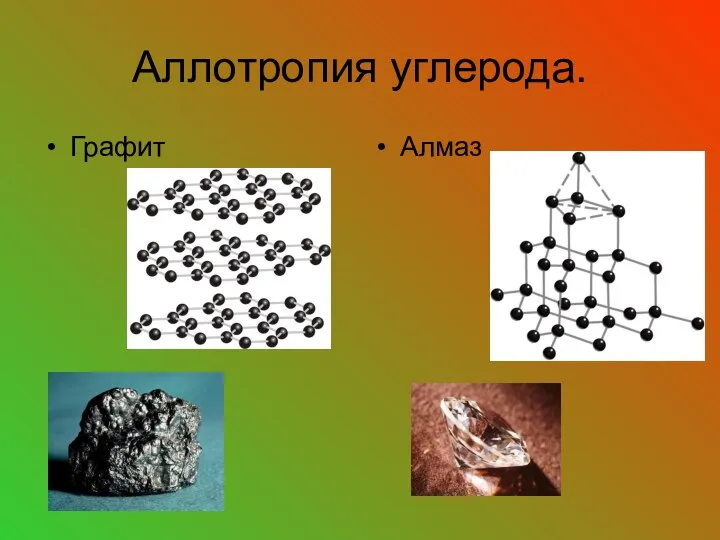
- 23. Аллотропия углерода. Графит Алмаз
- 24. Аллотропия серы. Кристаллическая, пластическая и моноклинная
- 25. Пограничное положение между металлами и неметаллами. Белое олово металл Серое олово неметалл
- 26. Почему химически неверно поэтическое выражение: «В воздухе пахло грозой»?
- 27. Экспедиция полярного исследователя Р. Скотта к Южному полюсу в 1912 году погибла из-за того, что потеряла
- 28. Какой тип химической связи должен быть в металлическом водороде?
- 29. Выполните задание. 1 вариант О2 – кислород, газ; Р4 – I2 – Si – бетта Sn
- 30. Проверь ответы. 1 вариант О2 – кислород, газ; Р4 – белый фосфор,твёрдый; I2 – йод, твердый
- 31. Критерии оценок 8 правильных ответов – «5»; 7,6 првильных ответов – «4»; 5,4 правильных ответов –
- 33. Скачать презентацию



























 Алмаз, бриллиант
Алмаз, бриллиант Путешествие по морю
Путешествие по морю Генетические ряды неорганических веществ
Генетические ряды неорганических веществ Кондуктометрический анализ
Кондуктометрический анализ Спирты и фенолы
Спирты и фенолы Гелий. История открытия
Гелий. История открытия Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами
Коалесцирующие фильтры. Моделирование процесса разделения отходов углеводородов коалесцирующими фильтрами Комплексные соединения
Комплексные соединения Конкурс О, химия – ты муза вдохновения!
Конкурс О, химия – ты муза вдохновения! Презентация на тему Химия и повседневная жизнь человека
Презентация на тему Химия и повседневная жизнь человека  Пидорасня
Пидорасня Презентация по Химии "Ковалентная химическая связь"
Презентация по Химии "Ковалентная химическая связь"  Натуральные и синтетические каучуки
Натуральные и синтетические каучуки Развитие химии
Развитие химии Гидролиз. Виды гидролиза
Гидролиз. Виды гидролиза Химические средства защиты растений
Химические средства защиты растений Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C
Материаловедение. Технология конструкционных материалов. Диаграмма состояния Fe-Fe3C 12 принципов зелёной химии
12 принципов зелёной химии Презентация на тему Закон постоянства состава
Презентация на тему Закон постоянства состава  Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Спирты и фенолы
Спирты и фенолы Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Альдегиды (номенклатура и изомерия)
Альдегиды (номенклатура и изомерия) Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Классификация органических соединений
Классификация органических соединений Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Стеклообразование, структура и свойства стекол системы Na2O – B2O3 – SiO2 на основе комплексного борсодержащего сырья
Стеклообразование, структура и свойства стекол системы Na2O – B2O3 – SiO2 на основе комплексного борсодержащего сырья