Содержание
- 2. Актуальность и обоснование работы В связи с развитием резистентности микроорганизмов к традиционным антибиотикам необходимы новые антимикробные
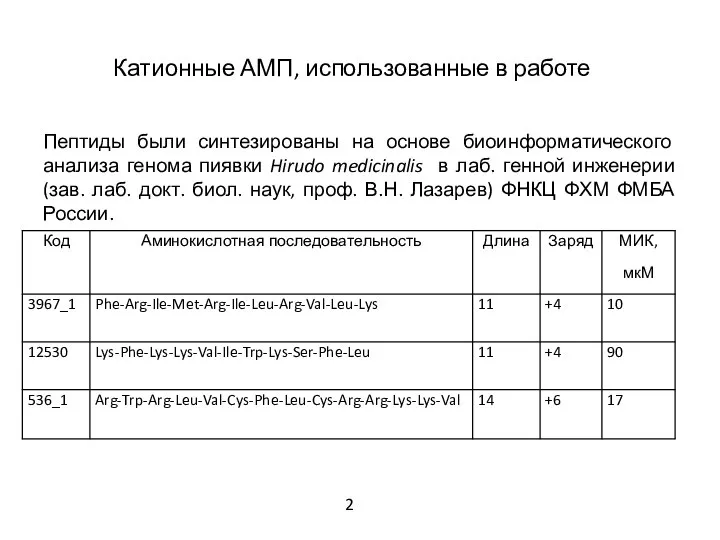
- 3. Катионные АМП, использованные в работе Пептиды были синтезированы на основе биоинформатического анализа генома пиявки Hirudo medicinalis
- 4. Цели и задачи исследования Цель Исследование взаимодействия между пептидами и нейтрофилами на трех уровнях: Целая клетка
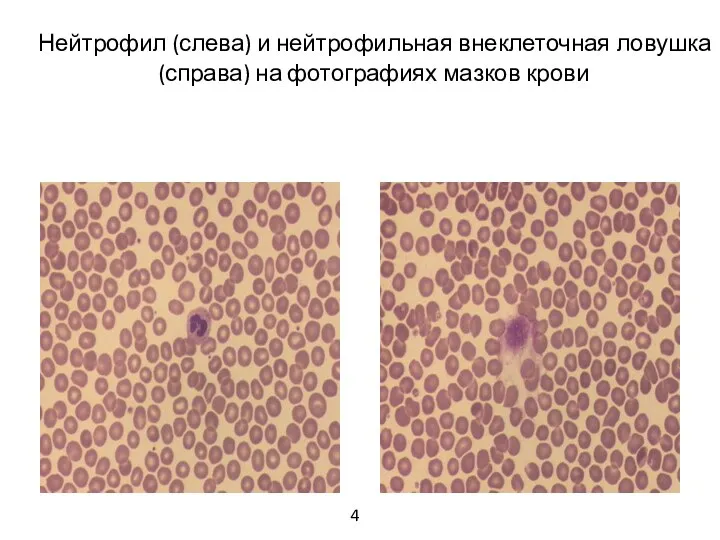
- 5. Нейтрофил (слева) и нейтрофильная внеклеточная ловушка (справа) на фотографиях мазков крови 4
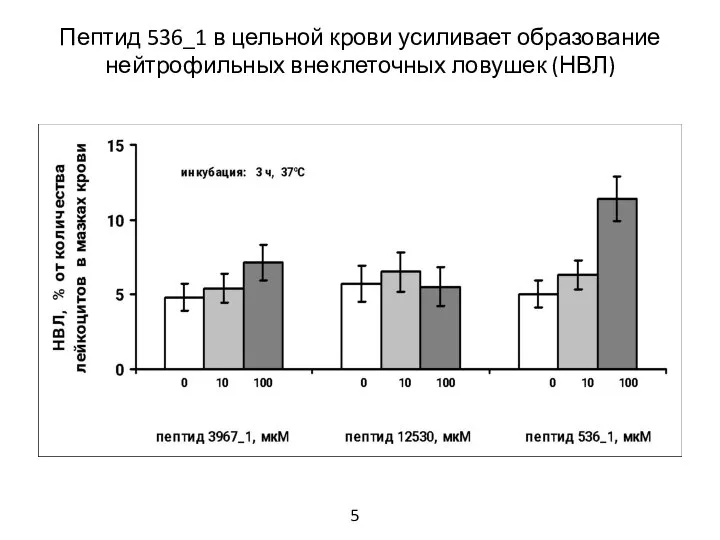
- 6. Пептид 536_1 в цельной крови усиливает образование нейтрофильных внеклеточных ловушек (НВЛ) 5
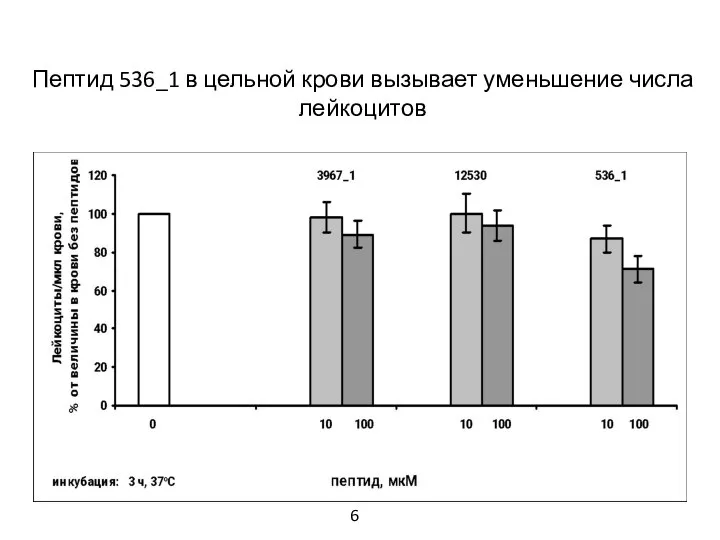
- 7. Пептид 536_1 в цельной крови вызывает уменьшение числа лейкоцитов 6
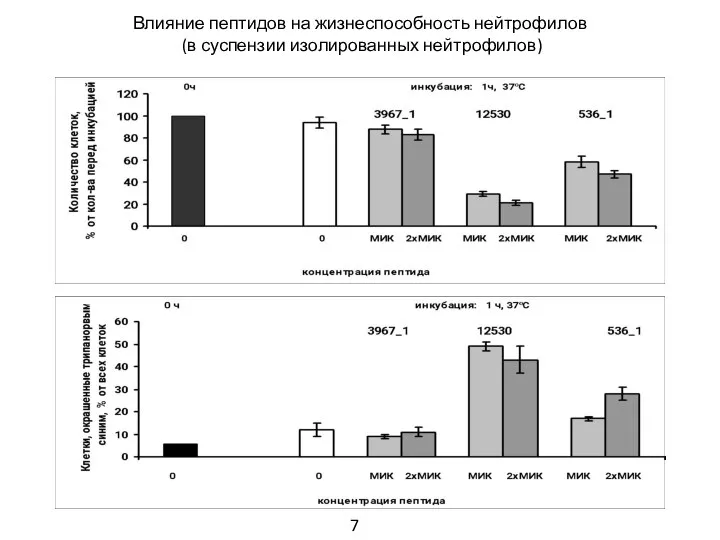
- 8. Влияние пептидов на жизнеспособность нейтрофилов (в суспензии изолированных нейтрофилов) 7
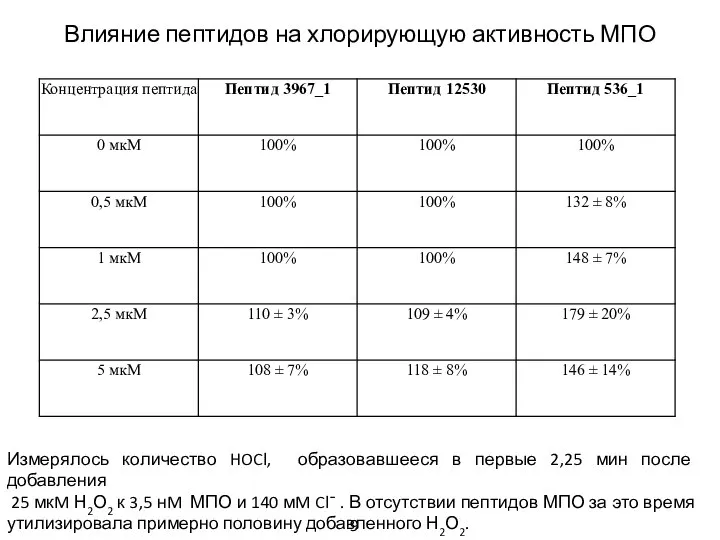
- 9. Оценка хлорирующей активности МПО Метод taurine chloramine assay [Kettle, 1994]. Метод основан на реакции HOCl с
- 10. Влияние пептидов на хлорирующую активность МПО Измерялось количество HOCl, образовавшееся в первые 2,25 мин после добавления
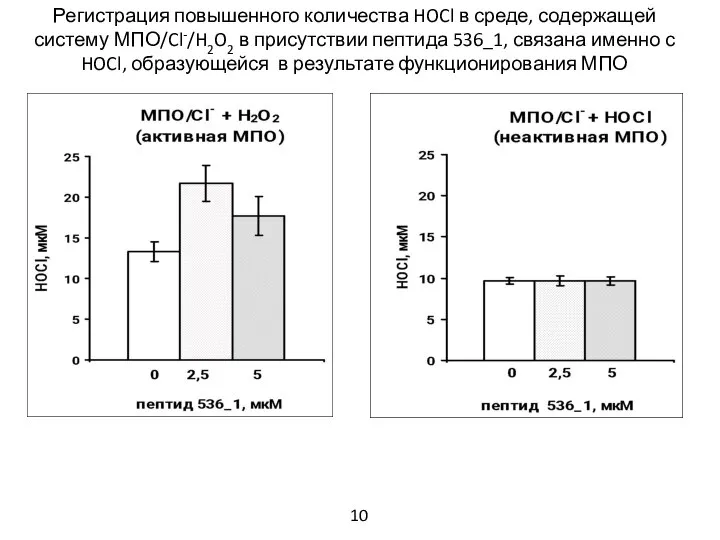
- 11. Регистрация повышенного количества HOCl в среде, содержащей систему МПО/Cl-/H2O2 в присутствии пептида 536_1, связана именно с
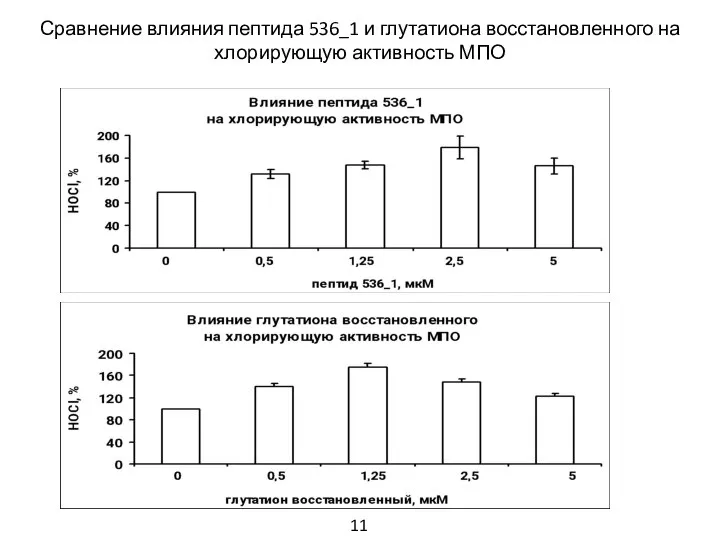
- 12. Сравнение влияния пептида 536_1 и глутатиона восстановленного на хлорирующую активность МПО 11
- 13. Влияние пептидов на пероксидазную активность МПО Влияния не было обнаружено. Пероксидазная активность МПО измерялась с использованием
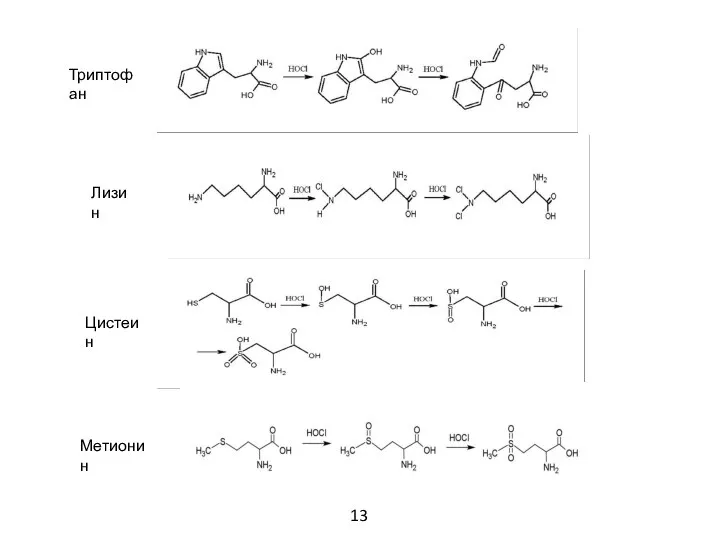
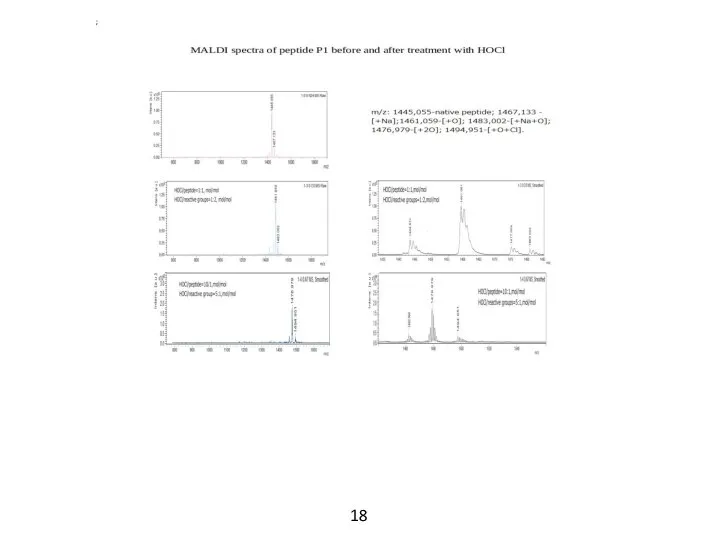
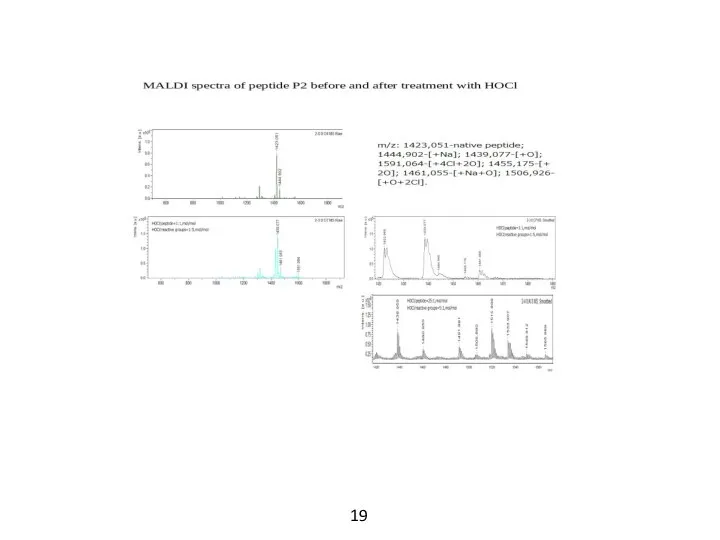
- 14. MALDI-масс-спектрометрия Если предполагать использование АМП в качестве медицинского препарата, то следует учитывать, что вследствие наличия в
- 15. Триптофан Лизин Цистеин Метионин 13
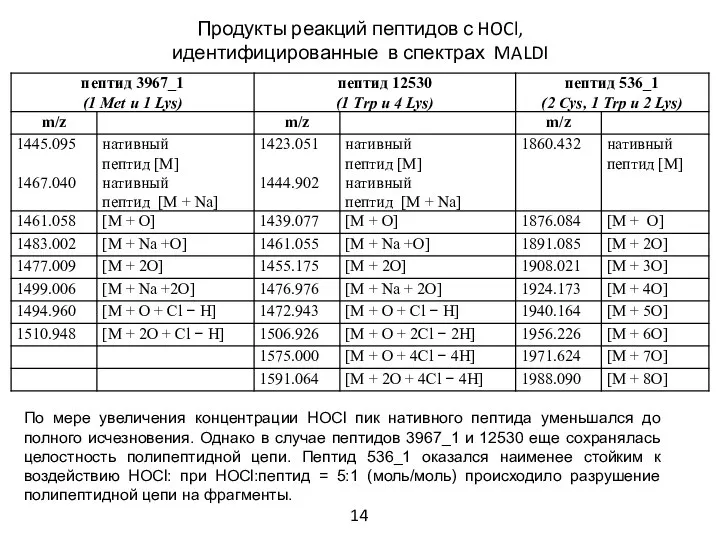
- 16. Продукты реакций пептидов с HOCl, идентифицированные в спектрах MALDI По мере увеличения концентрации HOCl пик нативного
- 17. 1. В цельной крови пептид 536_1 усиливал образование нейтрофильных внеклеточных ловушек и вызывал уменьшение числа лейкоцитов.
- 18. Результаты работы были представлены на 3-ем Сеченовском Международном Биомедицинском Саммите: E.A. Menyaylo et al. Novel cationic
- 19. Благодарности Сотрудникам лаборатории физико–химических методов исследования и анализа, Д. С. Матюшкиной (лаб. простых систем) за помощь
- 20. 18
- 21. 19
- 23. Скачать презентацию


![Оценка хлорирующей активности МПО Метод taurine chloramine assay [Kettle, 1994]. Метод основан](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1094152/slide-8.jpg)





 Голосеменные растения
Голосеменные растения Руководства по номенклатуре грызунов
Руководства по номенклатуре грызунов Школьный кабинет биологии, его значение в обучении и воспитании. Принципы подбора и хранения разнообразных средств наглядности
Школьный кабинет биологии, его значение в обучении и воспитании. Принципы подбора и хранения разнообразных средств наглядности Сохраним мир птиц
Сохраним мир птиц Бобр - крупный грызун
Бобр - крупный грызун Путешествие по страницам Красной книги
Путешествие по страницам Красной книги Организация работы и отдыха
Организация работы и отдыха Химический состав клетки
Химический состав клетки Тип моллюски
Тип моллюски Бездер қалай жұмыс жасайды?
Бездер қалай жұмыс жасайды? Водоплавающие жители водоема
Водоплавающие жители водоема Презентация на тему Горох Менделя
Презентация на тему Горох Менделя  Филогенез размножения
Филогенез размножения Презентация на тему МИКРОЭВОЛЮЦИЯ, ВИД, КРИТЕРИИ И СТРУКТУРА
Презентация на тему МИКРОЭВОЛЮЦИЯ, ВИД, КРИТЕРИИ И СТРУКТУРА  Генетический код
Генетический код Работа скелетных мышц и их регуляция
Работа скелетных мышц и их регуляция стафилокок (1)
стафилокок (1) Эхинококкозы. Альвеококк
Эхинококкозы. Альвеококк Химический состав растений
Химический состав растений Пингвины. Ареал распространения. Образ жизни
Пингвины. Ареал распространения. Образ жизни Семь основных таксономических категорий
Семь основных таксономических категорий Гимнастика Цигун. Кроссворд Анализатор слуха и равновесия
Гимнастика Цигун. Кроссворд Анализатор слуха и равновесия Опорно-двигательная система человека
Опорно-двигательная система человека Нарушения теплового баланса
Нарушения теплового баланса Куди ми втрачаємо воду. Краплина
Куди ми втрачаємо воду. Краплина Профилактика паразитарных заболеваний
Профилактика паразитарных заболеваний Домашние животные
Домашние животные Миниатюрные фиалки
Миниатюрные фиалки