Слайд 2Трофобластический бета-глобулин
Трофобластический бета-глобулин (ТБГ) был выделен наряду с другими белками беременности более 40

лет тому назад. Наибольшее значение в качестве онкомаркера ТБГ имеет в диагностике трофобластической болезни (пузырного заноса), в акушерской практике – как раннего маркера беременности.
В отечественной и зарубежной литературе данный белок фигурирует под несколькими названиями:
трофобластический бета-глобулин,
трофобласт-специфический бета-глобулин,
трофобластический бета-гликопротеин,
трофобласт-специфический бета-гликопротеид
beta-Globulin, Trophoblastic;
pregnancy Protein, SP1;
pregnancy Associated Plasma Protein C;
pregnancy Associated Plasma Protein B;
CD66f (Cluster of Differentiation 66f)
PSBG 1;
PAPPB (http://pro-analizy.ru/trofoblasticheskij-beta-globulin-tbg/)
Слайд 3ТБГ и IgG могут взаимодействовать
Ранее при определении подвижности нативного сывороточного ТБГ в

ПААГ была выявлена его неоднородность: выявлялся как быстрый (в зоне трансферрина), так и медленный (в зоне гамма-глобулинов) компоненты (Никулина Д. М., 1977). Неоднородность подвижности ТБГ может быть обусловлена его межмолекулярными взаимодействиями с IgG, которые могут быть объяснены тем, что ТБГ выполняет иммуносупрессивную функцию. Следовательно, межмолекулярные белок-белковые взаимодействия ТБГ и IgG могут быть физиологически важными и нуждаются в дополнительном изучении. В возникновении таких взаимодействий особую роль играют гидрофобные силы.
Слайд 4Цель
Цель: изучить обусловленность межмолекулярных взаимодействий ТБГ и IgG наличием на поверхности

их структур идентичных кластеров гидрофобных радикалов, которые посредством Ван-дер-Ваальсовых сил реализуют эти взаимодействия.
Слайд 5Методы
Методы:
Из базы данных белковых последовательностей Uniprot (http://www.uniprot.org/ ) была взята аминокислотная

последовательность ТБГ ( трофобластический бета-глобулин, PSBG 1, pregnancy-specific beta-1-glycoprotein), состоящая из 419 аминокислотных остатков и последовательность IgG(1352 аминокислоты). Затем на сервере I-Phyre ( http://www.sbg.bio.ic.ac.uk/phyre2/html/page.cgi?id=index ) была получена пространственная структура ТБГ. Пространственная структура IgG, полученная с помощью рентгеноструктурного анализа, была взята из базы данных белковых структур PDB (http://www.rcsb.org/pdb/home/home.do )
Визуализация и сравнительный анализ белковых последовательностей и структур был проведен с помощью программ Swiss PDB Viewer ( http://spdbv.vital-it.ch/ ) и Yasara( http://www.yasara.org/ ).
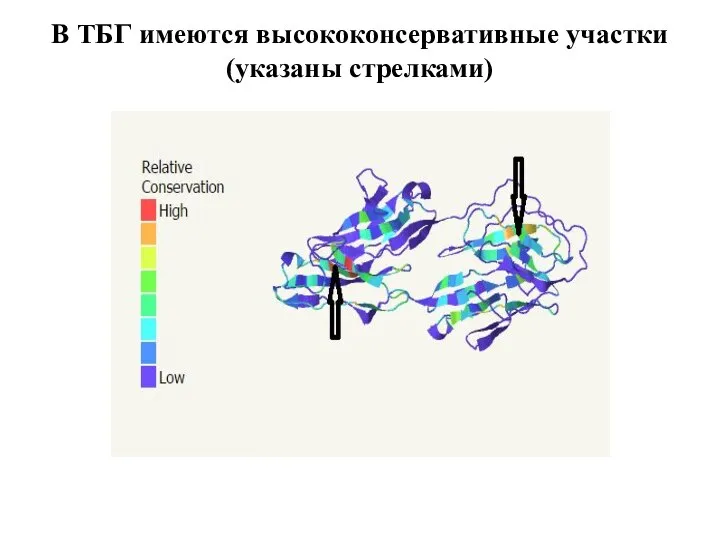
Слайд 7В ТБГ имеются высококонсервативные участки(указаны стрелками)
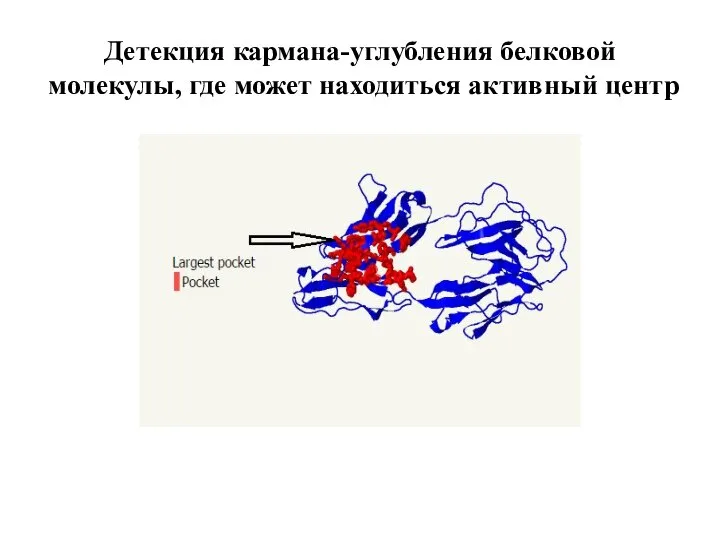
Слайд 8Детекция кармана-углубления белковой молекулы, где может находиться активный центр
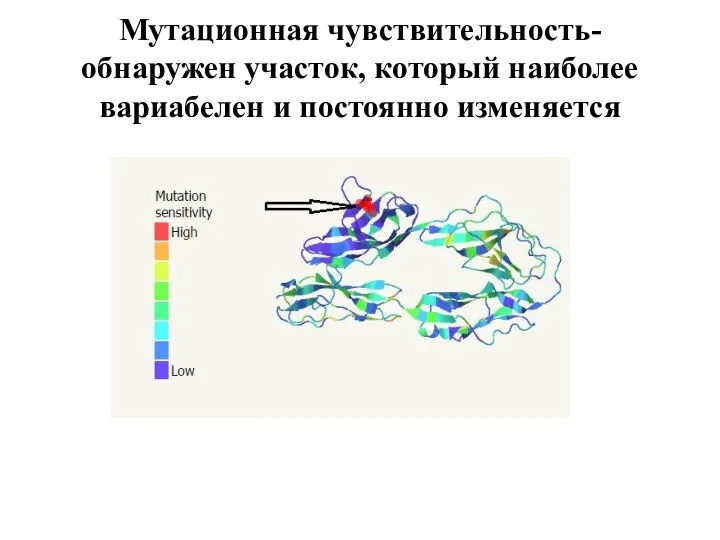
Слайд 9Мутационная чувствительность-обнаружен участок, который наиболее вариабелен и постоянно изменяется
Слайд 10Сравнение аминокислотных последовательностей ТБГ и IgG
Затем был проведен сравнительный анализ аминокислотных последовательностей

данных белков на предмет наличия в них гидрофобных аминокислот. В последовательности IgG имеется 476 амк, из них 230 неполярных(48%). В последовательности ТБГ имеется 419 аминокислот, из них 196 неполярных(47%).
В аминокислотных последовательностях изучаемых белков имеются гидрофобные кластеры аминокислот, сгруппированные по 2 и более гидрофобных аминокислоты. В белке IgG содержится 51 кластер (по 2 амк-32 кластера, по 3 амк-8, по 4 амк-2, по 5 амк-2, по 6 амк-3, по 7 амк-2, по 8 амк-1, по 10 амк-1). В белке ТБГ содержится 42 кластера( по 2 амк-24 кластера, по 3 амк-12 кластеров, по 4 амк-3 кластера, по 5 амк-2 кластера, по 6 амк-1).
Слайд 11Выводы
Выводы:
Экспериментальные данные и данные in silico могут означать, что некоторые из

гидрофобных аминокислот расположены на поверхности белков и могут обуславливать их межмолекулярные взаимодействия.









 Водный гиацинт. Влияние на него различных факторов загрязнения
Водный гиацинт. Влияние на него различных факторов загрязнения Игра Юннатское движение 2 часть
Игра Юннатское движение 2 часть Любопытные факты о животных и насекомых
Любопытные факты о животных и насекомых Семейство кленовые
Семейство кленовые Строение клетки
Строение клетки Анатомия головы
Анатомия головы Мышечные ткани
Мышечные ткани Царство животные – Animalia. Многоклеточные - Metazoa. Лекция 5. Часть 1
Царство животные – Animalia. Многоклеточные - Metazoa. Лекция 5. Часть 1 Зрительный анализатор, его строение и функции, орган зрения.
Зрительный анализатор, его строение и функции, орган зрения. ВПР. Биология. 5 класс. Задание 4.3
ВПР. Биология. 5 класс. Задание 4.3 Мейоз. Занятие 13
Мейоз. Занятие 13 Лишайники. Виды лишайников
Лишайники. Виды лишайников Род ель
Род ель Растительный организм и его особенности
Растительный организм и его особенности Толстая кишка
Толстая кишка 166e469b89784302ae0453f0e0c20791
166e469b89784302ae0453f0e0c20791 Коалы. Среда обитания
Коалы. Среда обитания embiol_2.Ovogenesis
embiol_2.Ovogenesis Царство грибов
Царство грибов Теории эволюции
Теории эволюции Грибы. Строение грибов
Грибы. Строение грибов Презентация на тему Строение семени растений
Презентация на тему Строение семени растений  Глаз как оптический прибор и зрение
Глаз как оптический прибор и зрение Проверь свои знания по экологии! Тест для дошкольников Знатоки природы
Проверь свои знания по экологии! Тест для дошкольников Знатоки природы Витамины группы B
Витамины группы B Парамфистомоз. Дикроцелиоз. Эуритрематоз
Парамфистомоз. Дикроцелиоз. Эуритрематоз Полимеразная цепная реакция и методы детекции ПЦР-продуктов
Полимеразная цепная реакция и методы детекции ПЦР-продуктов Тип Членистоногие
Тип Членистоногие