Содержание
- 2. Строение белков Белки — высокомолекулярные органические соединения, состоящие из остатков α-аминокислот. В состав белков входят углерод,
- 3. Аминокислотный состав белков Белки — непериодические полимеры, мономерами которых являются α-аминокислоты. Обычно в качестве мономеров белков
- 4. Аминокислотный состав белков В зависимости от аминокислотного состава, белки бывают: полноценными — содержат весь набор аминокислот;
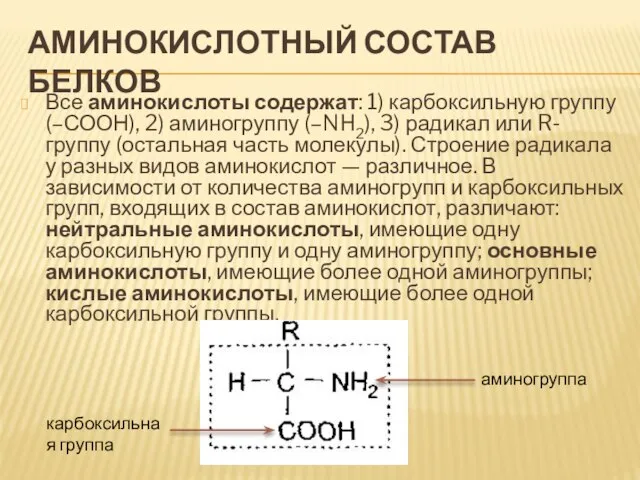
- 5. Аминокислотный состав белков Все аминокислоты содержат: 1) карбоксильную группу (–СООН), 2) аминогруппу (–NH2), 3) радикал или
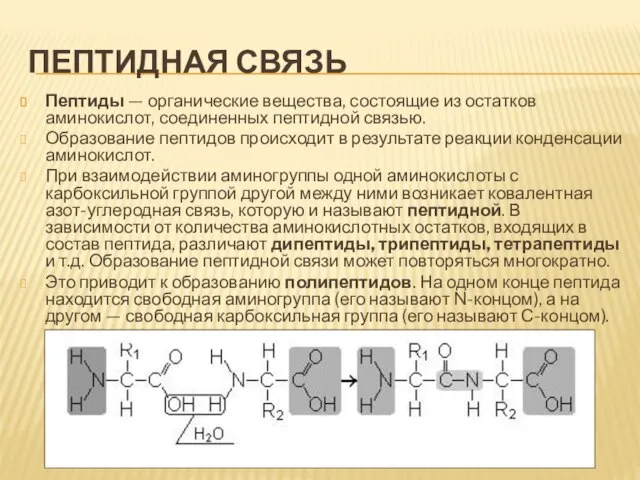
- 6. Пептидная связь Пептиды — органические вещества, состоящие из остатков аминокислот, соединенных пептидной связью. Образование пептидов происходит
- 7. Пространственная организация белковых молекул Выполнение белками определенных специфических функций зависит от пространственной конфигурации их молекул, кроме
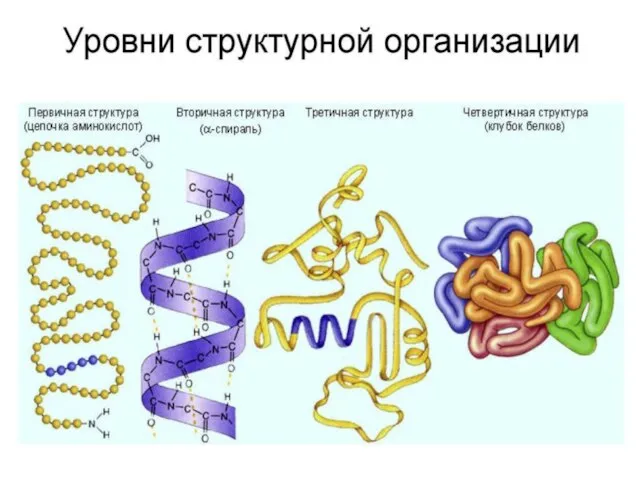
- 9. Первичная структура белка Это последовательность расположения аминокислотных остатков в полипептидной цепи, составляющей молекулу белка. Связь между
- 10. Вторичная структура Это упорядоченное свертывание полипептидной цепи в спираль (имеет вид растянутой пружины). Витки спирали укрепляются
- 11. Третичная структура укладка полипептидных цепей в глобулы, возникающая в результате возникновения химических связей (водородных, ионных, дисульфидных)
- 12. Четвертичная структура Она характерна для сложных белков, молекулы которых образованы двумя и более глобулами. Субъединицы удерживаются
- 13. Свойства белков Белки сочетают в себе основные и кислотные свойства, определяемые радикалами аминокислот: чем больше кислых
- 14. Свойства белков Внешние факторы (нагревание, ультрафиолетовое излучение, тяжелые металлы и их соли, изменения рН, радиация, обезвоживание)
- 16. Скачать презентацию










 Презентация на тему Лишайники
Презентация на тему Лишайники  Наша планета РВО
Наша планета РВО Анатомия и морфология листа
Анатомия и морфология листа Іскерлік ойын
Іскерлік ойын Гаметогенез, эмбриогенез
Гаметогенез, эмбриогенез Железо – элемент жизни
Железо – элемент жизни Мейоз. Механизм мейоза
Мейоз. Механизм мейоза PlantNet – мобильное приложение – помощник для учителя и ученика по определению видов растений
PlantNet – мобильное приложение – помощник для учителя и ученика по определению видов растений Презентация на тему ВНЕШНЕЕ СТРОЕНИЕ МЛЕКОПИТАЮЩИХ
Презентация на тему ВНЕШНЕЕ СТРОЕНИЕ МЛЕКОПИТАЮЩИХ  Шистосомоз. Географическое распространение
Шистосомоз. Географическое распространение Спинной мозг, его строение и функции
Спинной мозг, его строение и функции Фотосинтез
Фотосинтез Основные пути приспособления организмов к среде
Основные пути приспособления организмов к среде Презентация на тему СЕРДЕЧНО-СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ
Презентация на тему СЕРДЕЧНО-СОСУДИСТЫЕ ЗАБОЛЕВАНИЯ  Структура ЦНС. Свойства нервных центров
Структура ЦНС. Свойства нервных центров Классификация мутаций. Генные, хромосомные и геномные мутации
Классификация мутаций. Генные, хромосомные и геномные мутации Покрытосеменные (цветковые) растения
Покрытосеменные (цветковые) растения Урок повторения
Урок повторения Динофитовые водоросли
Динофитовые водоросли Дыхательная система
Дыхательная система лаб роб 3 мікологія
лаб роб 3 мікологія Презентация на тему ИСТОРИЯ ИЗУЧЕНИЯ КЛЕТКИ. КЛЕТОЧНАЯ ТЕОРИЯ
Презентация на тему ИСТОРИЯ ИЗУЧЕНИЯ КЛЕТКИ. КЛЕТОЧНАЯ ТЕОРИЯ  Кто такие земноводные?
Кто такие земноводные? Влияние ранневесенних заморозков на урожайность персика в условиях Республики Крым
Влияние ранневесенних заморозков на урожайность персика в условиях Республики Крым Цепи питания. 5 класс
Цепи питания. 5 класс Корень
Корень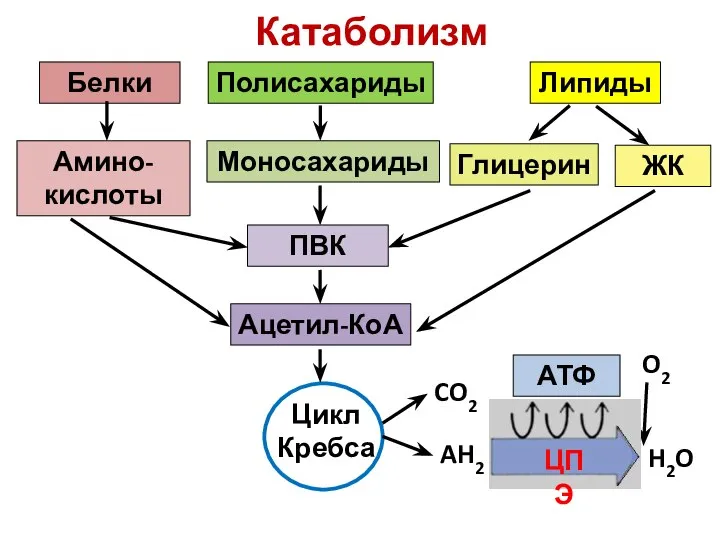 Катаболизм. Общая схема цикла Кребса
Катаболизм. Общая схема цикла Кребса ОКРУЖАЮЩИЙ МИР _САНИТАРЫ ЛЕСА_ 3 КЛАСС
ОКРУЖАЮЩИЙ МИР _САНИТАРЫ ЛЕСА_ 3 КЛАСС