Слайд 2Катаболизм гликолипидов - сфинголипидозы
Катаболизм гликолипидов обеспечивается группой специфических ферментов находящихся в

лизосомах. Это сфингомиелиназа, бета-глюктозидаза, бета-галактозилгидролаза, альфа-галактозидаза, гексозамидиназа А и В и другие.
Существует около десятка специфических лизосомных болезней накопления - сфинголипидозов (гликолипидозов).
Одним из сфинголипидозов является болень Гоше (Gaucher), наследуемая по аутосомно-рецессивному типу.
При этом заболевании происходит накопление в клетках печени селезенки, легких и др. глюкозилцерамида (цереброзида) вследствие повреждения фермента бета-глюкозидазы, разрушающего этот гликолипид на глюкозу и церамид.
Это приводит к увеличению печени и селезенки в 4-5 раз по сравнении с нормой. Развивается анемия, задерживается умственное развитие, нередки явления геморрагического диатеза, остеопороз.
В связи с инфильтрацией легких клетками Гоше появляются признаки дыхательной недостаточности. Рентгенологические изменения в легких напоминают милиарный туберкулез. Прогноз не благоприятен.
Слайд 3Гликолипидозы
При болезни Фабри (Fabri) имеет место дефект сцепленного с Х-хромосомой гена, транскрибирующего

синтез фермента альфа-галактозидазы. В результате в тканях накапливается тригликозилцерамид. Клиника болезни Фабри напоминает болезнь Гоше.
Сфинголипидоз Тей-Сакса (амавротический идиотизм, болезнь Tay-Sachs). Это заболевание сопровождается перерождением сетчатой субстанции мозга, демиелинизацией нервных волокон, слепотой, слабоумием, параличом. Заболевание связано с отсутствием фермента гексозамидиназы А, обеспечивающий катаболизм ганглиозидов типа GМ2, которые накапливаются в первую очередь в ганглиях и глиальных клетках мозга.
При болезни Нимана-Пика (Niemann-Hick) вследствие отсутствия фермента сфингомиелиназы, разрушающего сфингомиелины, они накапливаются в клетках ретикулоэндотелиальной системы, в клетках нервной ткани, что ведет к резкому отставанию ребенка в нервно-психическом развитии, появлении глухоты и слепоты
Терапия сфинголипидозов введением недостающих лизосомальных ферментов может быть благоприятной, если начать лечение с очень раннего детского возраста.
Слайд 5Главным источником для синтеза холестерина является ацетил-КоА, и до стадии образования β-гидрокси-β-метилглутарил-КоА
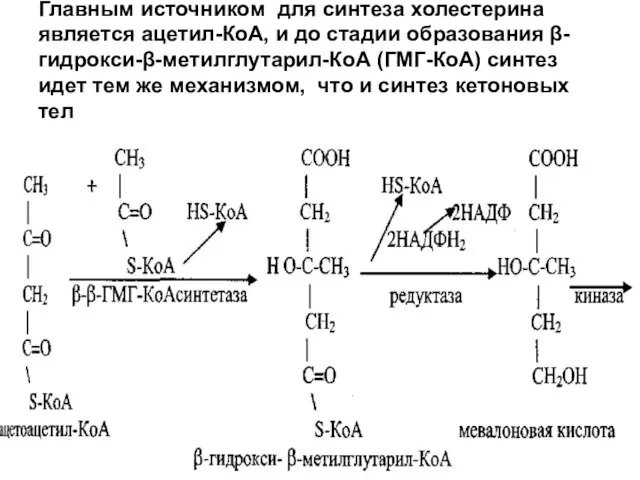
(ГМГ-КоА) синтез идет тем же механизмом, что и синтез кетоновых тел
Слайд 6Под воздействием мевалонат киназы с использованием двух молекул АТФ образуется мевалонилпирофосфат, при
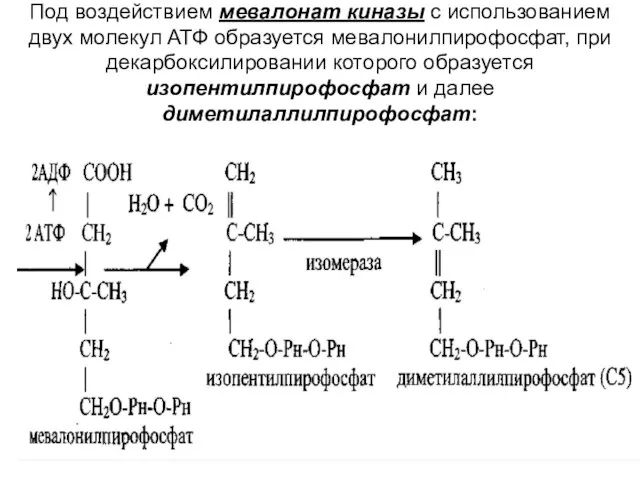
декарбоксилировании которого образуется изопентилпирофосфат и далее диметилаллилпирофосфат:
Слайд 8Печень является основным органом, в котором интенсивно идет синтез холестерина (80%).
В

меньшей степени холестерин синтезируется в надпочечниках, яичниках, семенниках, в коже и в стенке кишечника.
Ферменты необходимые для синтеза холестерина имеются во всех клетках, кроме зрелых эритроцитов.
За сутки в печени синтезируется 1,5 - 4,0 грамм холестерина (в среднем 2,0 гр.).
Слайд 9На интенсивность синтеза холестерина в печени влияет количество экзогенного холестерина поступающего с

пищей.
При снижении уровня холестерина в пище скорость синтеза холестерина в печени возрастает и наоборот.
Усиление синтеза холестерина в печени наблюдается при потреблении большого количества жиров, как источника ацетил-КоА, который служит источником
для синтеза не только жирных кислот и кетоновых тел, но и холестерина.
Слайд 10Скорость синтеза холестерина регулируется по механизму отрицательной обратной связи.
Основным пунктом регуляции

является фермент, синтезирующий мевалоновую кислоты - ГМГ-КоА-редуктаза.
Холестерин ингибирует этот фермент собственного синтеза.
Так при содержании 2-3 гр. холестерина в суточной пище человека синтез собственного холестерина почти полностью прекращается.
Слайд 11Если холестерин в пище полностью отсутствует,
то его синтез в тканях

происходит с максимальной скоростью.
Чем больше поступление холестерина с пищей,
тем меньше синтезируется холестерин в тканях и
тем большую долю экскретируемого из организма холестерина составляет холестерин пищи.
Слайд 12 В печени из холестерина синтезируются желчные кислоты.
Образование желчных кислот включает

реакции гидроксилирования и реакции частичного окисления боковой цепи холестерина.
Первым этапом биосинтеза желчных кислот является 7α-гидроксилирование холестерина микросомальной 7α-гидроксилазой при участии кислорода, НАДФН2, цитохрома Р450 и витамина С. На этой стадии синтезируется 7α-гидроксихолестерол.
Слайд 13При недостатке витамина С образование желчных кислот на стадии 7α-гидроксилирования тормозится, что

приводит к накоплению холестерина и развитию атеросклероза и др.
Слайд 14Желчные кислоты участвуют
в эмульгировании жиров в кишечнике и во всасывании продуктов

их переваривания
Вследствие этого, основная часть желчных кислот из полости кишечника всасывается в клетки, с кровью воротной вены попадает в печень и повторно используется при образовании желчи.
Небольшая часть желчных кислот (0,5г за сутки) выводится из организма с калом.
Слайд 15В составе смешанных мицелл с желчными кислотами выводится и холестерин.
В пузырной

и печеночной желчи холестерин находится в этерифицированной форме, будучи включенной макромицелу липидного комплекса.
В кишечнике при разрушении этого комплекса происходит освобождение холестерина и его частичная реабсорбция.
Слайд 16На реабсорбцию холестерина в стенку кишечника влияют желчные кислоты, активность холэстеразы, наличие

пищевых белков, лактозы и другие факторы
Не всосавшийся в стенку кишечника холестерин под воздействием ферментов кишечной микрофлоры гидрируется до копростерина и выводится из организма в составе каловых масс.
Общее количество холестерина выводимого из организма с калом в составе желчи и в виде желчных кислот за сутки составляет у взрослого человека около 1,3 гр.
Слайд 17 В нормальном стационарном состоянии суммарное количество холестерина, поступающего в кишечник с

пищей, и холестерина, синтезированного в тканях, должно быть равно суммарному количеству экскретируемого холестерина и холестерина превращенного и экскретируемого в виде желчных кислоты:
ХОЛ( пищ ) + ХОЛ(синт) = ХОЛ(экскр) + Желч.кисл.(экскр)
Одним из последствий нарушения этого баланса является гиперхолестеринемия, последствиями которой являются желчекаменная болезнь, ишемическая болезнь сердца и атеросклероз.
Слайд 18При желчекаменной болезни в желчном пузыре или желчных протоках образуются камни в

результате осаждения и кристаллизации компонентов желчи - холестерина и билирубина.
Обычно в желчных камнях основная масса приходится на холестерин. Образование холестериновых камней, как следствие дестабилизации жидкокристаллической формы холестерина, происходит вследствие увеличения количества холестерина в составе желчи и уменьшения синтеза или экскреции желчных кислот.
Осаждению холестерина способствует застой желчи, воспалительные заболевания желчного пузыря и протоков.
Центрами кристаллизации холестерина могут служить конгломераты белка или слущивающиеся клетки эпителия.
















 Витамины и их роль в жизни человека
Витамины и их роль в жизни человека Орган слуха и равновесия
Орган слуха и равновесия Влияние сок алоэ на рост и развитие корней и листьев лука
Влияние сок алоэ на рост и развитие корней и листьев лука Вегетативная нервная система человека
Вегетативная нервная система человека Проверочная работа Скелетные соединительные ткани
Проверочная работа Скелетные соединительные ткани Дыхательная система
Дыхательная система Основные законы Менделя
Основные законы Менделя Зубастый олень
Зубастый олень Компонент деяких ферментів, гормонів
Компонент деяких ферментів, гормонів Тип Кольчатые черви Annellida
Тип Кольчатые черви Annellida Анабиоз. Исследовательская работа
Анабиоз. Исследовательская работа Физиология человека: динамические показатели нервных процессов
Физиология человека: динамические показатели нервных процессов Кожа человека
Кожа человека Физическое развитие, индивидуальные особенности внешнего облика в подростковый период. Различия в развитии мальчиков и девочек
Физическое развитие, индивидуальные особенности внешнего облика в подростковый период. Различия в развитии мальчиков и девочек Общая характеристика типа Членистоногие. Класс Ракообразные
Общая характеристика типа Членистоногие. Класс Ракообразные Происхождение груши
Происхождение груши 05. Биосинтез белков в живой клетке
05. Биосинтез белков в живой клетке Многоугольные кости
Многоугольные кости Тип Кольчатые черви. Классы кольчатых червей
Тип Кольчатые черви. Классы кольчатых червей Продолжительность жизни вида. Кривые выживания, их типы
Продолжительность жизни вида. Кривые выживания, их типы Анатомо - морфологические особенности и основные физиологические функции организма
Анатомо - морфологические особенности и основные физиологические функции организма Генетика поведения. DRD4
Генетика поведения. DRD4 Асиміляція чи дисиміляція
Асиміляція чи дисиміляція Презентация на тему Игра «Звёздный час» на тему «животные и птицы»
Презентация на тему Игра «Звёздный час» на тему «животные и птицы»  Прогулка по лесу. Внеклассное занятие
Прогулка по лесу. Внеклассное занятие Презентация на тему Состав почвы
Презентация на тему Состав почвы  Подтип Жгутиконосцы
Подтип Жгутиконосцы Особенности слухового восприятия. 8 класс
Особенности слухового восприятия. 8 класс