Содержание
- 8. Применение денатурирующих агентов в биологических исследованиях и медицине В медицине денатурирующие агенты часто используют для стерилизации
- 9. Значительное количество антисептиков представлено солями тяжёлых металлов. Их антимикробное действие связано с тем, что уже в
- 10. Классификация белков по форме молекул по молекулярной массе по химическому строению по функциям по локализации в
- 11. ПРОСТЫЕ И СЛОЖНЫЕ БЕЛКИ ПОЛОСТИ РТА
- 12. •Коллаген—фибриллярный белок •обладает огромной прочностью и практически не растяжим (прочнее стальной проволоки того же сечения, он
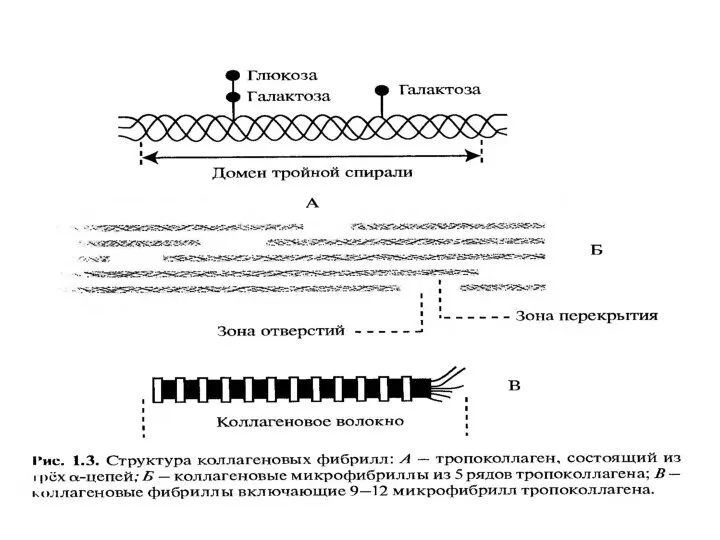
- 13. Субъединицей коллагена является тропоколлаген тропоколлаген состоит из 3 α-цепей. Известно около 30 видов α-цепей Большинство α-цепей
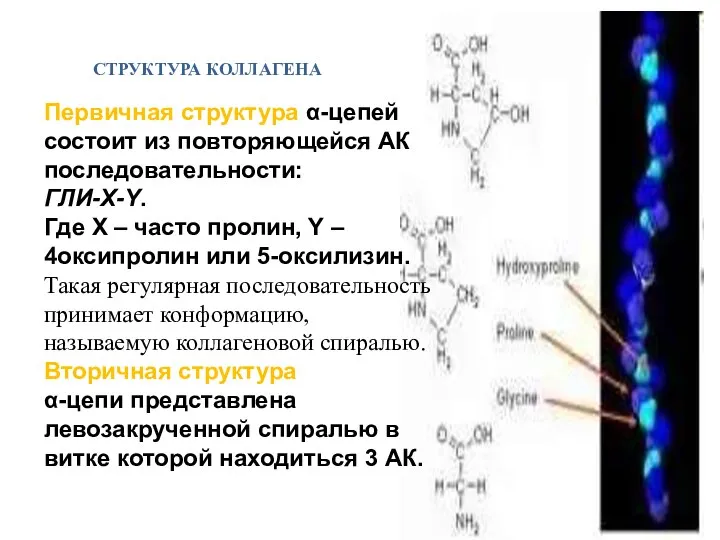
- 14. Первичная структура α-цепей состоит из повторяющейся АК последовательности: ГЛИ-X-Y. Где X – часто пролин, Y –
- 15. Четвертичная структура 3 α-цепи скручиваются друг с другом в правозакрученную суперспираль тропоколлагена. Она стабилизируется водородными связями,
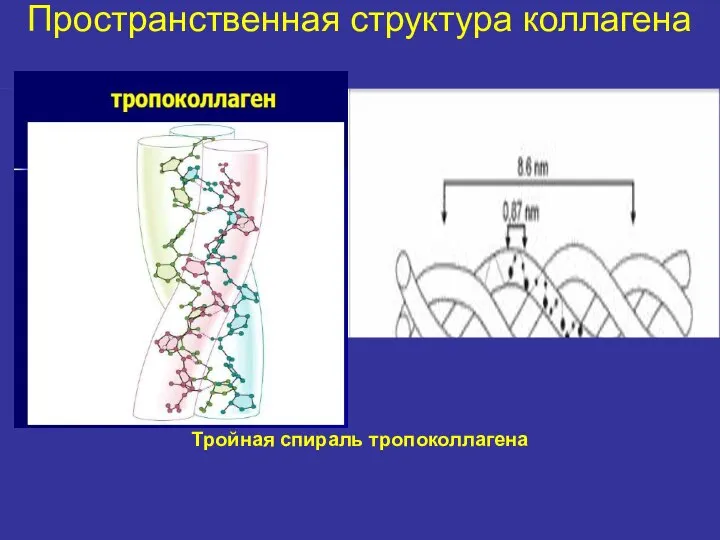
- 16. Пространственная структура коллагена Тройная спираль тропоколлагена
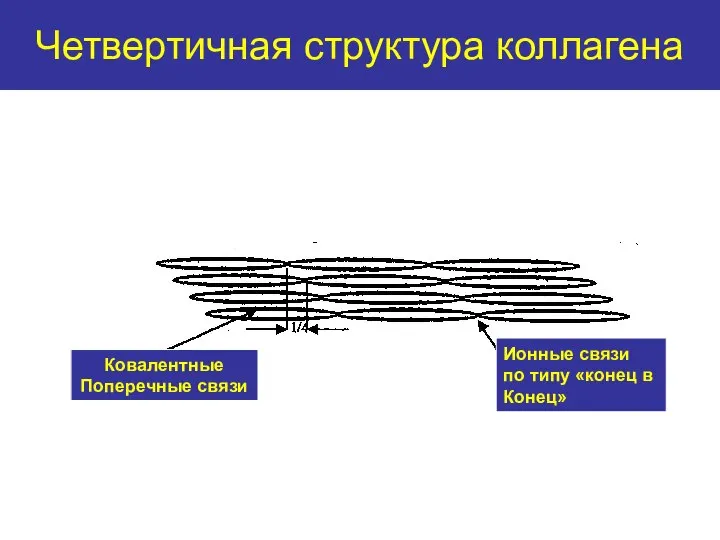
- 17. Четвертичная структура коллагена Ковалентные Поперечные связи Ионные связи по типу «конец в Конец»
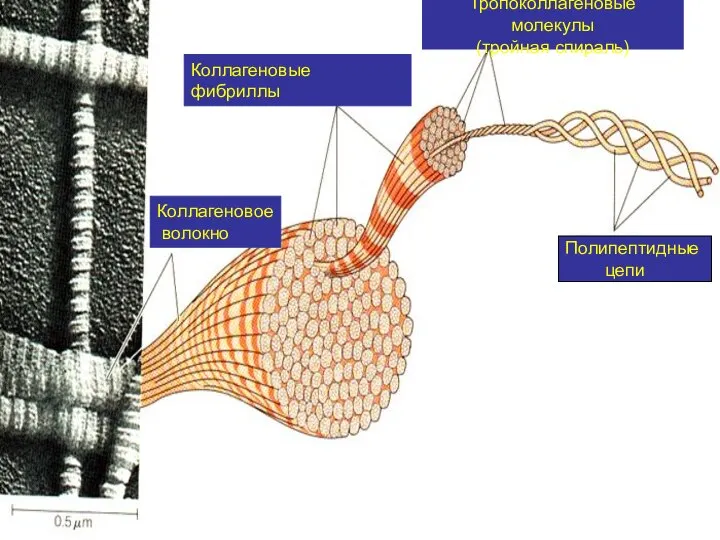
- 18. Полипептидные цепи Тропоколлагеновые молекулы (тройная спираль) Коллагеновые фибриллы Коллагеновое волокно
- 20. На сегодняшний день известно свыше 28 генетических типов коллагена которые отличаются по первичной структуре цепей, функциям
- 21. ТИПЫ КОЛЛАГЕНОВ
- 22. ТИПЫ КОЛЛАГЕНОВ ПОЛОСТИ РТА Все типы коллагенов в зависимости от структуры делятся на: Фибриллообразующие Ассоциированные с
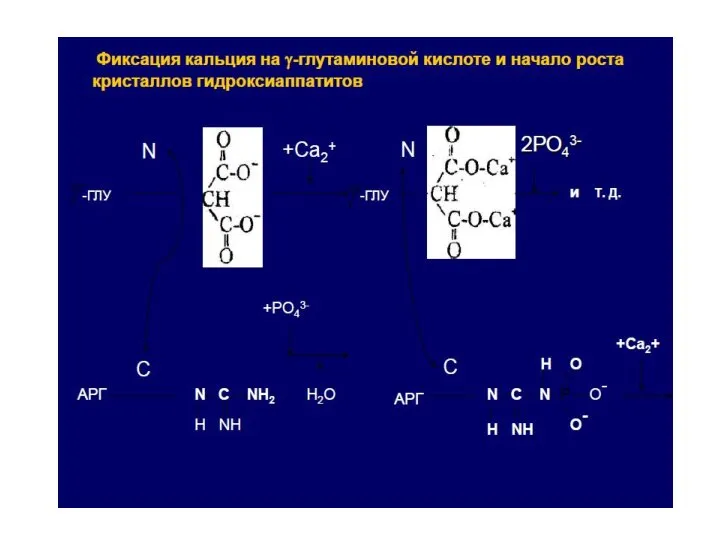
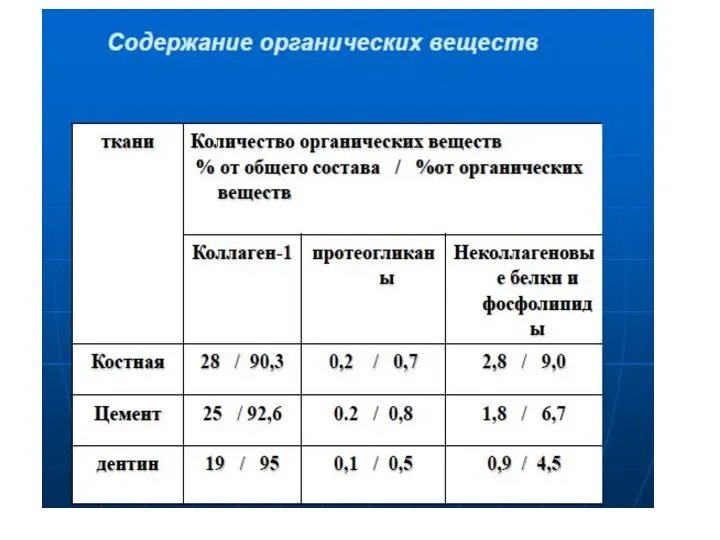
- 23. Выполняет структурную и минерализующую функцию
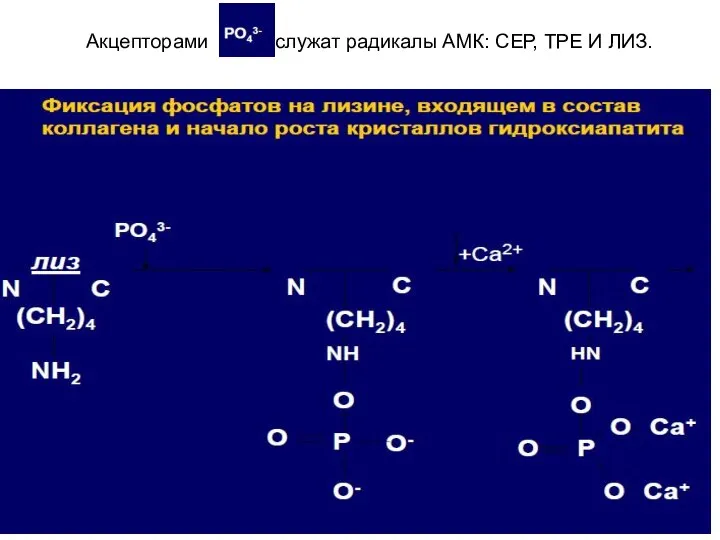
- 25. Акцепторами служат радикалы АМК: СЕР, ТРЕ И ЛИЗ.
- 26. Эластин — гликопротеин с молек. массой 70 кДа. Основной белок эластических волокон. Содержится в стенках кровеносных
- 27. Главное свойства эластических волокон – могут растягиваться в несколько раз, сохраняя при этом высокую прочность на
- 28. Аминокислотный состав эластина: - 27% глицина; - 19% аланина; - 10% валина; - 4,7% лейцина.
- 29. Первичная структура Эластина цепь из 800 АК, преобладают глицин, валин, аланин, много пролина и лизина, немного
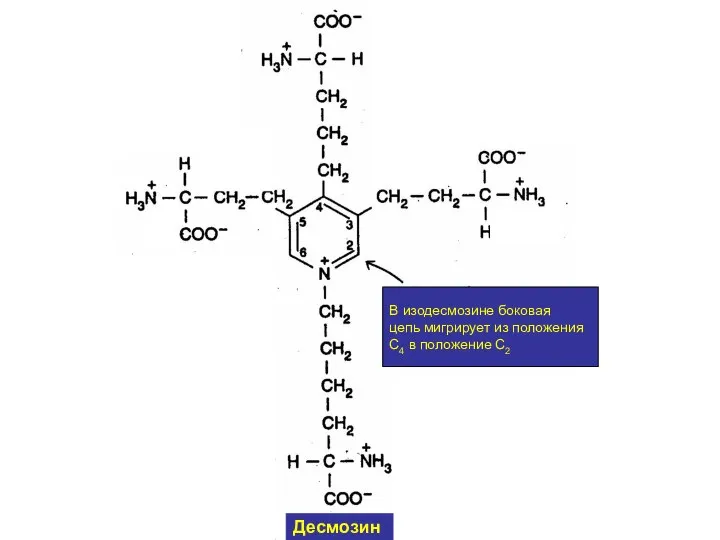
- 30. В изодесмозине боковая цепь мигрирует из положения С4 в положение С2 Десмозин
- 31. Кроме десмозинов, в образовании поперечных сшивок принимает участие лизиннорлейцин, образованный 2-мя остатками лизина: NH NH -ОС-СН-(СР2)3-СН2-NH-CH2-(CH2)3-CH-CO-
- 33. Различия между коллагеном и эластином
- 34. Свойства коллагена и эластина высокая эластичность (эластин), высокая прочность (коллаген), волокнистость, плохая растворимость в воде, высокая
- 37. Белки слюны представлены полиморфными группами: Некоторые белки существуют в единичной форме: фактор роста эпителия, фактор роста
- 38. 1. Белки, богатые пролином (ББП) Выделяются, в основном, с секретом околоушных слюнных желез. Выполняют минерализующую и
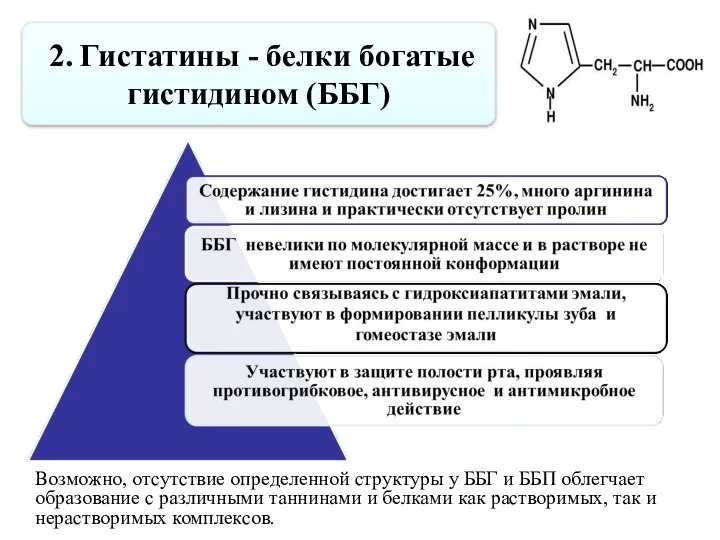
- 40. 2. Гистатины - белки богатые гистидином (ББГ) Возможно, отсутствие определенной структуры у ББГ и ББП облегчает
- 41. 3. Белки, богатые тирозином - стазерины (статерины) Это гликофосфопротеины с высоким содержанием тирозина. На N-концах молекул
- 42. 4. Цистатины - кислые низкомолекулярные белки полости рта Есть данные, что цистатины выполняют антимикробную и антивирусную
- 43. Carbohydrates and Glycobiology Glycoconjugates: Proteoglycans, Glycoproteins, and Glycosphingolipids Carbohydrates as Informational Macromolecules: the Sugar Code Fig.
- 44. Гликобиология изучает структуру и функции гликоконъюгатов; сегодня эта наука является одной из наиболее активно развивающихся областей
- 45. Гликопротеины Истинные ГП простой белок 80-90% углеводы 10-20 % нерегулярного строения: моносахариды гексозамины нейраминовая кислота сиаловая
- 46. Истинные ГП Муцины Гормоны – ФСГ, ЛГ, ТТГ Ферменты – протромбин, холинэстераза Транспортные белки- трансферрин, церулоплазмин,
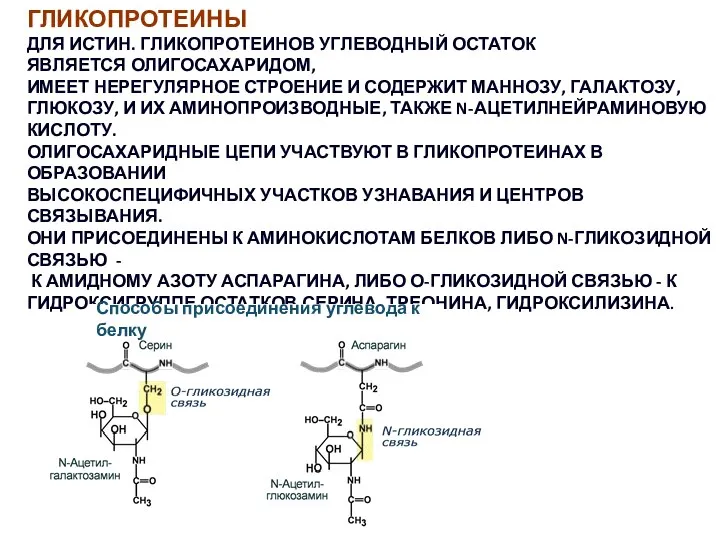
- 47. ГЛИКОПРОТЕИНЫ ДЛЯ ИСТИН. ГЛИКОПРОТЕИНОВ УГЛЕВОДНЫЙ ОСТАТОК ЯВЛЯЕТСЯ ОЛИГОСАХАРИДОМ, ИМЕЕТ НЕРЕГУЛЯРНОЕ СТРОЕНИЕ И СОДЕРЖИТ МАННОЗУ, ГАЛАКТОЗУ, ГЛЮКОЗУ,
- 48. ФУНКЦИЕЙ ГЛИКОПРОТЕИНОВ ЯВЛЯЮТСЯ: 1. Структурная –клеточная стенка бактерий, костный матрикс, например, коллаген, эластин.Протеогликаны значимы для межклеточного
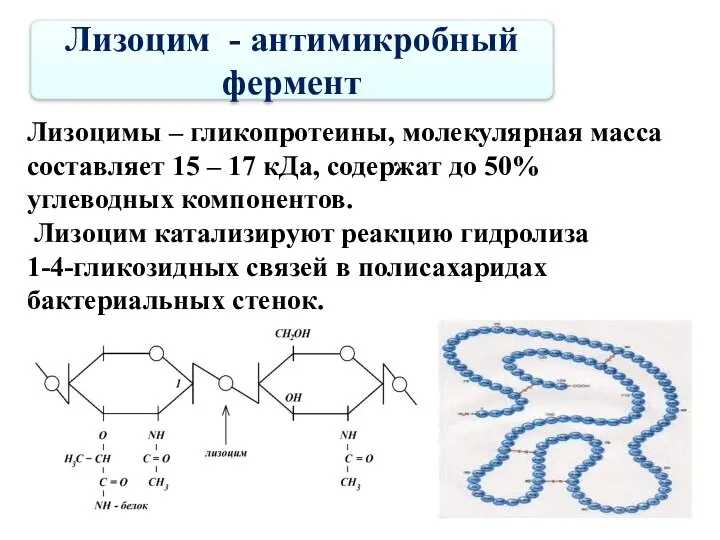
- 59. Лизоцим - антимикробный фермент Лизоцимы – гликопротеины, молекулярная масса составляет 15 – 17 кДа, содержат до
- 60. ФУНКЦИИ МУЦИНОВ В СЛИЗИСТОЙ ОБОЛОЧКЕ МУЦИНЫ - ГЛАВНЫЕ ГЛИКОПРОТЕИНЫ СЛИЗИ Муцины — главные гликопротеины слизи, покрывающей
- 61. УГЛЕВОДНО-БЕЛКОВЫЙ СОСТАВ МУЦИНОВ Углеводный состав муцинов. Около 95% массы слизи составляет вода, 1% – соли и
- 63. Белковый состав муцинов. На долю белка в муцинах приходится около 30% массы молекулы. Муцины характеризуются необычным
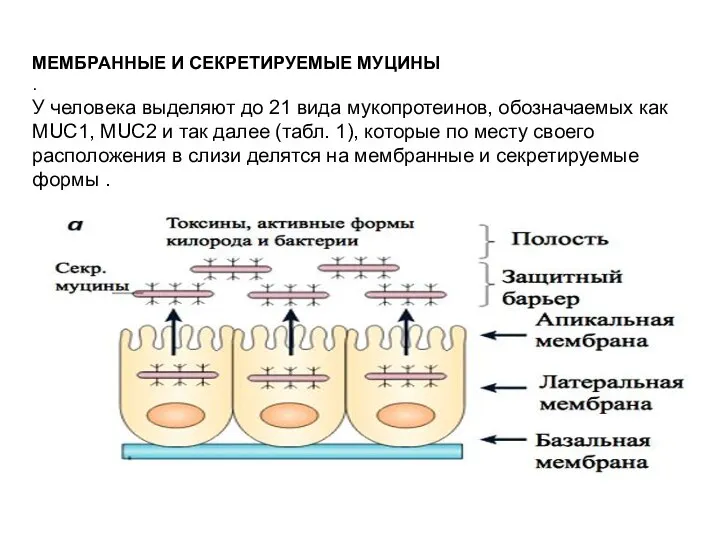
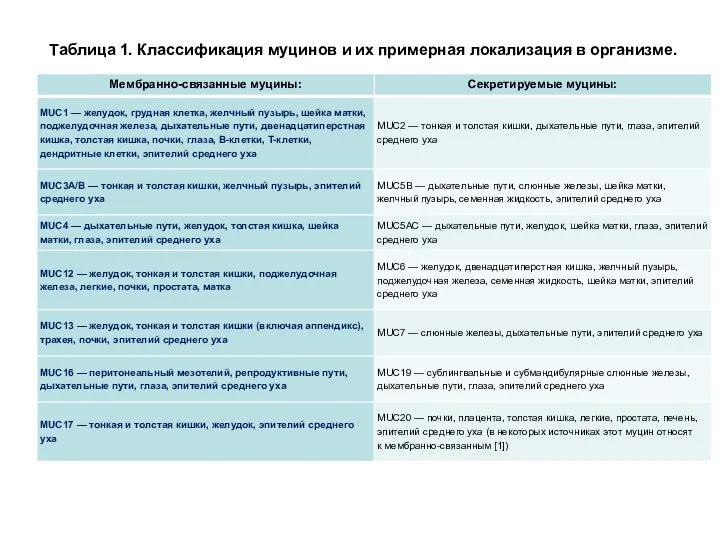
- 64. МЕМБРАННЫЕ И СЕКРЕТИРУЕМЫЕ МУЦИНЫ . У человека выделяют до 21 вида мукопротеинов, обозначаемых как MUC1, MUC2
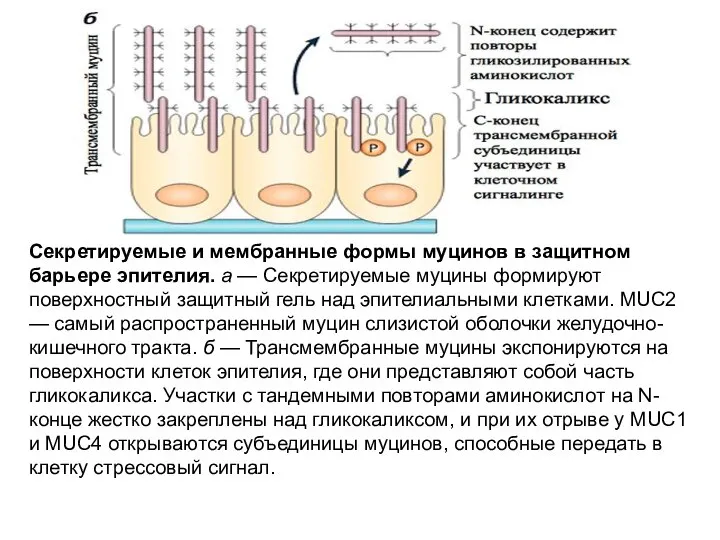
- 65. Секретируемые и мембранные формы муцинов в защитном барьере эпителия. а — Секретируемые муцины формируют поверхностный защитный
- 66. Таблица 1. Классификация муцинов и их примерная локализация в организме.
- 67. Функции муцинов
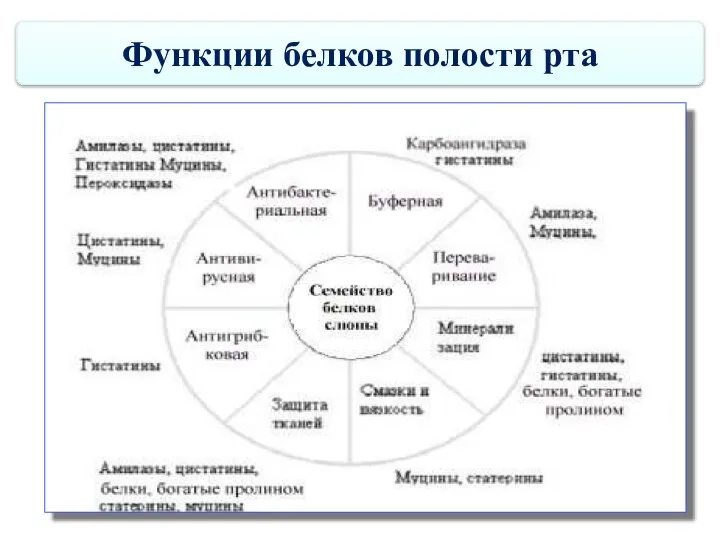
- 68. Функции белков полости рта
- 69. ГЛИКОЗАМИНОГЛИКАНЫ
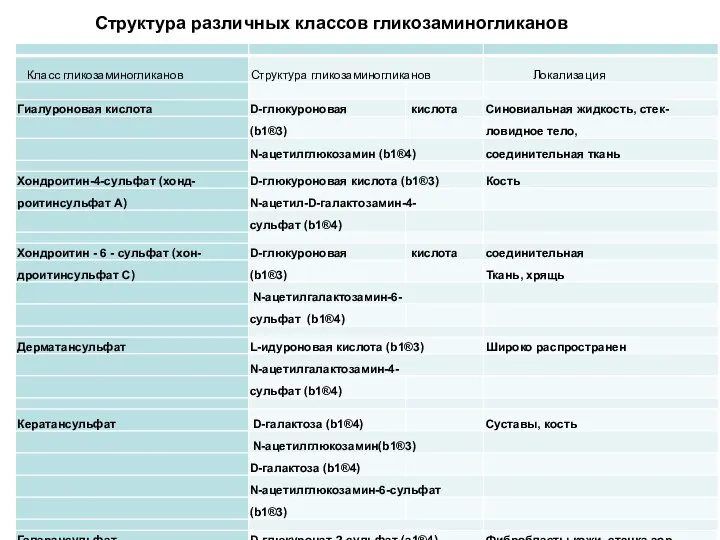
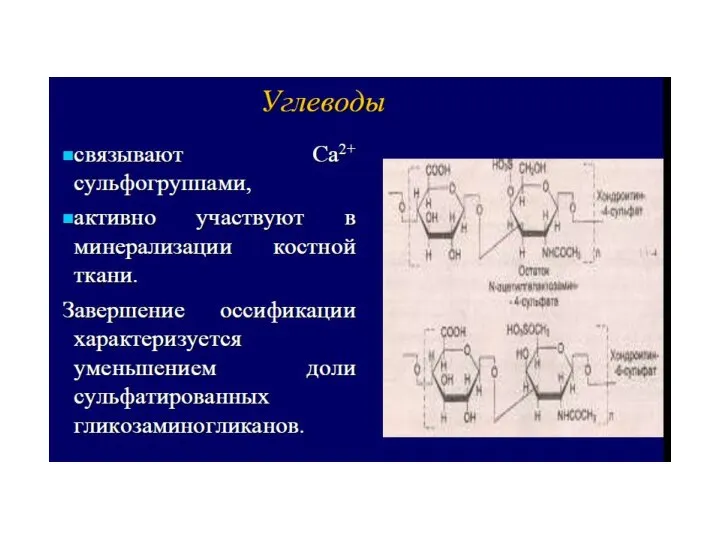
- 70. Гликозаминогликаны относятся к гетерополисахаридам. Это линейные структуры, построенные из повторяющихся дисахаридных единиц. Молекула дисахарида состоит из
- 71. Структура различных классов гликозаминогликанов
- 72. СОСТАВ ГЛЮКОЗАМИНГЛИКАНОВ Название глюкозамин- гликана Дисахаридный мономер
- 75. Протеогликаны
- 76. Протеогликаны Другая группа гликоконъюгатов, протеогликаны состоят из белковой части, к которой ковалентно присоединено несколько десятков полисахаридных
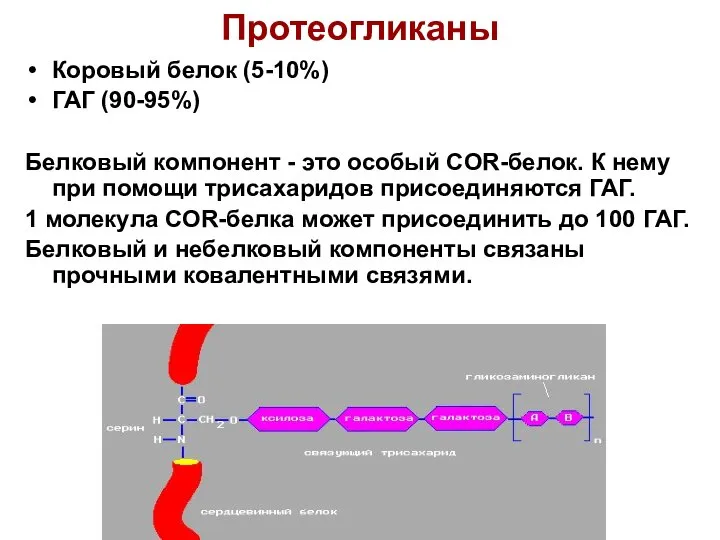
- 77. Протеогликаны Коровый белок (5-10%) ГАГ (90-95%) Белковый компонент - это особый COR-белок. К нему при помощи
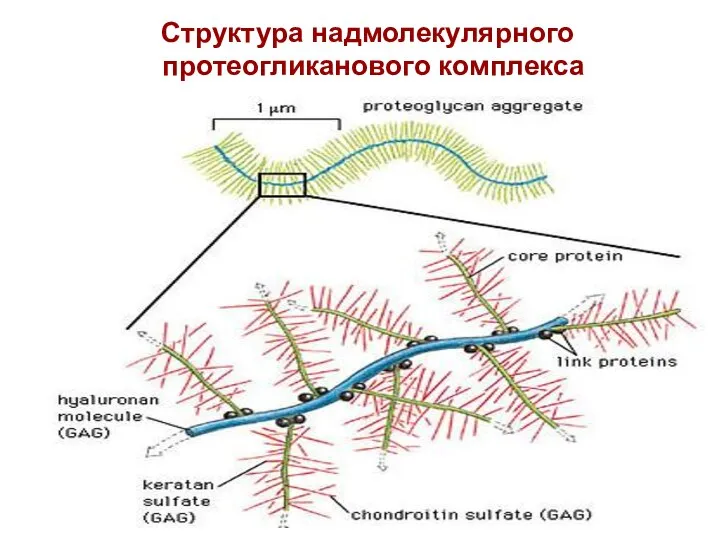
- 78. Структура надмолекулярного протеогликанового комплекса
- 79. В межклеточном пространстве протеогликаны связаны с гиалуроновой кислотой. Образуется сложный надмолекулярный комплекс. В его составе: гиалуроновая
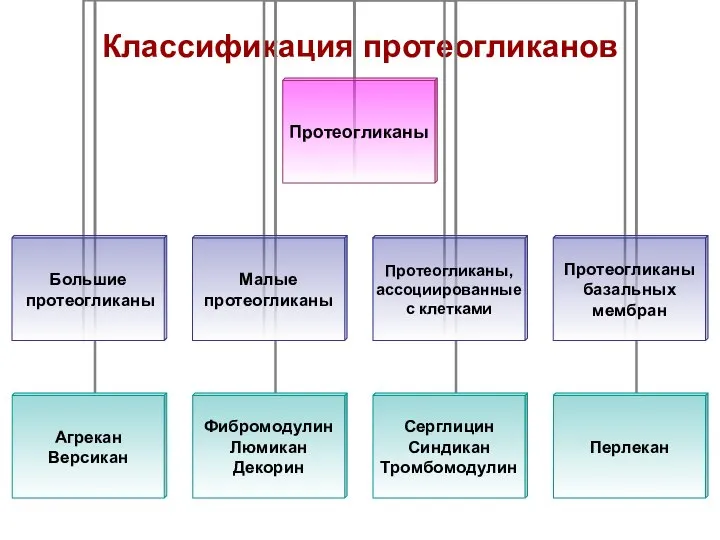
- 80. Классификация протеогликанов
- 81. Классификация протеогликанов. Большие протеогликаны. Белки имеют большую молекулярную массу и содержат более 100 цепей ГАГ. Сюда
- 82. ПГ, ассоциированные с клетками. Сюда относятся: серглицины, синдеканы, тромбомодулин, фосфатидилинозитол – это заякоренные ПГ. Они содержат
- 83. Функции протеогликанов и ГАГ они являются структурными компонентами межклеточного матрикса; протеогликаны и гликозаминогликаны специфически взаимодействуют с
- 84. протеогликаны и гликозаминогликаны играют роль молекулярного сита в меж-клеточном матриксе, они препятствуют распространению патогенных микроор-ганизмов; гиалуроновая
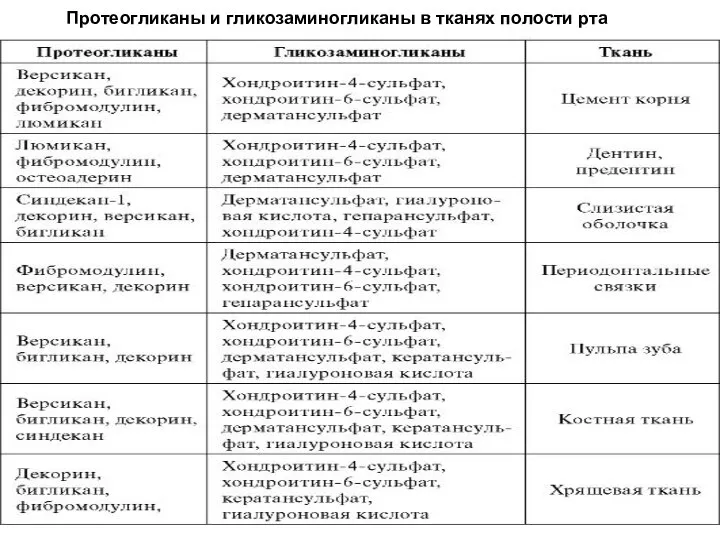
- 85. Протеогликаны и гликозаминогликаны в тканях полости рта
- 88. Скачать презентацию
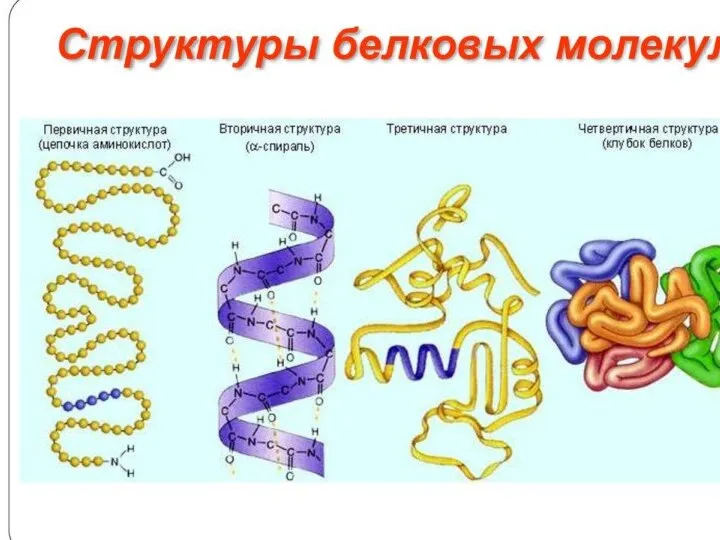
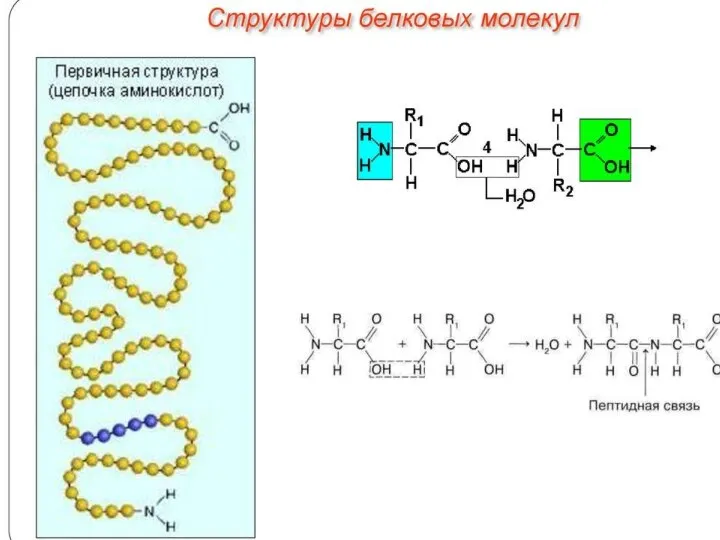
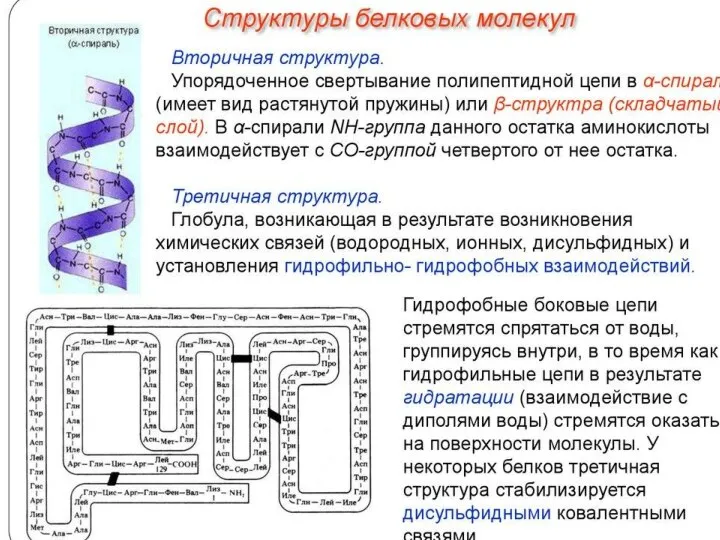
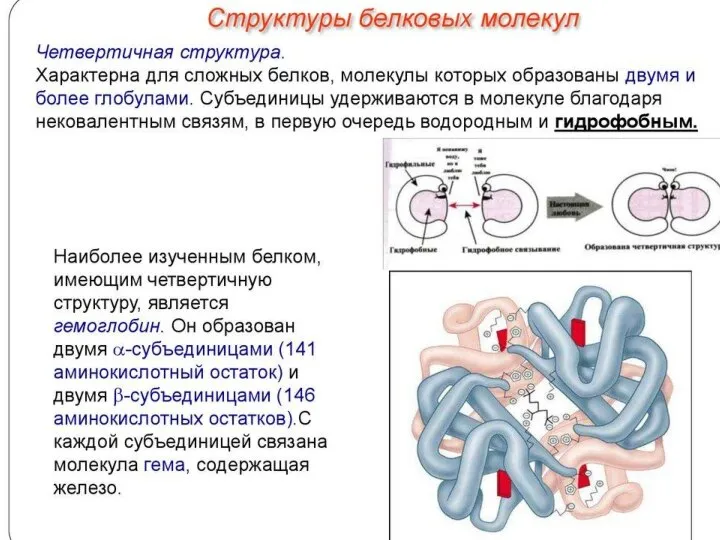

























































 Химический состав клетки
Химический состав клетки Клеточный уровень. Клеточная теория. 10 класс
Клеточный уровень. Клеточная теория. 10 класс Решение задач по генетике. Урок-практикум
Решение задач по генетике. Урок-практикум Перистальтика. Определение
Перистальтика. Определение Всё про дворнягу
Всё про дворнягу Цветок толстянка. Наблюдение за прорастанием корня
Цветок толстянка. Наблюдение за прорастанием корня ТОРМОЖЕНИЕ (1)
ТОРМОЖЕНИЕ (1) Физиология нервов и мышц
Физиология нервов и мышц Многообразие рыб
Многообразие рыб Наше зрение
Наше зрение Неограниченные возможности головного мозга
Неограниченные возможности головного мозга 文:[美]史蒂夫・危金斯
文:[美]史蒂夫・危金斯 Мое любимое животное (9 класс)
Мое любимое животное (9 класс)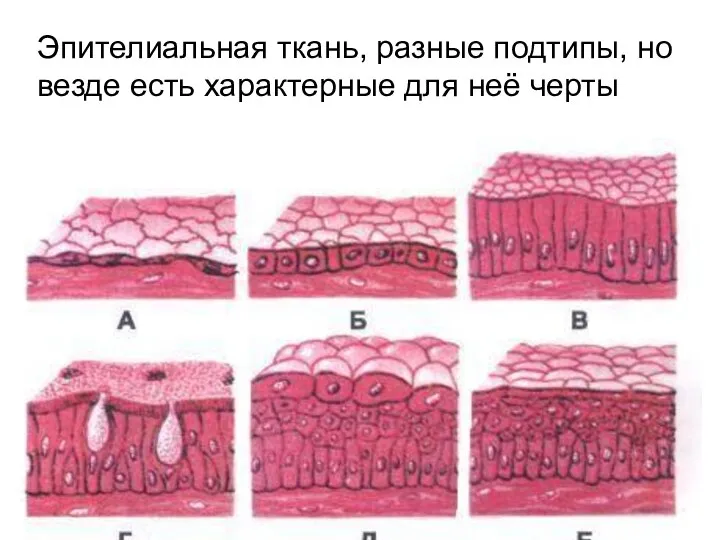 Эпителиальная ткань
Эпителиальная ткань Входная контрольная работа
Входная контрольная работа Взаимодействие аллельных генов. Кодоминирование
Взаимодействие аллельных генов. Кодоминирование Регуляторы роста и развития растений
Регуляторы роста и развития растений Нуклеиновые кислоты
Нуклеиновые кислоты Движение крови по сосудам
Движение крови по сосудам Мономеры и полимеры
Мономеры и полимеры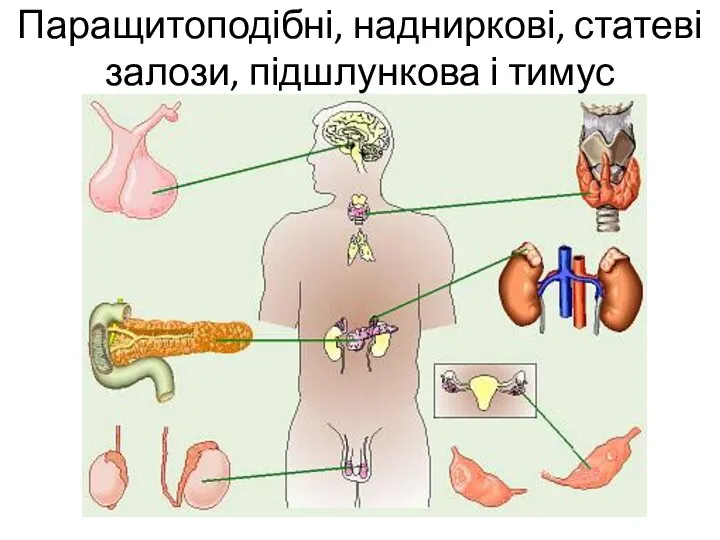 Паращитоподібні, надниркові, статеві залози, підшлункова і тимус
Паращитоподібні, надниркові, статеві залози, підшлункова і тимус Jean Batiste Lamarck
Jean Batiste Lamarck Биосинтез белка. Генетический код
Биосинтез белка. Генетический код Болото и его обитатели
Болото и его обитатели Собака в нашем доме
Собака в нашем доме Эндокринная система
Эндокринная система Оплодотворение. Биологическая сущность
Оплодотворение. Биологическая сущность Строение и функции хромосом
Строение и функции хромосом