Содержание
- 2. А Регенерация в культуре пыльников ячменя: А- растения-альбиносы; Б- зелёные растения-регенеранты; В- оптимальная фаза развития растения
- 3. А Б Растения-регенеранты: А- растения на среде для индукции корнеобразования; Б-термостат, с расположенными в нем растениями
- 4. Инфекция, наблюдаемая в культурах растительных тканей, может быть систематической и случайной. В первом случае необходимо проанализировать
- 5. Стерилизация Стерилизация помещения. В больших операционных комнатах и боксах для стерилизации помещения ультрафиолетом могут быть использованы
- 6. Стерилизация Ультрафиолетовое облучение весьма эффективно против вегетирующих форм бактерий, но для уничтожения спорообразующих бактерий, а также
- 7. Стерилизация Правила работы в операционной комнате. Перед самым началом работы все предметы, находящиеся в операционной комнате,
- 8. Стерилизация Стерилизация посуды и инструментов. Стерилизация сухим горячим воздухом. Стеклянную посуду, инструменты обычно стерилизуют в сушильных
- 9. Стерилизация Стерилизация паром под давлением (автоклавирование). Вата, пробки,марля, халаты и косынки, бумага, целлофановые колпачки, фольга, пипетки,
- 10. Стерилизация Стерилизация питательных средств. Автоклавирование. Среды стерилизуют при давлении 0,75 — 1 атм (температура 115-120º) в
- 11. Стерилизация Концы пипеток перед автоклавированием закрывают ватным тампоном и каждую завертывают от дельно. Не рекомендуется переносить
- 12. Стерилизация Стерилизация растительного материала. Начальное получение стерильного растительного материала является трудной задачей и часто, несмотря на
- 13. Стерилизация Для стерилизации органов и тканей растений, из которых будет изолироваться ткань для культуры, применяют обычно
- 14. Стерилизация Хлорная известь рекомендуется для стерилизации различного растительного материала в концентрации 90 г/л. продолжительность стерилизации для
- 15. Стерилизация Стерилизующие растворы, содержащие ртуть (сулема и диацид). Сулема (HgCl2) не смотря на на ее токсичность
- 16. Стерилизация После стнрилизации ткани в сулеме необходимо тщательно промыть ее в 4-5 порциях стерильной воды, по
- 17. Стерилизация Перекись водорода. Концентрация 10-12%, время стерилизации сухих семян –10–12 мин., набухших семян 6 –8 мин.,
- 18. Стерилизация Применение антибиотиков. Антибиотики редко применяются для поверхностной стерилизации растительного материала, но они необходимы в тех
- 19. Стерилизация Используя антибиотики для получения стерильных культур, необходимо помнить, что они также оказывают влияние на рост
- 20. Стерилизация Техника стерилизации растительного материала. Перед стерилизацией объекты должны быть тщательно вымыты теплой водой с мылом
- 22. Скачать презентацию
Слайд 2А
Регенерация в культуре пыльников ячменя:
А- растения-альбиносы;
Б- зелёные растения-регенеранты;
В- оптимальная фаза развития
А
Регенерация в культуре пыльников ячменя:
А- растения-альбиносы;
Б- зелёные растения-регенеранты;
В- оптимальная фаза развития

Б
В
Слайд 3А
Б
Растения-регенеранты: А- растения на среде для индукции корнеобразования; Б-термостат, с расположенными в
А
Б
Растения-регенеранты: А- растения на среде для индукции корнеобразования; Б-термостат, с расположенными в

Слайд 4
Инфекция, наблюдаемая в культурах растительных тканей, может быть систематической и случайной. В
Инфекция, наблюдаемая в культурах растительных тканей, может быть систематической и случайной. В

Слайд 5
Стерилизация
Стерилизация помещения. В больших операционных комнатах и боксах для стерилизации помещения ультрафиолетом
Стерилизация
Стерилизация помещения. В больших операционных комнатах и боксах для стерилизации помещения ультрафиолетом

Стерилизация обычно продолжается 2-3 час. Так как при этом образуются озон и окислы азота, токсичные в больших концентрациях и для человека и для растительных тканей, то, как правило, стерилизация комнаты для утренней работы в ней производится накануне вечером. При недостаточной герметичности помещения и отсутствии «подпора» воздуха в нем такой длительный промежуток времени между окончанием стерилизации помещения и началом работы может повысить процент инфицированности ткани. Однако при хорошей герметизации помещения такая предварительная стерилизация дает вполне удовлетворительные результаты. Кроме ртутно-кварцевых ламп в «операционных» комнатах или боксах могут быть успешно использованы бактерицидные аргоннортутные лампы низкого давления с трубкой из увиолевого стекла. Наша промышленность выпускает их мощностью 15 и 30 вт (БУВ-15П и БУВ-30П).Эти лампы нуждаются в специальных пуско - регулирующих устройствах, состоящих из дросселя (марки КДБ-1), двух держателей и стартера (типа СК). Бактерицидные лампы экономичнее, чем лампы ртутно-кварцевые. Светильники из четырех-шести бактерицидных ламп можно расположить под потолком, по углам комнаты и над рабочим столом, а также и в тамбуре при входе в операционную комнату.
.
Слайд 6Стерилизация
Ультрафиолетовое облучение весьма эффективно против вегетирующих форм бактерий, но для уничтожения спорообразующих
Стерилизация
Ультрафиолетовое облучение весьма эффективно против вегетирующих форм бактерий, но для уничтожения спорообразующих

В тамбуре перед операционной комнатой рекомендуется положить коврик (паралоновый, резиновый), смоченный раствором стерилизатора (хлорная известь, хлорамин), чтобы не занести инфекцию в операционную комнату с обувью.
Слайд 7Стерилизация
Правила работы в операционной комнате. Перед самым началом работы все предметы, находящиеся
Стерилизация
Правила работы в операционной комнате. Перед самым началом работы все предметы, находящиеся

Слайд 8Стерилизация
Стерилизация посуды и инструментов. Стерилизация сухим горячим воздухом. Стеклянную посуду, инструменты обычно
Стерилизация
Стерилизация посуды и инструментов. Стерилизация сухим горячим воздухом. Стеклянную посуду, инструменты обычно

Стерилизация пламенем. Во время работы инструменты, предварительно простерилизованные сухим, горячим воздухом, вынимают из бумаги, опускают в стакан с 96º-ным спиртом и стерилизуют еще раз обжиганием в пламени спиртовки. Немедленно после обжигания каждый инструмент закладывают между листами плотной оберточной бумаги, сложенной в пачки из 20-30-листов и предварительно простерилизованной в автоклаве. После использования для манипуляции с тканью пинцет или ланцет опять опускают в спирт и перед каждым последующим употреблением инструмент опять обжигают и закладывают уже под следующий (еще не использованный для хранения инструментов) лист бумаги. Инструменты во время работы можно стерилизовать также кипячением. Это рекомендуется для ножниц, шприцев, пробкобуров. Ланцеты и пинцеты, обычно применяемые при работе с тканями, удобнее стерилизовать обжиганием.
Слайд 9Стерилизация
Стерилизация паром под давлением (автоклавирование). Вата, пробки,марля, халаты и косынки, бумага, целлофановые
Стерилизация
Стерилизация паром под давлением (автоклавирование). Вата, пробки,марля, халаты и косынки, бумага, целлофановые

Предметы, подготовленные для автоклавирования, должны быть обернуты сначала в бумагу, затем в целлофан и обвязаны шпагатом. Вату, пробки, марлю, халаты можно стерилизовать в специальных металлических биксах. Вату из плотно свернутых пачек следует вынуть и разложить более рыхлым слоем. Материалы и оборудование рекомендуется стерилизовать в автоклаве при давлении 2 атм (температура 133º ), в течении 30 мин.
Слайд 10Стерилизация
Стерилизация питательных средств. Автоклавирование. Среды стерилизуют при давлении 0,75 — 1 атм
Стерилизация
Стерилизация питательных средств. Автоклавирование. Среды стерилизуют при давлении 0,75 — 1 атм

Слайд 11Стерилизация
Концы пипеток перед автоклавированием закрывают ватным тампоном и каждую завертывают от дельно.
Стерилизация
Концы пипеток перед автоклавированием закрывают ватным тампоном и каждую завертывают от дельно.

Стерилизация фильтрованием. Белковые компоненты среды, витамины, углекислые соли, аминокислоты, растительные экстракты и другие термолабильные вещества при автоклавировании могут разрушаться или превращаться в другие соединения. Для сохранения их в составе стерильной среды рекомендуется следующий способ стерилизации. Предварительно в автоклаве стерилизуют пустые культуральные сосуды, закрытые пробками и колпочками. Режим стерилизации обычный, т. е. 2 атм в течение 30 мин. Питательную среду, из состава которой исключены термолабильные компоненты, автклавируют в течение 20 мин. при 1 атм. Раствор термолабильных веществ стерилизуют фильтрованием через бактериальные фильтры и в стерильной комнате приливают к основной среде, охлажденной до 50-60º, добавляют отфильтрованный раствор, среду в взбалтывают и быстро разливают по простерилизованным культуральным сосудам.
Слайд 12Стерилизация
Стерилизация растительного материала.
Начальное получение стерильного растительного материала является трудной задачей и часто,
Стерилизация
Стерилизация растительного материала.
Начальное получение стерильного растительного материала является трудной задачей и часто,

Слайд 13Стерилизация
Для стерилизации органов и тканей растений, из которых будет изолироваться ткань для
Стерилизация
Для стерилизации органов и тканей растений, из которых будет изолироваться ткань для

Правило, по которому следует выбирать наиболее пригодный стерилизующий раствор, просто. Это вещество должно обеспечить наибольший процент неповрежденных тканей, способных к росту и новообразованиям, при наименьшем проценте инфекции. Этого правила следует придерживаться и при выборе длительности стерилизации.
Наиболее распространенными стерилизующими растворами являются растворы, содержащие активный хлор: гипохлориты кальция и натрия, хлорамины, хлорная известь. Растворы эти готовят следующим образом: определенное количество стерилизатора перед употреблением взбалтывают в 1 л воды в течение 10 мин., затем отфильтровывают и используют для стерилизации растительного материала.
Слайд 14Стерилизация
Хлорная известь рекомендуется для стерилизации различного растительного материала в концентрации 90 г/л.
Стерилизация
Хлорная известь рекомендуется для стерилизации различного растительного материала в концентрации 90 г/л.

Гипохлорит кальция применялся Лиоре для стерилизации корневой ткани скорцонеры в концентрации 90 г/л в течение 15 мин. Лингаппа стерилизовал кусочки побегов картофеля в течении 5 мин. 75º-ным спиртом и затем 15 мин. 1%-ным гипохлоритом натрия.
Слайд 15Стерилизация
Стерилизующие растворы, содержащие ртуть (сулема и диацид). Сулема (HgCl2) не смотря на
Стерилизация
Стерилизующие растворы, содержащие ртуть (сулема и диацид). Сулема (HgCl2) не смотря на

Эффективность стерилизации значительно повышается при добавлении к раствору сулемы детергентов типа Твин-80, Твин-20 (5–6 капель на 1 л) или ОП-7; ОП-10, - 300 мг/л .
Слайд 16Стерилизация
После стнрилизации ткани в сулеме необходимо тщательно промыть ее в 4-5 порциях
Стерилизация
После стнрилизации ткани в сулеме необходимо тщательно промыть ее в 4-5 порциях

Кроме сулемы, для стерилизации может быть рекомендован другой ртутный препарат диацид (этанолмеркурихлорид и борная кислота с цетилпиридинбромидом в качестве детергента), но он действует слабее сулемы, и, по нашим наблюдениям, никакими преимуществами по сравнению с ней не обладают.
Слайд 17Стерилизация
Перекись водорода. Концентрация 10-12%, время стерилизации сухих семян –10–12 мин., набухших семян
Стерилизация
Перекись водорода. Концентрация 10-12%, время стерилизации сухих семян –10–12 мин., набухших семян

Преимуществом перекиси водорода в качестве стерилизующего агента является то, что после нее не нужно так долго и тщательно отмывать ткань, как после сулемы: достаточно только один раз промыть стерильной водой. Оставшаяся в тканях перекись быстро разрушается.
Стерилизация спиртом и обжиганием пламенем. Часто применяется при стерилизации крупных семян, завязей, плодов. Материал опускается в спирт и затем обжигается в пламени; эта операция повторяется несколько раз.
Слайд 18Стерилизация
Применение антибиотиков. Антибиотики редко применяются для поверхностной стерилизации растительного материала, но они
Стерилизация
Применение антибиотиков. Антибиотики редко применяются для поверхностной стерилизации растительного материала, но они

Так, по данным Монтана (1957) добавление пенициллина в количестве 1 мг на 1 л питательной среды помогло получить стерильную культуру стебля молочая. По данным Штихеля (1959) ауреомицин или его аналог ахромицин, добавленные к среде в концентрации 50 мг/л, оказались очень эффективными при культивировании тканей клубнелуковицы цикламена. Морель (1950) применял для получения стерильных культур тканей ауреомицин в концентрации 1/10000.
Слайд 19Стерилизация
Используя антибиотики для получения стерильных культур, необходимо помнить, что они также оказывают
Стерилизация
Используя антибиотики для получения стерильных культур, необходимо помнить, что они также оказывают

Слайд 20Стерилизация
Техника стерилизации растительного материала. Перед стерилизацией объекты должны быть тщательно вымыты теплой
Стерилизация
Техника стерилизации растительного материала. Перед стерилизацией объекты должны быть тщательно вымыты теплой

Для стерилизации побегов древесных растений Зелинский рекомендует следующую последовательность операций: отрезки(длиной 20–30 см) одно-двухлетних побегов дуба, бука и березы моют в проточной воде, протирают ватой, смоченной сначала 95º-ным, затем 100º-ным спиртом, и стерилизуют в 0,2%-ном растворе сулемы в течение 45 мин. Затем промывают 3 раза стерильной водой и используют для изоляции из них определенных тканей.
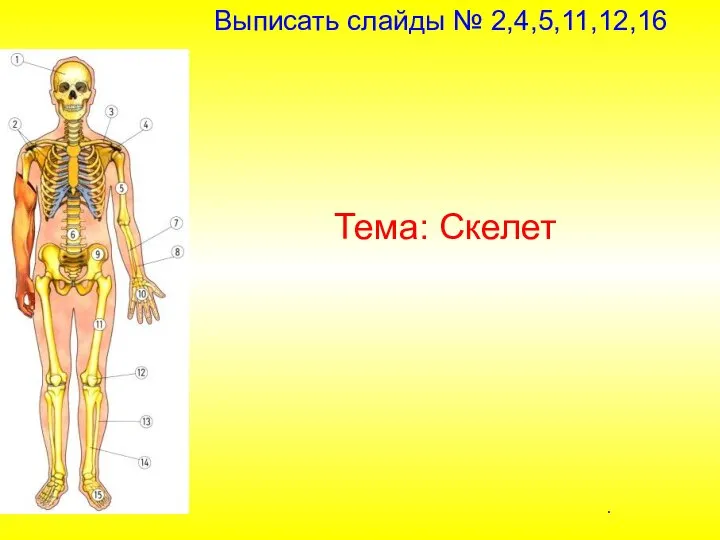 Скелет
Скелет Углеводы. Липиды. Роль в жизнедеятельности клетки
Углеводы. Липиды. Роль в жизнедеятельности клетки Папоротники, хвощи, плауны
Папоротники, хвощи, плауны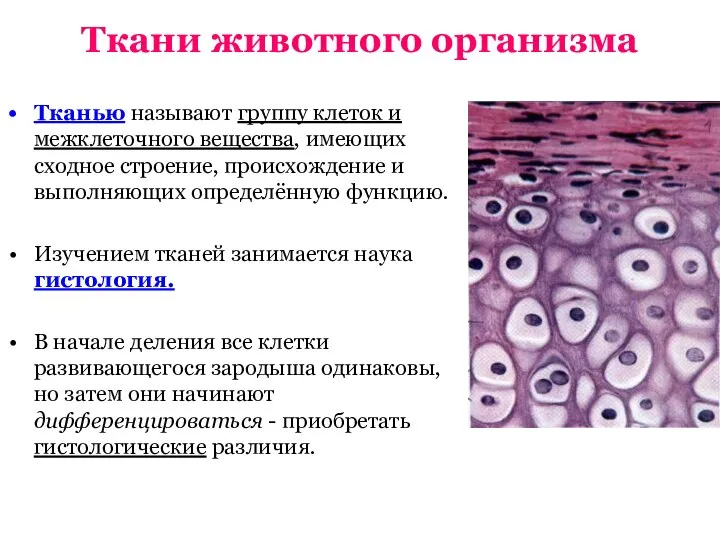 Элжур. Ткани
Элжур. Ткани Влияние различных факторов на рост и развитие растений кукурузы
Влияние различных факторов на рост и развитие растений кукурузы Перелетные птицы
Перелетные птицы Органы высших растений
Органы высших растений Цитологические основы наследственности
Цитологические основы наследственности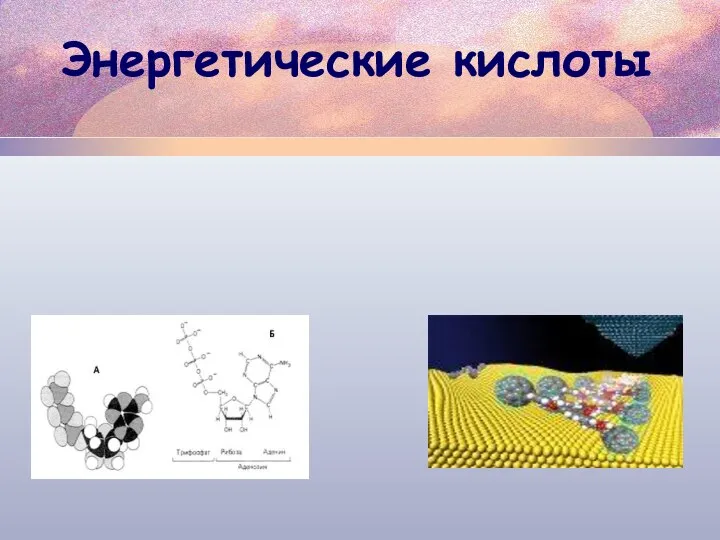 Энергетические кислоты. АТФ
Энергетические кислоты. АТФ Гипотезы о происхождения жизни
Гипотезы о происхождения жизни Пищеварительная система человека
Пищеварительная система человека Строение грибов
Строение грибов Презентация на тему ТИП ИГЛОКОЖИЕ
Презентация на тему ТИП ИГЛОКОЖИЕ  Движение крови по сосудам
Движение крови по сосудам Митоз и мейоз в микрофотографиях и рисунках
Митоз и мейоз в микрофотографиях и рисунках Почвенные бактерии
Почвенные бактерии Техническая энтомология
Техническая энтомология Царство Грибы
Царство Грибы Память. Понятие памяти. Физиологическая основа памяти. Процессы памяти: запоминание, сохранение, забывание, воспроизведение
Память. Понятие памяти. Физиологическая основа памяти. Процессы памяти: запоминание, сохранение, забывание, воспроизведение Животные динозавры
Животные динозавры Презентация на тему ДИНОЗАВРЫ
Презентация на тему ДИНОЗАВРЫ  Презентация на тему Класс птицы (7 класс)
Презентация на тему Класс птицы (7 класс)  Эукариоты. Строение Эукариота
Эукариоты. Строение Эукариота Биология и история
Биология и история Жизнь организмов в морях и океанах
Жизнь организмов в морях и океанах Знакомство с птицами парка
Знакомство с птицами парка Бактерии
Бактерии Растительный организм и его особенности
Растительный организм и его особенности