Содержание
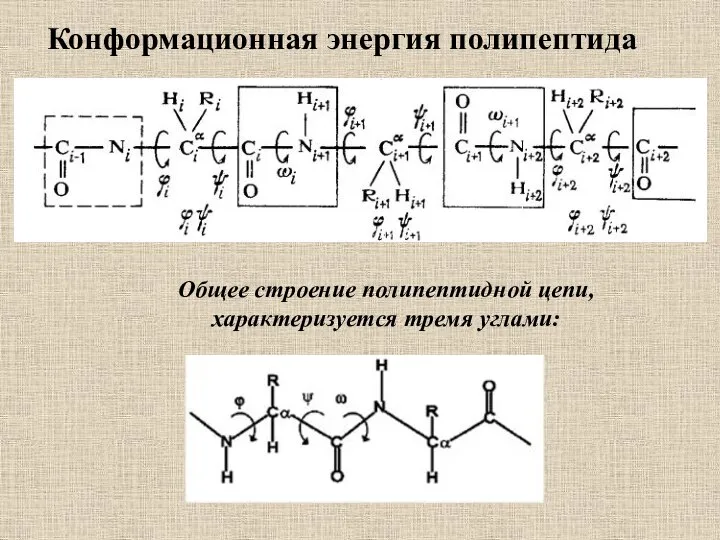
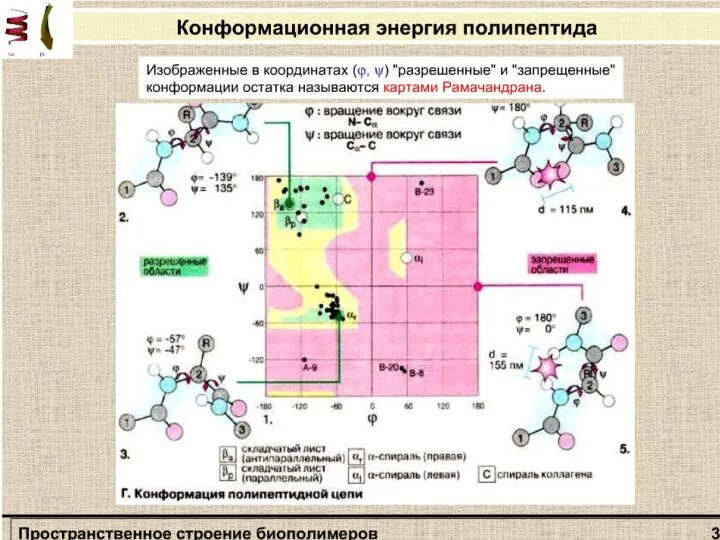
- 2. Конформационная энергия полипептида Общее строение полипептидной цепи, характеризуется тремя углами:
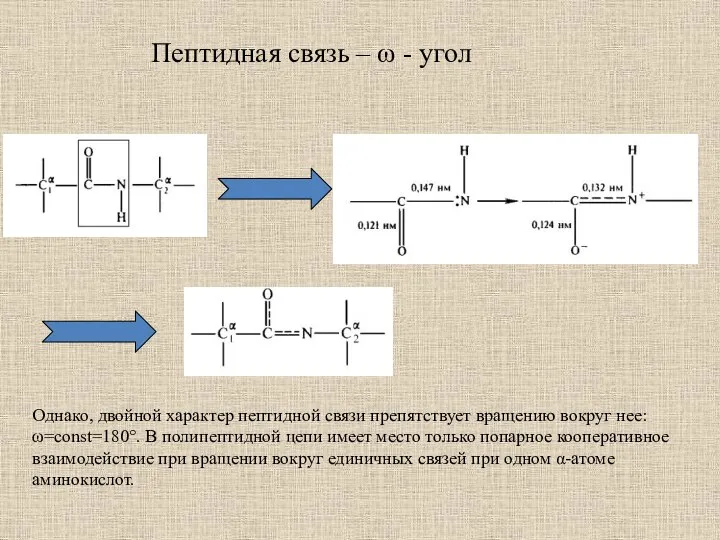
- 3. Пептидная связь – ω - угол Однако, двойной характер пептидной связи препятствует вращению вокруг нее: ω=const=180°.
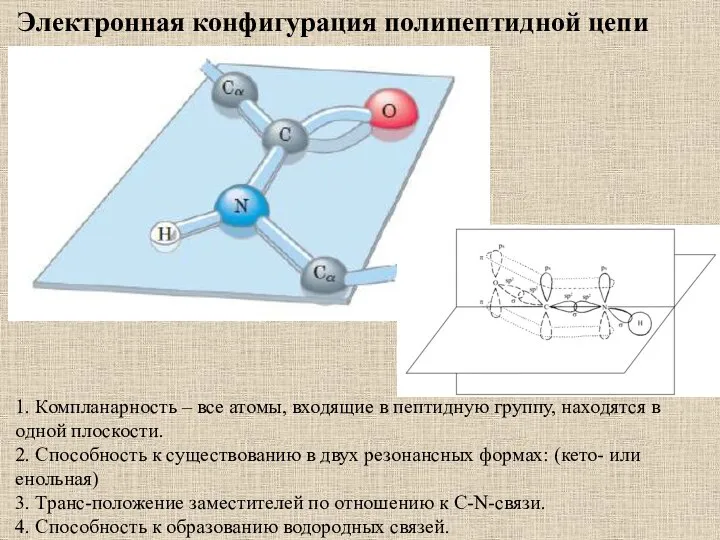
- 4. 1. Компланарность – все атомы, входящие в пептидную группу, находятся в одной плоскости. 2. Способность к
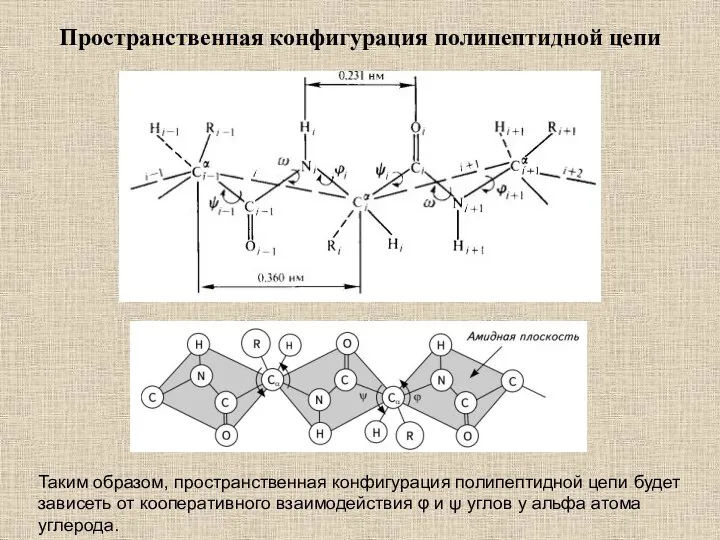
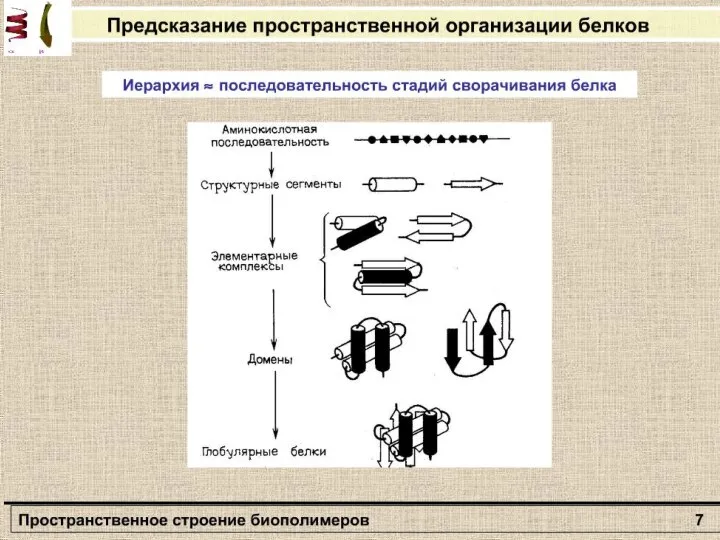
- 5. Пространственная конфигурация полипептидной цепи Таким образом, пространственная конфигурация полипептидной цепи будет зависеть от кооперативного взаимодействия φ
- 6. Не все значения углов ψ и φ допустимы вследствие возможного стерического несоответствия двух соседних аминокислотных остатков.
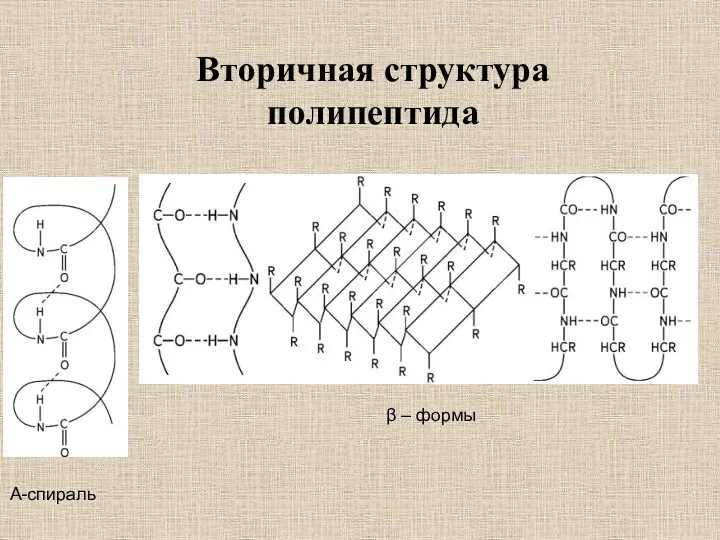
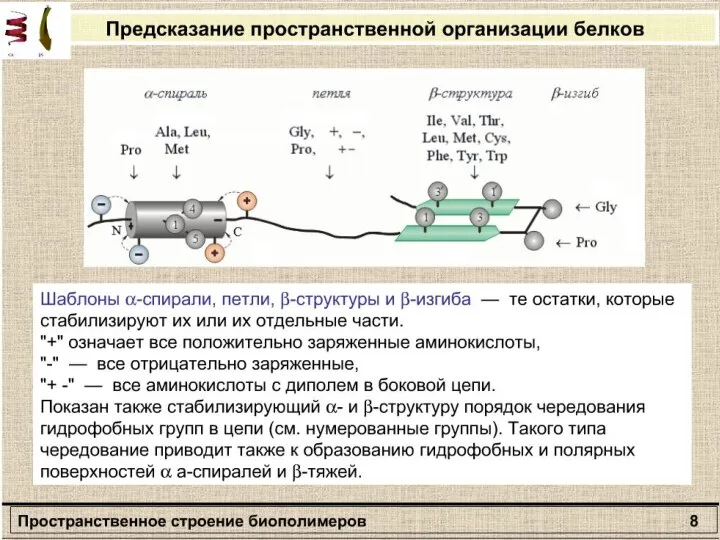
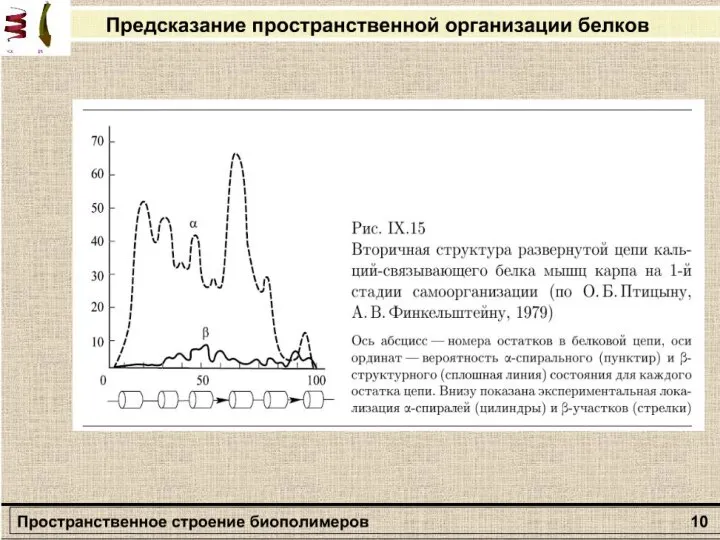
- 12. Вторичная структура полипептида Α-спираль β – формы
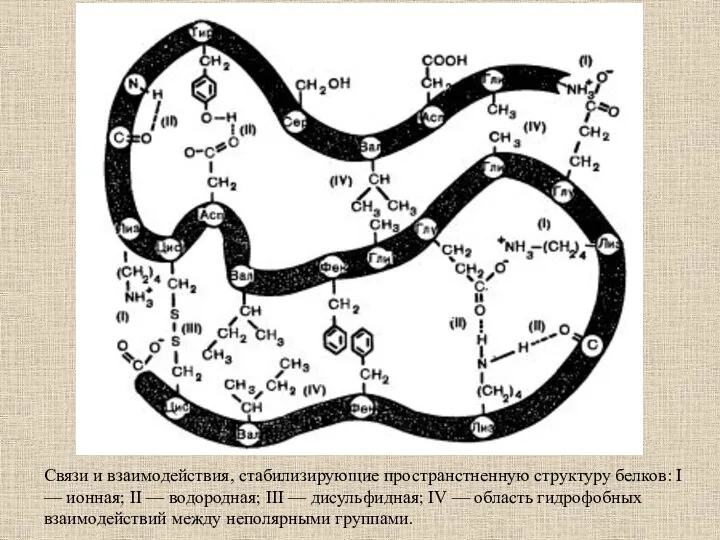
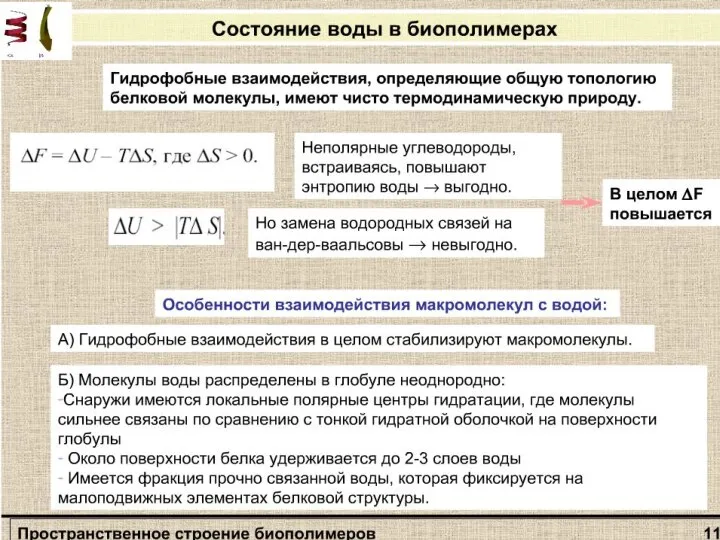
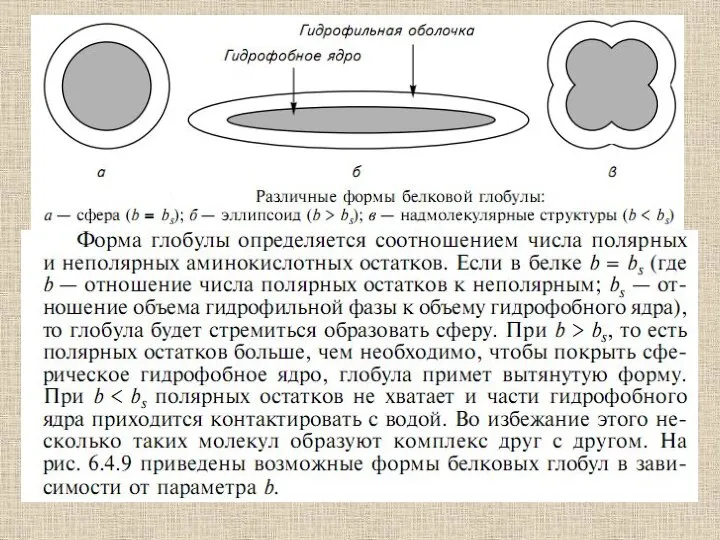
- 13. Связи и взаимодействия, стабилизирующие пространстненную структуру белков: I — ионная; II — водородная; III — дисульфидная;
- 27. Раздел: Молекулярная биофизика Тема: Динамика биополимеров
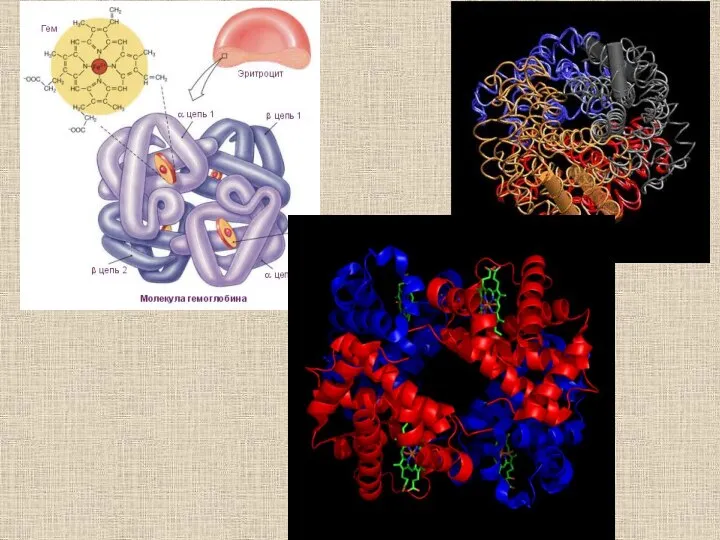
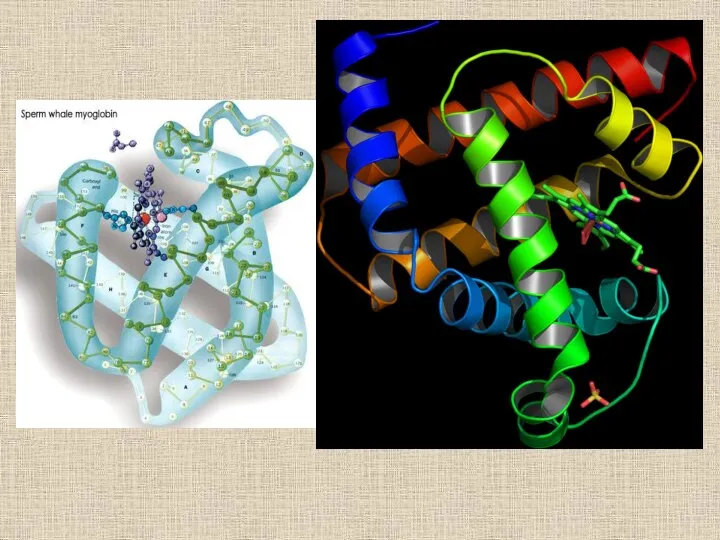
- 28. Пространственная структура миоглобина (кашалота) в проекции ху Миоглобин (переносчик кислорода в мышцах) содержит один гем и
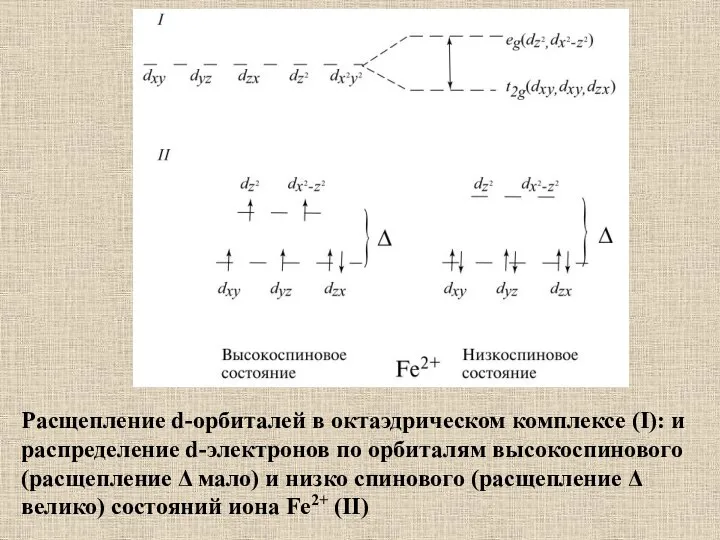
- 29. Расщепление d-орбиталей в октаэдрическом комплексе (I): и распределение d-электронов по орбиталям высокоспинового (расщепление Δ мало) и
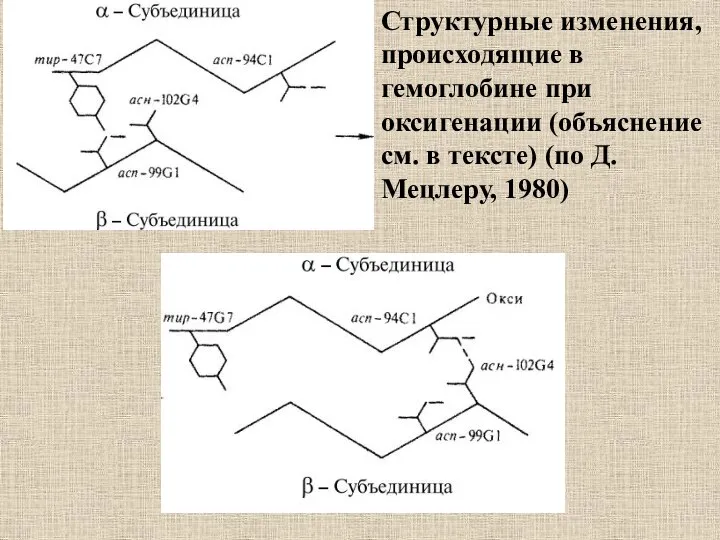
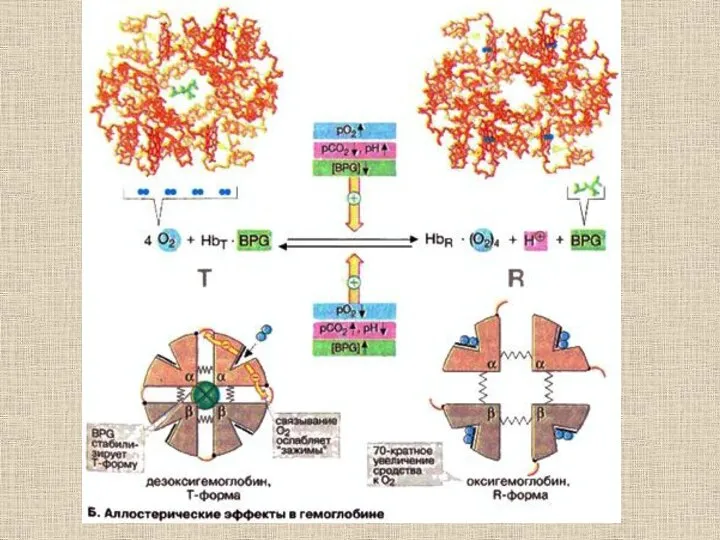
- 30. Структурные изменения, происходящие в гемоглобине при оксигенации (объяснение см. в тексте) (по Д. Мецлеру, 1980)
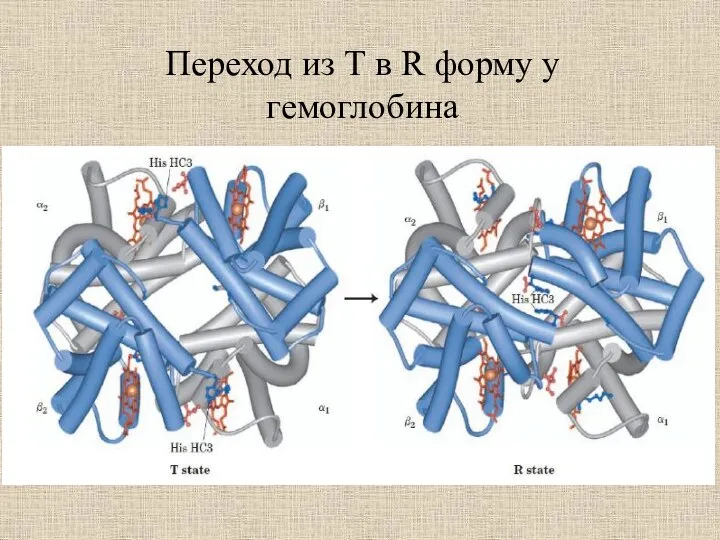
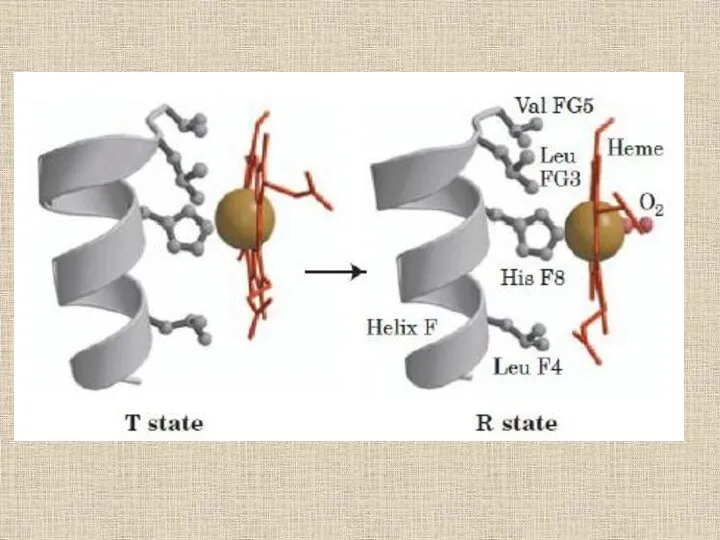
- 31. Переход из T в R форму у гемоглобина
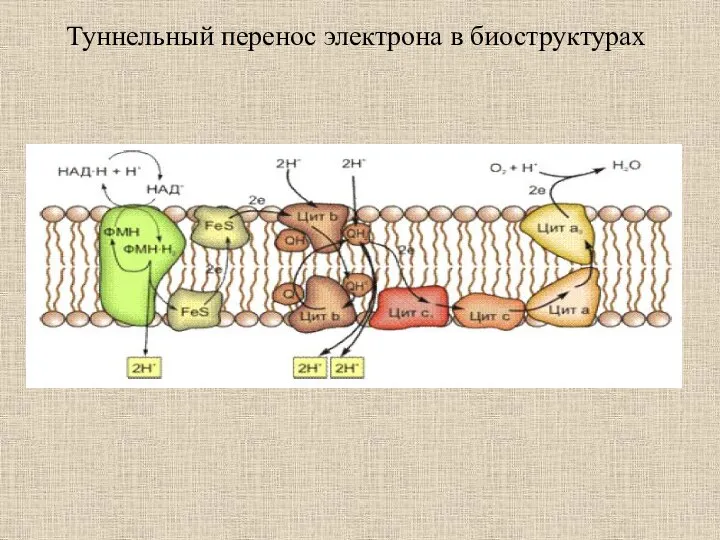
- 33. Туннельный перенос электрона в биоструктурах
- 34. Методы изучения подвижности белков Люминесцентные методы ЭПР ЯМР ЯГР спектроскопия Метод изотопного обмена
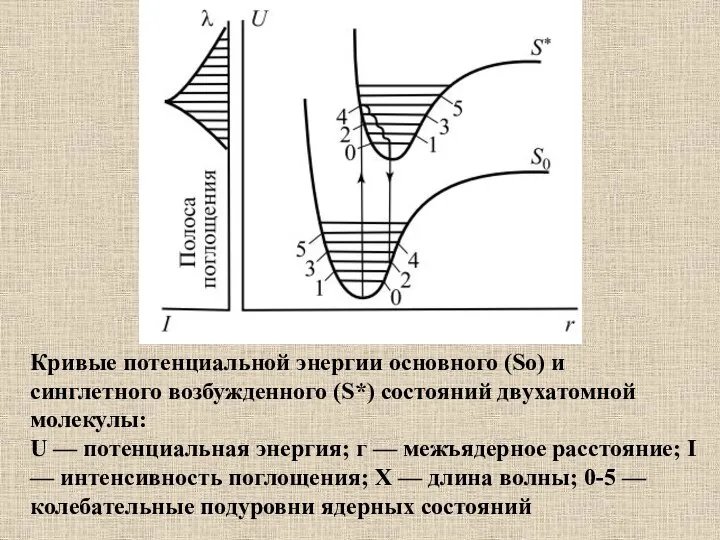
- 35. Кривые потенциальной энергии основного (So) и синглетного возбужденного (S*) состояний двухатомной молекулы: U — потенциальная энергия;
- 36. Электронные уровни органической молекулы и переходы между ними (схема Яблонского): р — вероятность переходов в единицу
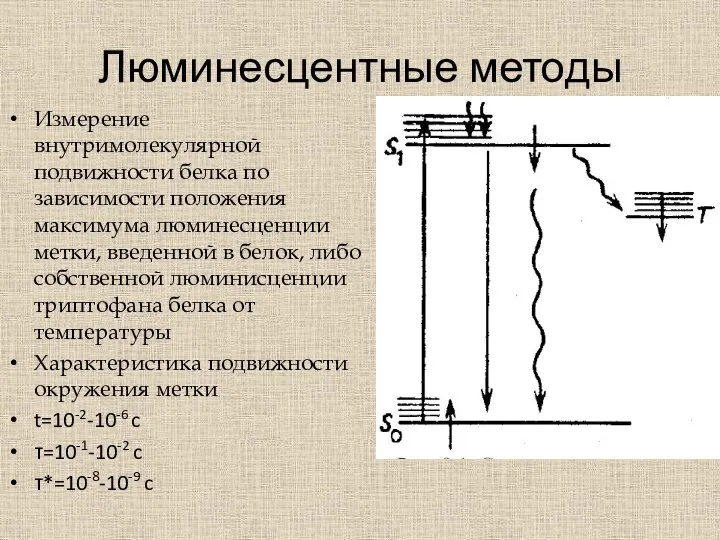
- 37. Люминесцентные методы Измерение внутримолекулярной подвижности белка по зависимости положения максимума люминесценции метки, введенной в белок, либо
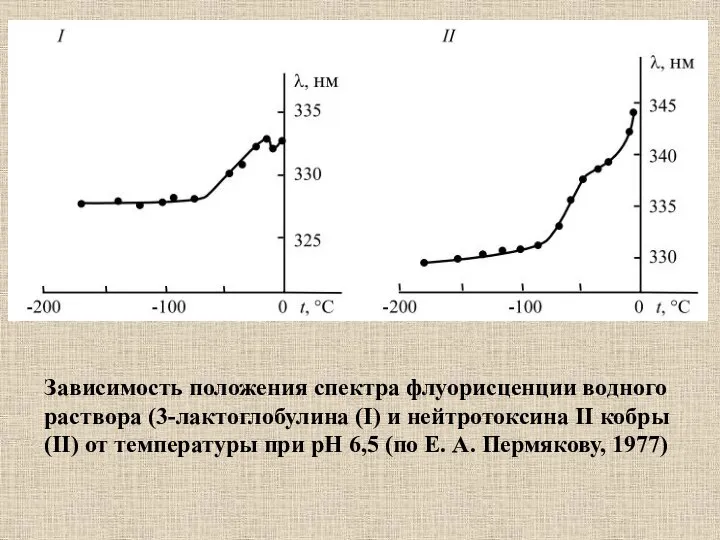
- 38. Зависимость положения спектра флуорисценции водного раствора (3-лактоглобулина (I) и нейтротоксина II кобры (II) от температуры при
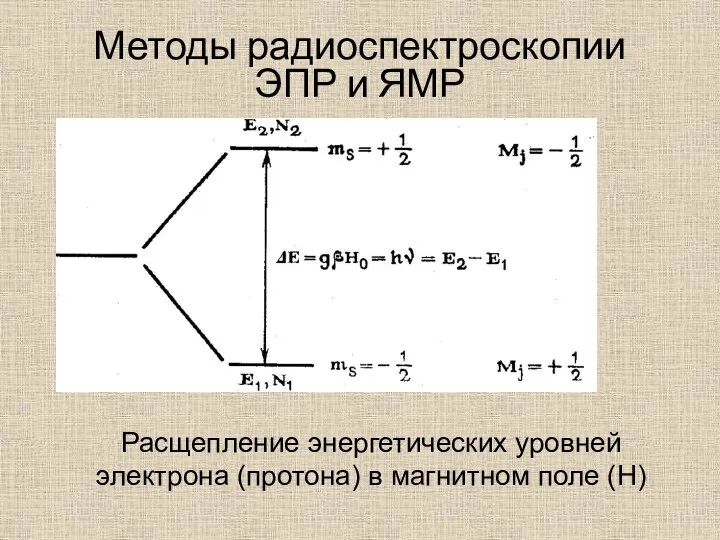
- 39. Методы радиоспектроскопии ЭПР и ЯМР Расщепление энергетических уровней электрона (протона) в магнитном поле (Н)
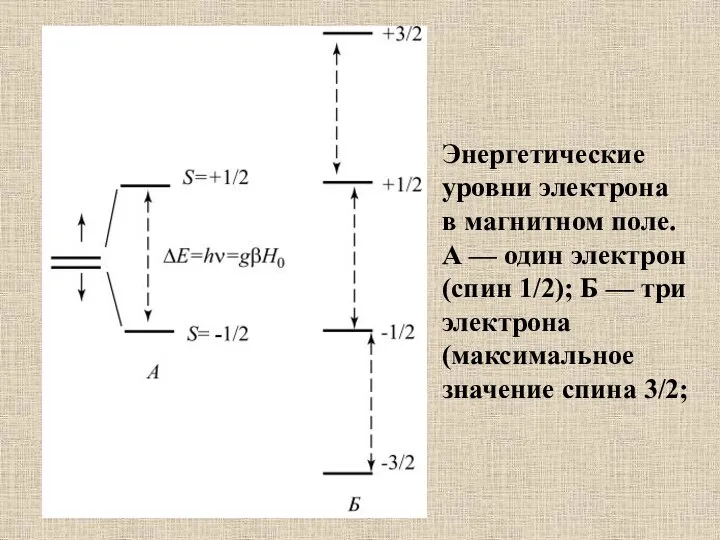
- 40. Энергетические уровни электрона в магнитном поле. А — один электрон (спин 1/2); Б — три электрона
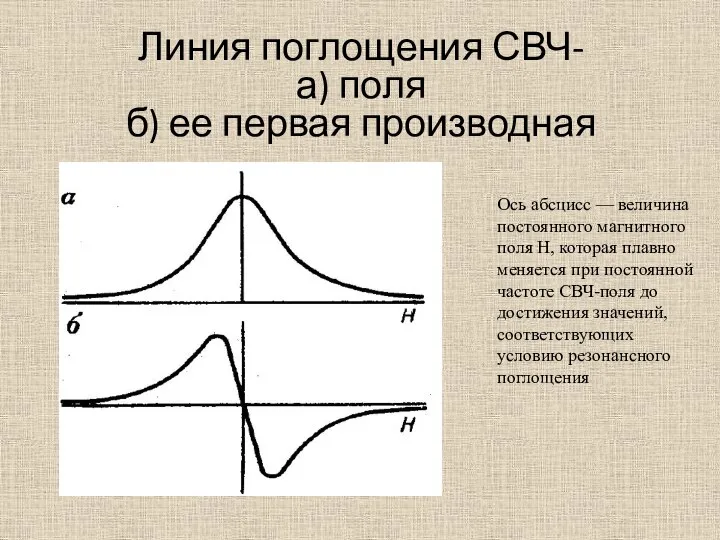
- 41. Линия поглощения СВЧ- а) поля б) ее первая производная Ось абсцисс — величина постоянного магнитного поля
- 42. Линия резонанса ЭПР Ширина: Т1 – время передачи энергии окружающей среде Т2 – время спин-спинового взаимодействия
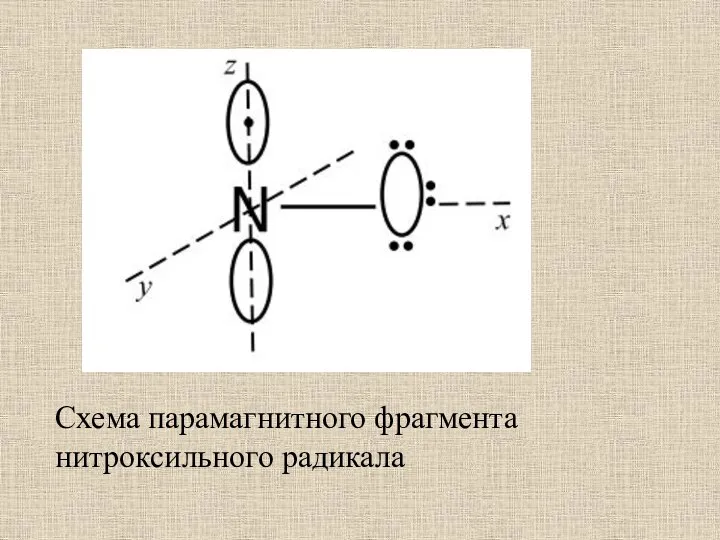
- 43. Схема парамагнитного фрагмента нитроксильного радикала
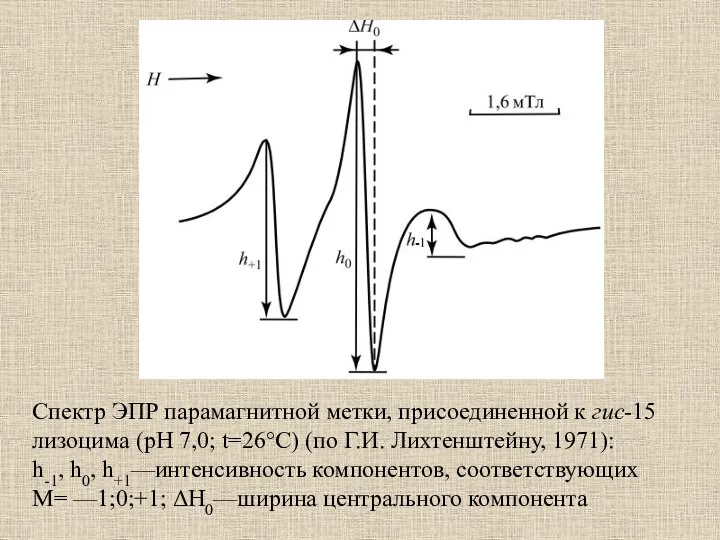
- 44. Спектр ЭПР парамагнитной метки, присоединенной к гис-15 лизоцима (рН 7,0; t=26°C) (по Г.И. Лихтенштейну, 1971): h-1,
- 45. ЯМР-спектроскопия Измерение времени релаксации Т1 и Т2 по ширине линии резонанса. Определение времени вращения метки, на
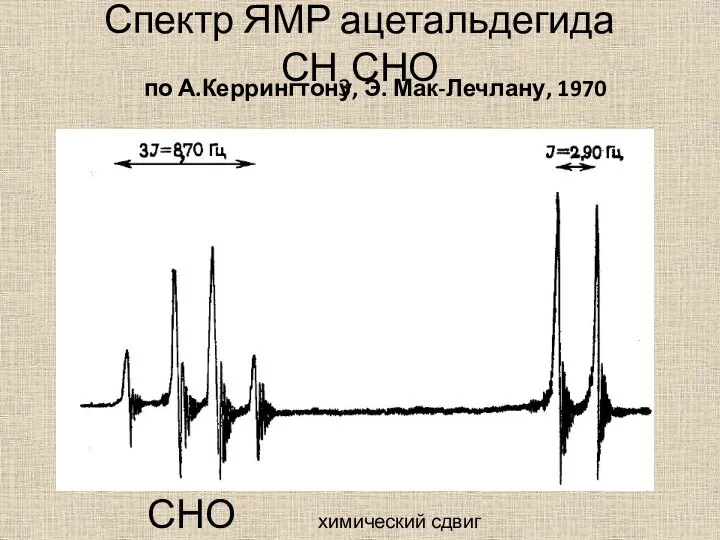
- 46. Спектр ЯМР ацетальдегида СН3СНО СНО химический сдвиг СН3 по А.Керрингтону, Э. Мак-Лечлану, 1970
- 47. ЯГР спектроскопия Дает информацию не только о временных, а также амплитудных характеристиках движений в белке (средние
- 48. Эффект Мёссбауэра Уширение спектра обусловлено диффузией молекул белка. Изменение частоты уширения пропорционально скорости источника (v)
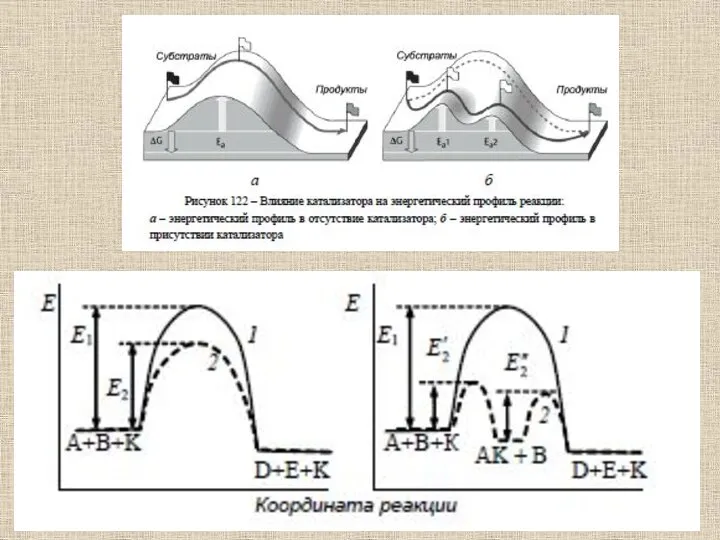
- 51. Ферментативный катализ
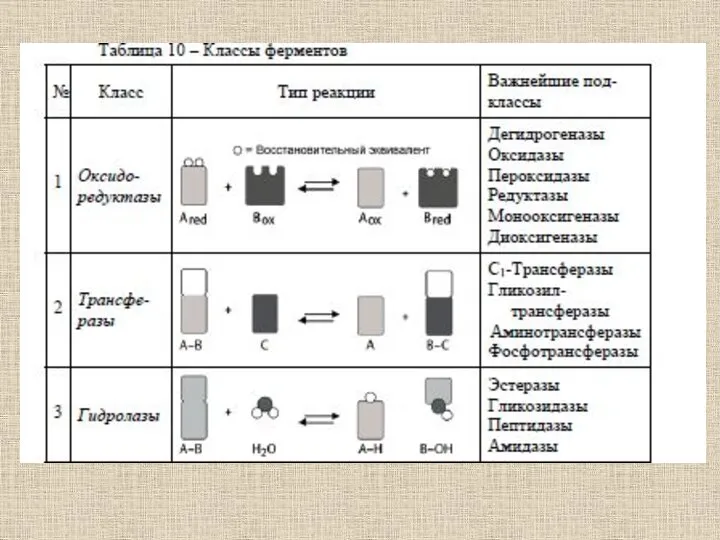
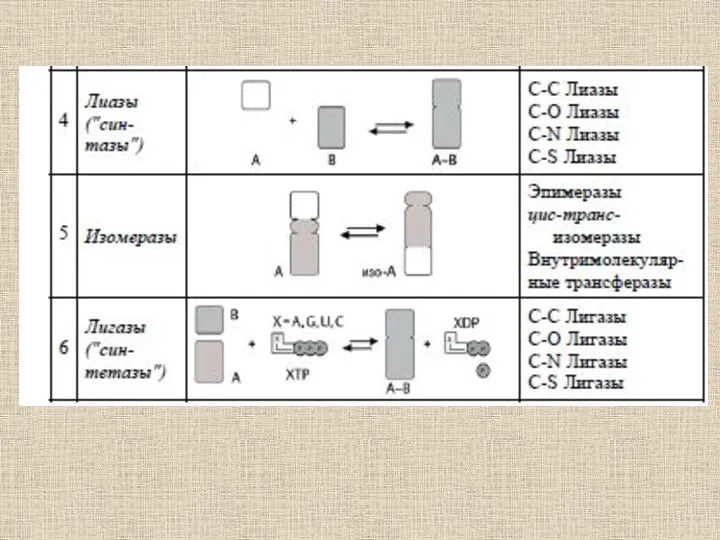
- 52. Ферменты (от латинского fermentum – закваска), энзимы (от греческого en – "в" и zyme – "закваска")
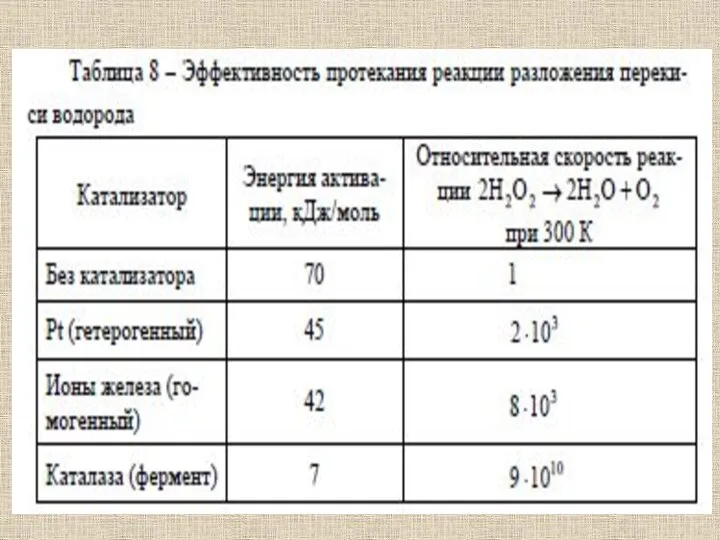
- 53. Ферменты отличаются от других катализаторов тремя уникальными свойствами: - высокой эффективностью действия, - специфичностью действия, -
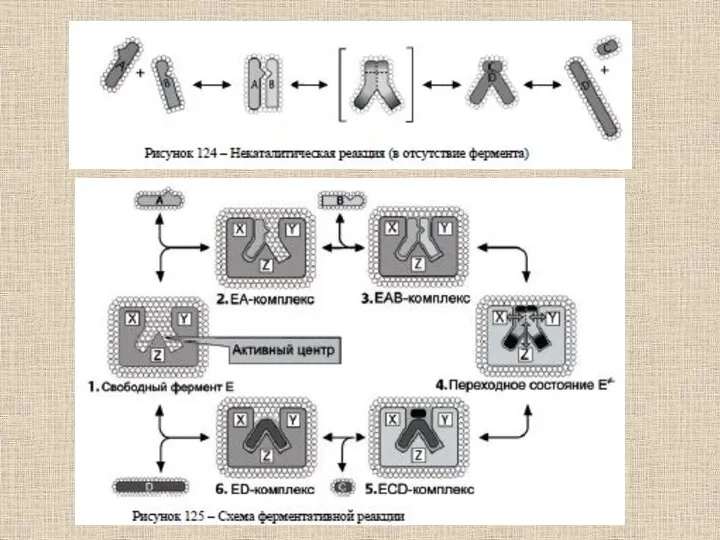
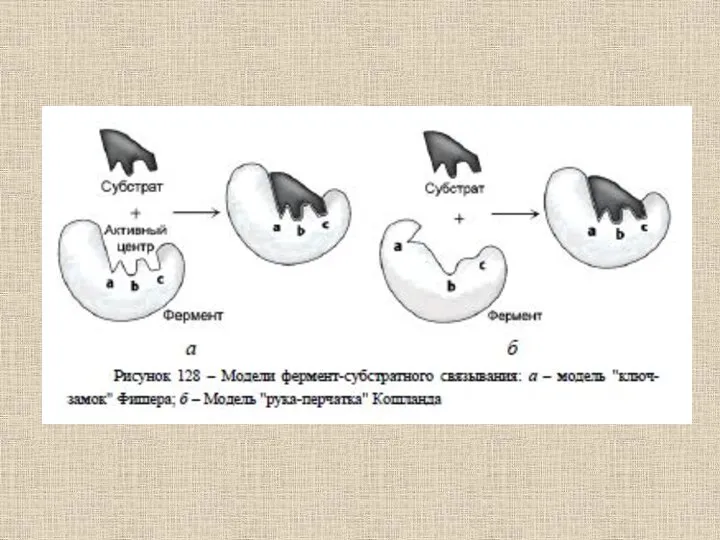
- 59. Взаимодействия, которые играют главную роль при связывании субстрата в активном центре фермента и образовании комплекса фермент-субстрат
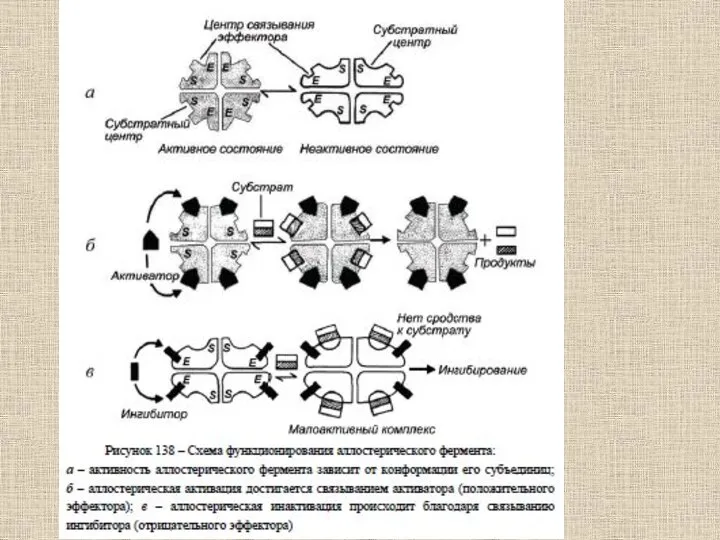
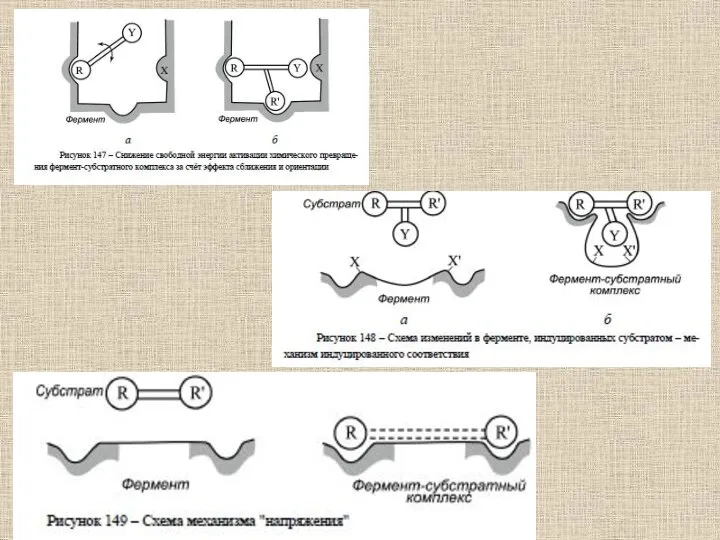
- 61. Основные механизмы управления каталитической активностью фермента связаны со следующими явлениями и процессами: 1) аллостерия; 2) кооперативность;
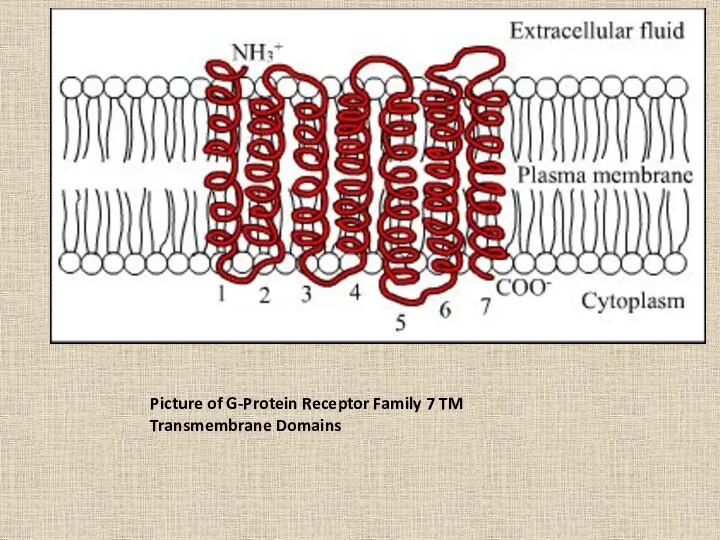
- 65. Picture of G-Protein Receptor Family 7 TM Transmembrane Domains
- 71. Скачать презентацию
























 Природа и её значение в жизни человека
Природа и её значение в жизни человека Презентация на тему Словарная работа
Презентация на тему Словарная работа  Иммунная система. Иммунитет
Иммунная система. Иммунитет Моё хобби. Поле крокусов
Моё хобби. Поле крокусов Загадочный мир китов и дельфинов
Загадочный мир китов и дельфинов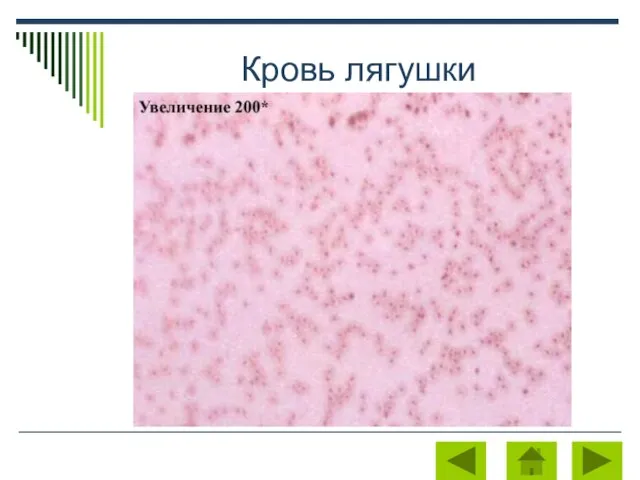 Кровь лягушки
Кровь лягушки Органы чувств
Органы чувств Ствол мозга. Строение и кровоснабжение
Ствол мозга. Строение и кровоснабжение Презентация на тему Дыхание растений 6 класс
Презентация на тему Дыхание растений 6 класс  Понятие морфогенов и градиентов их концентраций
Понятие морфогенов и градиентов их концентраций Периоды онтогенеза
Периоды онтогенеза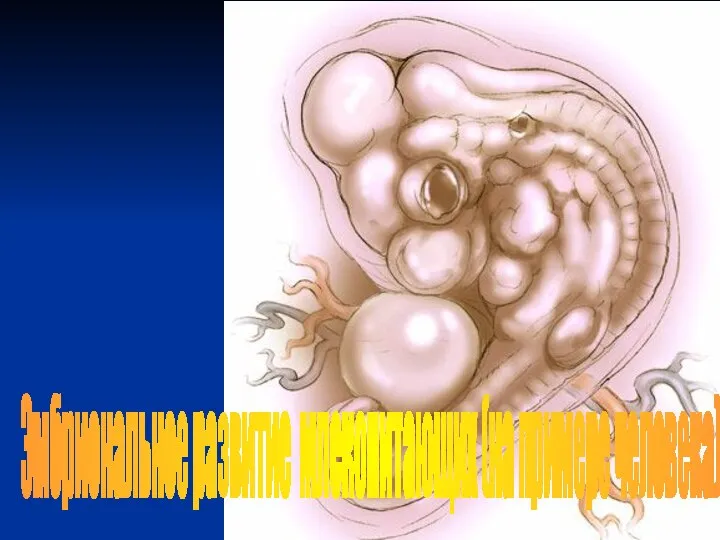 Эмбриогенез млекопитающих
Эмбриогенез млекопитающих Биотические связи в природе
Биотические связи в природе Ткани человека
Ткани человека Отряд журавлеобразные
Отряд журавлеобразные Презентация на тему Питания (5 класс)
Презентация на тему Питания (5 класс)  Бесполое размножение
Бесполое размножение Сорго. Значение и использование
Сорго. Значение и использование Применение водорослей в медицине
Применение водорослей в медицине грибы
грибы Презентация на тему Класс Земноводные
Презентация на тему Класс Земноводные  Ткани
Ткани Альтернативные источники энергии
Альтернативные источники энергии Розмноження рослин
Розмноження рослин Ненаследственная изменчивость
Ненаследственная изменчивость Презентация на тему Антропоген
Презентация на тему Антропоген  Грыбное царство
Грыбное царство Дыхательная система
Дыхательная система