Содержание
- 2. Цели обучения: 11.8.2.3 - вычислять энергию связи атомного ядра и объяснять графическую зависимость удельной энергии связи
- 3. Критерии оценивания: знает состав и свойства атома. определяет число протонов и атомную массу. знает и объясняет
- 4. Строение атома Модель атома Резерфорда
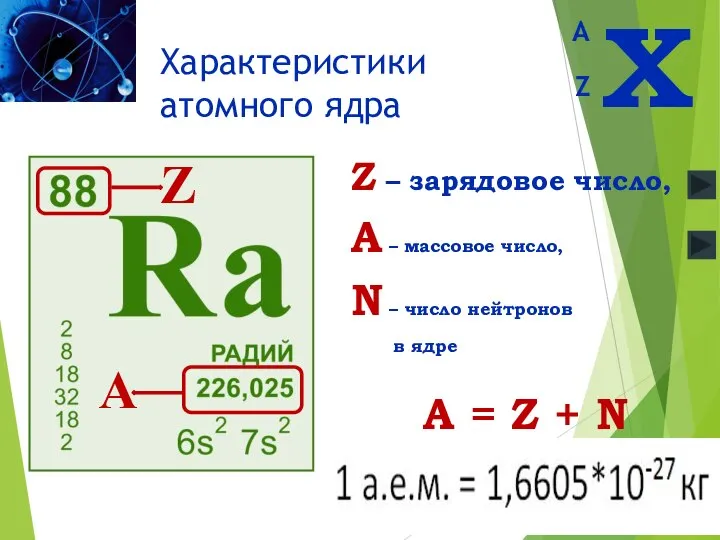
- 6. Z – зарядовое число, A – массовое число, N – число нейтронов в ядре A =
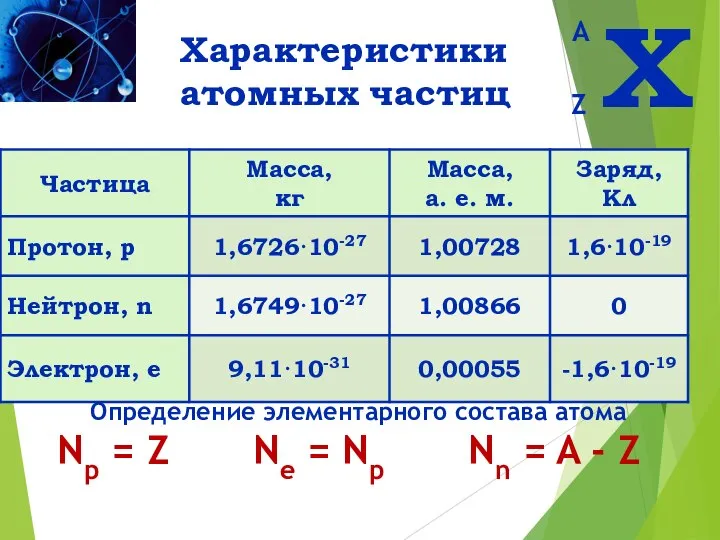
- 7. Характеристики атомных частиц Определение элементарного состава атома Np = Z Ne = Np Nn = A
- 8. Нукли́д (лат. nucleus — «ядро» и др.-греч. είδος — «вид, сорт») — вид атомов, характеризующийся определённым
- 9. Нуклиды, имеющие одинаковый атомный номер (то есть обладающие одинаковым числом протонов), называются изотопами, одинаковое массовое число
- 12. Единицы измерения массы и энергии в атомной физике Для массы: Для энергии:
- 13. Эквивалентность массы и энергии Эквивале́нтность ма́ссы и эне́ргии — физическая концепция теории относительности, согласно которой полная
- 14. Определим эквивалент массы 1 а.е.м. через энергию В микромире массу частиц часто выражают в единицах энергии:
- 15. Массу атома алюминия можно определить из таблицы Менделеева Определите в а.е.м. общую массу 13 протонов, 14
- 16. Дефект массы — это разница между суммой масс всех нуклонов, содержащихся в ядре, и массой ядра.
- 18. Определим дефект массы алюминия
- 19. При образовании ядра из нуклонов общая масса нуклонов уменьшается. При этом выделяется энергия эквивалентная дефекту массы.
- 20. Энергия, которая необходима для полного расщепления ядра на отдельные нуклоны, называется энергией связи ядра. Так как
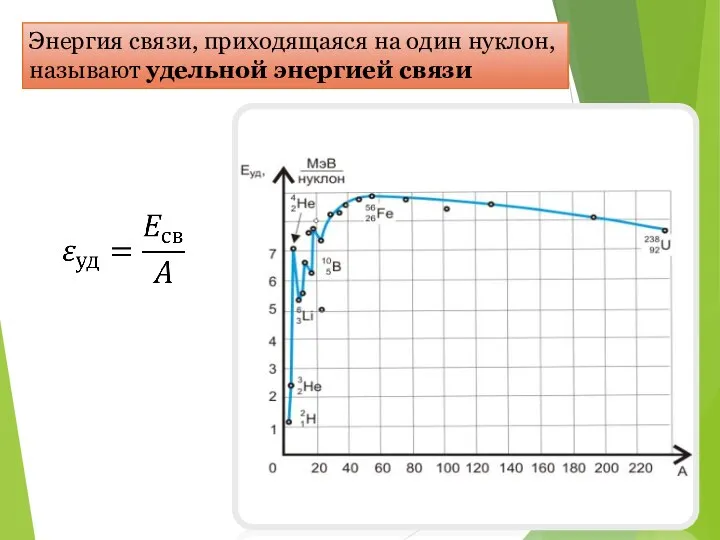
- 21. Энергия связи, приходящаяся на один нуклон, называют удельной энергией связи
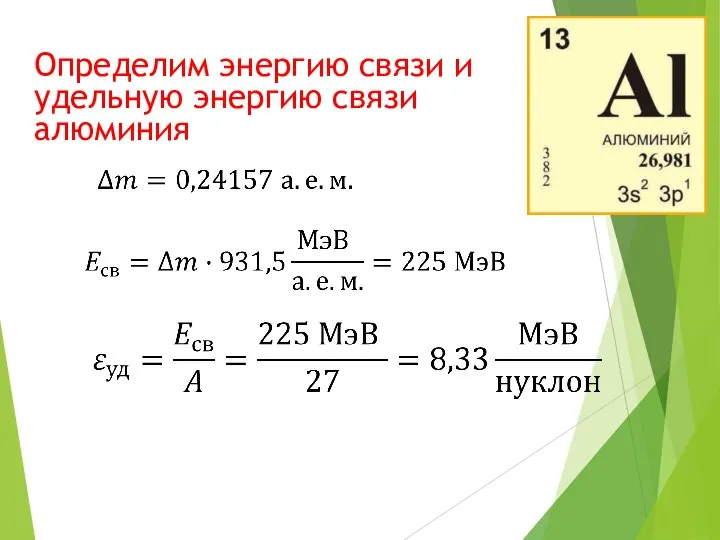
- 22. Определим энергию связи и удельную энергию связи алюминия
- 24. Скачать презентацию

















 Последовательное соединение проводников
Последовательное соединение проводников Деление ядер. Цепные ядерные реакции
Деление ядер. Цепные ядерные реакции Электрооборудование троллейбуса
Электрооборудование троллейбуса Структура и содержание контрольных измерительных материалов ЕГЭ по физике
Структура и содержание контрольных измерительных материалов ЕГЭ по физике Да здравствует российская наука
Да здравствует российская наука История кинематики
История кинематики Скорость выполнения работы. Формула работы
Скорость выполнения работы. Формула работы Мощность. Единицы мощности
Мощность. Единицы мощности Судың физикалық қасиеттері
Судың физикалық қасиеттері Учение физики, открывшие газовые законы
Учение физики, открывшие газовые законы Гармонические колебания. Амплитуда, период и частота колебательного движения
Гармонические колебания. Амплитуда, период и частота колебательного движения Гравитационные волны
Гравитационные волны Сила упругости
Сила упругости Передача давления жидкостями и газами. Закон Паскаля
Передача давления жидкостями и газами. Закон Паскаля Механические и электромагнитные волны
Механические и электромагнитные волны ОГЭ-2022 по физике. Задания, требования и изменения в сравнении с ОГЭ-2020
ОГЭ-2022 по физике. Задания, требования и изменения в сравнении с ОГЭ-2020 Презентация на тему Радиоактивные превращения атомных ядер
Презентация на тему Радиоактивные превращения атомных ядер  Наука на переменках. Тест
Наука на переменках. Тест Постоянные магниты
Постоянные магниты Различие в молекулярном строении твёрдых тел, жидкостей и газов
Различие в молекулярном строении твёрдых тел, жидкостей и газов Гальванический элемент
Гальванический элемент Условия плавания тел
Условия плавания тел Работа и мощность
Работа и мощность Момент силы относительно точки и оси. Теория пар сил. Приведение произвольной системы сил к заданному центру. Теорема Вариньона
Момент силы относительно точки и оси. Теория пар сил. Приведение произвольной системы сил к заданному центру. Теорема Вариньона Презентация на тему Решение задач по теме «Закон Ома»
Презентация на тему Решение задач по теме «Закон Ома»  Напряженность электрического поля. Урок 52
Напряженность электрического поля. Урок 52 Элементы гидроаэромеханики (продолжение)
Элементы гидроаэромеханики (продолжение) Физические процессы в приборах и системах
Физические процессы в приборах и системах