Содержание
- 2. Цель урока Формирование представлений о единой научной картине мира через модель атома Резерфорда
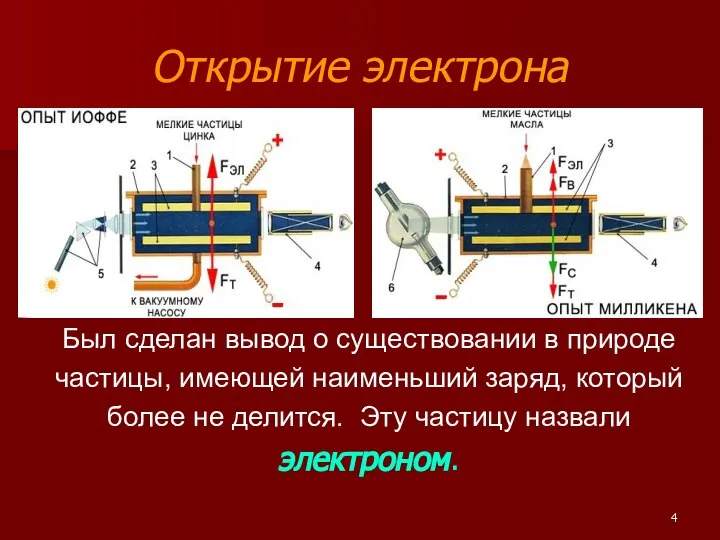
- 3. Дискретность электрического заряда Существование мельчайших частиц, имеющих наименьший электрический заряд, было доказано опытами А.Ф.Иоффе и Р.Милликена
- 4. Открытие электрона Был сделан вывод о существовании в природе частицы, имеющей наименьший заряд, который более не
- 5. Электрон Обозначают знаком ē Электрон очень мал. Масса электрона составляет 9,1* 10 -31 кг. За единицу
- 6. Заряд электрона Значение элементарного электрического заряда Заряд электрона – предел делимости электрического заряда, поэтому его называют
- 7. Модель атома Томсона Атом представляет собой равномерно положительно заряженный шар, внутри которого плавают отрицательные электроны. Дж.
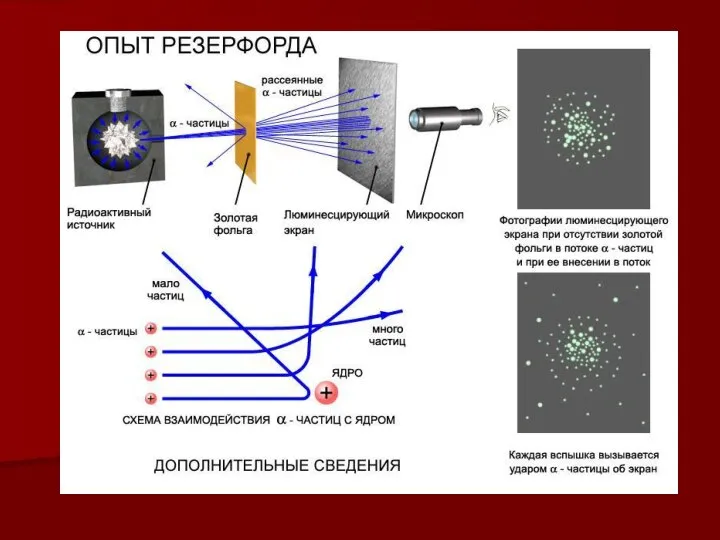
- 9. Строение атома Опыт Э.Резерфорда по рассеянию альфа-частиц привёл к открытию новой – планетарной модели атома. Э.
- 10. Модель атома Резерфорда В центре атома находится положительно заряженное ядро, состоящее из протонов и нейтронов. Вокруг
- 11. Ядро атома Занимает очень малый объём атома В нём сосредоточена почти вся масса атома Заряд ядра
- 12. Протоны Положительно заряженные элементарные частицы. Обозначают протоны знаком p+ Масса протона в 1840 раз больше массы
- 13. Нейтроны Нейтральные (не имеющие заряда) частицы ядра. Нейтроны обозначают знаком n0. Масса нейтрона приблизительно равна массе
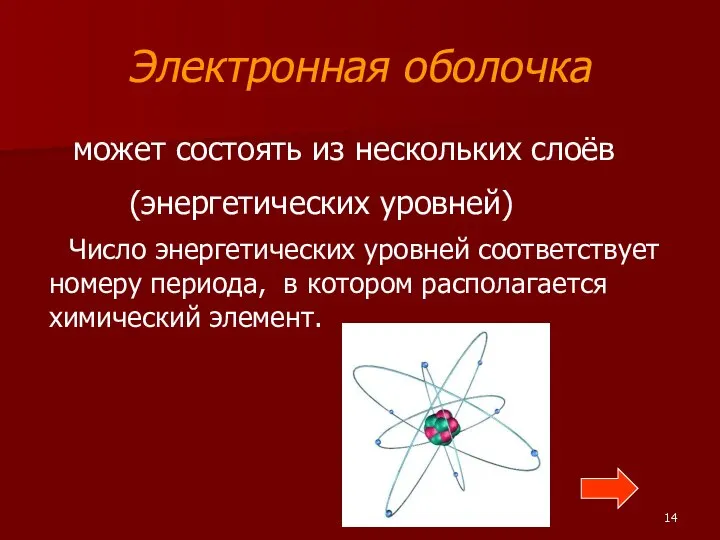
- 14. Электронная оболочка может состоять из нескольких слоёв (энергетических уровней) Число энергетических уровней соответствует номеру периода, в
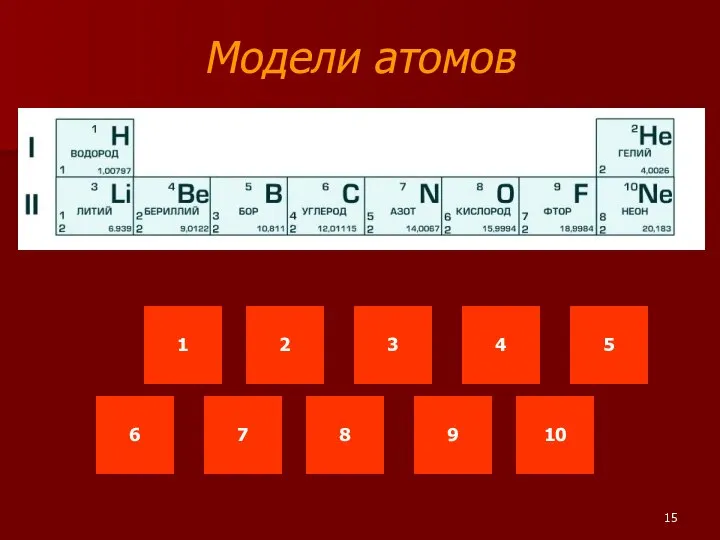
- 15. Модели атомов 1 3 4 5 10 6 7 8 9 2
- 16. Модель атома водорода 1p+ 1ē
- 17. Модель атома гелия 2p+ 2n0 2ē
- 18. Модель атома лития 3p+ 4n0 3ē
- 19. Модель атома бериллия 4p+ 5n0 4ē
- 20. Модель атома бора 5p+ 6n0 5ē
- 21. Модель атома углерода 6p+ 6n0 6ē
- 22. Модель атома азота 7p+ 7n0 7ē
- 23. Модель атома кислорода 8p+ 8n0 8ē
- 24. Модель атома фтора 9p+ 10n0 9ē
- 25. Модель атома неона 10p+ 10n0 10ē
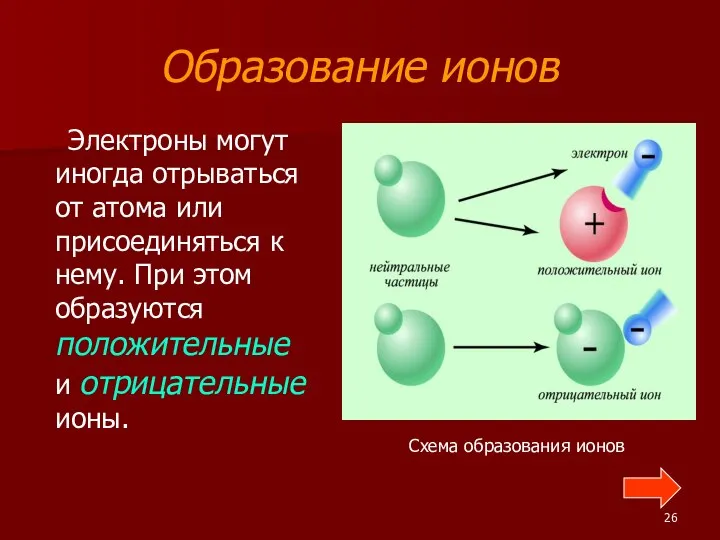
- 26. Образование ионов Электроны могут иногда отрываться от атома или присоединяться к нему. При этом образуются положительные
- 27. Схема образования иона если атом азота потерял два электрона, то он превращается в положительный ион с
- 28. Схема образования иона если атом азота приобрёл три электрона, то он превращается в отрицательный ион с
- 29. Вопросы на закрепление Как на опыте показать, что электрический заряд делится на части? Как назвали частицу
- 30. Делимость электрического заряда
- 31. Нуклоны Протон – положительно заряженная элементарная частица. Обозначение p+ Масса протона в 1840 раз больше массы
- 33. Скачать презентацию

























 Проводники и диэлектрики в электрическом поле
Проводники и диэлектрики в электрическом поле Презентация на тему История создания тепловых двигателей
Презентация на тему История создания тепловых двигателей  Будем знакомы – физика!
Будем знакомы – физика! Электрооборудование автомобиля, стартер, генератор Автомобиля ВАЗ-2190
Электрооборудование автомобиля, стартер, генератор Автомобиля ВАЗ-2190 Дрифт. Основы дрифта. Легенды дрифта
Дрифт. Основы дрифта. Легенды дрифта Siła i ruch
Siła i ruch Нанотехнологии в современном мире
Нанотехнологии в современном мире Силы в природе
Силы в природе Сопротивление материалов
Сопротивление материалов Частотные методы синтеза
Частотные методы синтеза Открытие нейтрона
Открытие нейтрона Усилитель звуковой частоты
Усилитель звуковой частоты Презентация на тему Брейн – ринг
Презентация на тему Брейн – ринг  Решение задач: Гидродинамика. Ламинарное и турбулентное течения жидкостей и газов
Решение задач: Гидродинамика. Ламинарное и турбулентное течения жидкостей и газов Тепловое излучение
Тепловое излучение Резерв
Резерв Электрический ток в газах
Электрический ток в газах Элементарные возбуждения и энергетический спектр конденсированного тела (лекции 15)
Элементарные возбуждения и энергетический спектр конденсированного тела (лекции 15) Применение правил правой и левой руки
Применение правил правой и левой руки Основные понятия и задачи кинематики (продолжение)
Основные понятия и задачи кинематики (продолжение) Обобщающий урок по теме Механика. 10 класс
Обобщающий урок по теме Механика. 10 класс Свойства жидкости
Свойства жидкости Вещества в электрическом поле
Вещества в электрическом поле Логарифмы в физике
Логарифмы в физике Интегрирование дифференциальных уравнений движения мотоцикла
Интегрирование дифференциальных уравнений движения мотоцикла Teploperedacha (1)
Teploperedacha (1) Виртуальные лаборатории на уроках физики
Виртуальные лаборатории на уроках физики Дефекты кристаллического строения (лекция 2)
Дефекты кристаллического строения (лекция 2)