Содержание
- 2. Домашнее задание § 113 (учебник физики 10 класс, Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Соцкий, М. Просвещение, 2016) ЕГЭ с.
- 3. По электрическим свойствам все жидкости можно разделить на 2 группы ПРОВОДЯЩИЕ НЕПРОВОДЯЩИЕ Содержащие свободные заряженные частицы
- 4. Проводимость разных веществ
- 5. Na Cl Na+ Cl- NaCl → Na+ + Cl- При диссоциации ионы металлов и водорода всегда
- 6. Электролиты обладают ионной проводимостью. Степень диссоциации – отношение числа молекул, диссоциировавших на ионы, к общему количеству
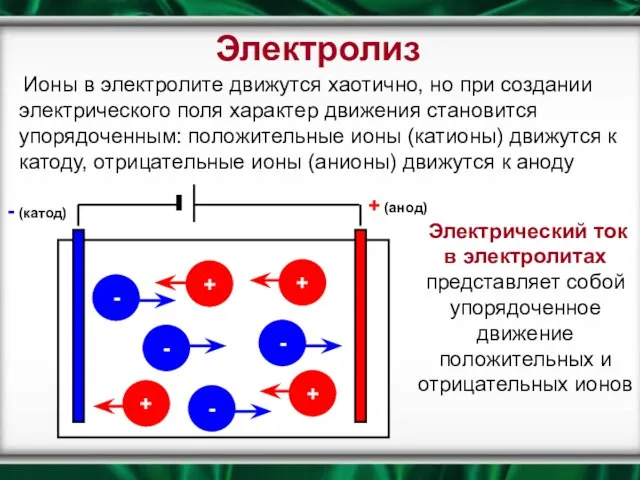
- 7. Ионы в электролите движутся хаотично, но при создании электрического поля характер движения становится упорядоченным: положительные ионы
- 8. Рассмотрим, что происходит, когда ионы достигают электродов (на примере СuCl2) CuCl2 → Cu2+ + 2Cl -
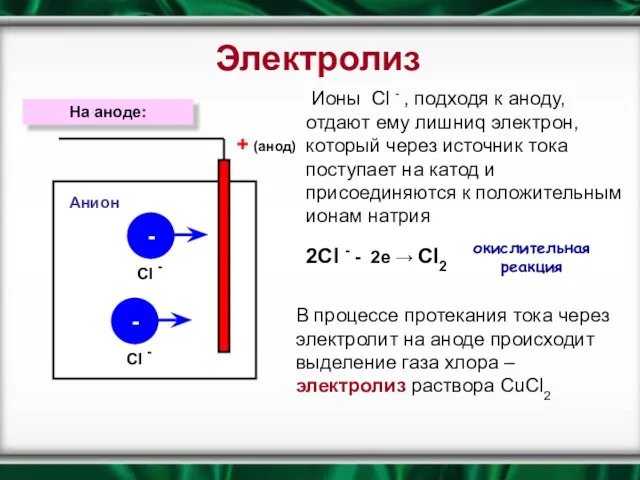
- 9. На аноде: + (анод) - - Ионы Сl - , подходя к аноду, отдают ему лишниq
- 10. При ионной проводимости прохождение тока связано с переносом вещества. Выделение вещества на электродах вследствие окислительно –
- 11. Сопротивление растворов электролитов Закон Ома справедлив при неизменной концентрации раствора и температуре. Сопротивление растворов электролитов уменьшается
- 12. Законы электролиза Этот закон был открыт опытным путем в 1833 году английским ученым Майклом Фарадеем. Закон
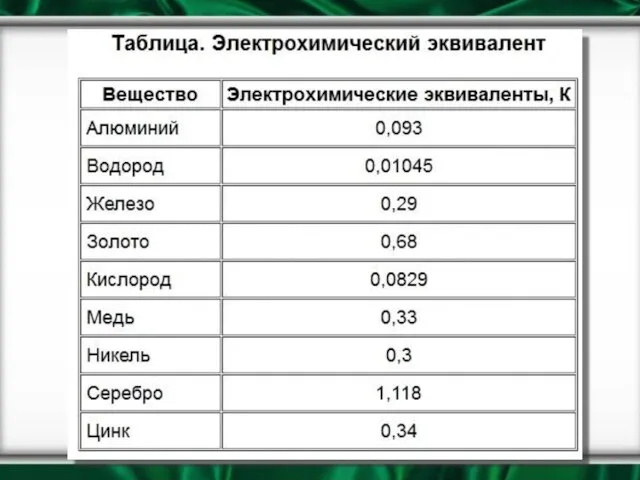
- 13. Электрохимический эквивалент вещества Электрохимический эквивалент вещества зависит от рода вещества (от молярной массы вещества «М» и
- 15. Определение заряда электрона с помощью электролиза Зная массу выделившегося вещества при прохождении заряда, молярную массу, валентность
- 16. Постоянная Фарадея Физический смысл: F – численно равна заряду, который надо пропустить через раствор электролита, чтобы
- 17. Применение электролиза Гальваностегия – декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование,
- 19. Применение электролиза Гальванопластика – электролитическое изготовление металлических копий, рельефных предметов Точность копирования формы предмета очень высокая,
- 21. Применение электролиза Гальванотехника - это отрасль прикладной электрохимии. Основателем гальванотехники и ее широчайшего применения является Борис
- 22. Применение электролиза Электрометаллургия – получение чистых металлов (Al, Na, Mg, Be) при электролизе расплавленных руд
- 24. Применение электролиза Рафинирование металлов – очистка металлов от примесей с помощью электролиза, когда неочищенный металл является
- 27. Скачать презентацию




















 Постоянные магниты. Магнитное поле Земли
Постоянные магниты. Магнитное поле Земли Магнитное_поле_в_вакууме
Магнитное_поле_в_вакууме Особенности измерения малых и больших сопротивлений
Особенности измерения малых и больших сопротивлений Презентация на тему Основные акустические опасные факторы воздействия на человека
Презентация на тему Основные акустические опасные факторы воздействия на человека  Динамика кристаллической решётки
Динамика кристаллической решётки Сила трения
Сила трения Электрические сигналы
Электрические сигналы Введение в предмет Микросхемотехника
Введение в предмет Микросхемотехника Закон Архимеда
Закон Архимеда Презентация на тему Сообщающиеся сосуды и их применение
Презентация на тему Сообщающиеся сосуды и их применение  Метод составления уравнений движения гибкого кольца при неголономных ограничениях для создания волнового гироскопа
Метод составления уравнений движения гибкого кольца при неголономных ограничениях для создания волнового гироскопа Различные изображения при помощи собирающей линзы
Различные изображения при помощи собирающей линзы Принцип Гюйгенса. Дифракция механических волн. Волновое движение
Принцип Гюйгенса. Дифракция механических волн. Волновое движение Лупа, фотоаппарат, проектор
Лупа, фотоаппарат, проектор 9 кл Механическое дв-ние
9 кл Механическое дв-ние Использование элементов развивающего обучения на уроках физики по сингапурской системе обучения
Использование элементов развивающего обучения на уроках физики по сингапурской системе обучения Экспериментальный набор для демонстрации принципа работы электродвигателя постоянного тока
Экспериментальный набор для демонстрации принципа работы электродвигателя постоянного тока Электростатическое поле в вакууме
Электростатическое поле в вакууме Форма и характеристики электрических сигналов. Анализ
Форма и характеристики электрических сигналов. Анализ HSC & HRD
HSC & HRD Насыщенный и ненасыщенный пар. Влажность воздуха
Насыщенный и ненасыщенный пар. Влажность воздуха Ультрафиолетовое излучение
Ультрафиолетовое излучение Световые кольца. Лазер
Световые кольца. Лазер Дифузiя навколо нас
Дифузiя навколо нас Проводники и диэлектрики в электрическом поле
Проводники и диэлектрики в электрическом поле Решение задач
Решение задач Регулировка уровня принимаемого сигнала диаграммой направленности антенн
Регулировка уровня принимаемого сигнала диаграммой направленности антенн Сила Архимеда 7 класс - Презентация_
Сила Архимеда 7 класс - Презентация_