Слайд 2 Фазой называется состояние вещества, характеризующееся тем, что оно занимает определённую область пространства,

и в пределах это области параметры и свойства вещества либо остаются постоянными, либо изменяются непрерывно.
Эта пространственная область отделена от других частей пространства границей. Масса вещества, содержащегося в одной фазе, с течением времени может меняться. В этом случае говорят о фазовом переходе.
Слайд 3 Выделяют следующие наиболее распространённые фазовые переходы:
1) кипение (переход вещества из жидкости в

пар);
2) конденсация (переход вещества из пара в жидкость);
3) кристаллизация, затвердение (переход вещества из жидкости в твёрдое состояние);
4) плавление (переход вещества из твёрдого состояния в жидкость).
Слайд 4 Рассмотрим фазовую T-S диаграмму.

Слайд 5Ж – жидкость
Ж+Т – жидкость+тело
НК – надкритическая область
Г – область газа;
Ж+П –

влажный пар
bkc – кривая насыщения;
bk – линия насыщенной жидкости
kc – линия сухого насыщенного пара
abc – линия тройных точек
be – линия начала процесса затвердевания или окончания процесса плавления
ad – линия окончания процесса затвердевания или начала процесса плавления
dek – изотерма критической точки
Слайд 6 k – критическая точка. Характеризуется тем, что при температуре, выше критической ,

невозможно получить жидкость с помощью изотермического сжатия. Критическое давление и температура – это давления и температура ниже критической точки.
Область Г – область газа. Эта область находится при давлении ниже критического, и температуре выше критической. Область газа характеризуется тем, что состояние газа в этой области описывается уравнением состояния идеального газа.
Область ПП - область перегретого пара. Располагается при температуре ниже критической и справа от линии kc.
Слайд 7 Область Ж+П - область влажного пара. Ограничивается кривой насыщения и линией тройных

точек. Это двухфазная область, характеризуемая равновесным состоянием насыщенного пара и насыщенной жидкости. Эта область протекания процессов конденсации и кипения.
Область Ж. - область переохлажденной жидкости. Она ограничена сверху критической изотермой, справа - линией насыщенной жидкости, слева - линией начала кристаллизации.
Область Т+Ж - двухфазовая область равновесного сосуществования жидкой фазы и твердой. Эта область протекания процессов затвердевания (кристаллизации) плавления.
Область Т+П - двухфазовая область равновесного сосуществования насыщенного пара и твердого тела.
Слайд 8 Тройной точкой называется состояние равновесия сразу трёх агрегатных состояний. Эта область протекания

процессов сублимации и десублимации.
Сублимацией называют процесс перехода твёрдой фазы в газообразную. Десублимацией называют процесс перехода насыщенного пара в твёрдую фазу.
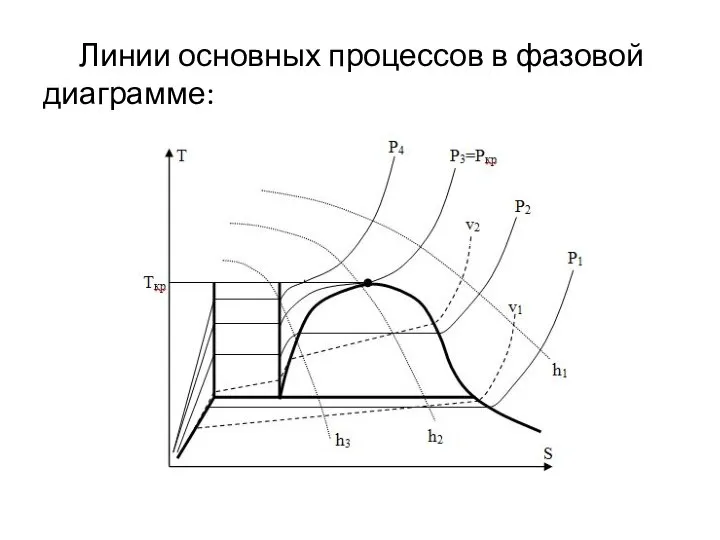
Слайд 9 Линии основных процессов в фазовой диаграмме:








 Диполь. Поле системы зарядов. Теорема Ирншоу
Диполь. Поле системы зарядов. Теорема Ирншоу Принцип Гюйгенса. Закон отражения света. Плоские и сферические зеркала. Закон преломления света. Полное внутреннее отражение
Принцип Гюйгенса. Закон отражения света. Плоские и сферические зеркала. Закон преломления света. Полное внутреннее отражение Рефрактометрия. Преломление света
Рефрактометрия. Преломление света Порядок заправки верхней и нижней нити
Порядок заправки верхней и нижней нити Физика и познание мира
Физика и познание мира Цепь переменного тока с индуктивностью
Цепь переменного тока с индуктивностью Устройство электроскопа
Устройство электроскопа Основные физические явления, используемые в работе ТСО. Тема 3
Основные физические явления, используемые в работе ТСО. Тема 3 Дефектация деталей
Дефектация деталей Электромагнитная индукция
Электромагнитная индукция Электронные средства обучения
Электронные средства обучения Закон инерции. Инерциальная система отсчёта. Первый закон Ньютона. Сила. Измерение сил
Закон инерции. Инерциальная система отсчёта. Первый закон Ньютона. Сила. Измерение сил Атомы
Атомы Микроскоп
Микроскоп 13. СВЕТОТЕХНИКА 2020
13. СВЕТОТЕХНИКА 2020 Луиджи Гальвани и Алессандро Вольта. Тема № 5
Луиджи Гальвани и Алессандро Вольта. Тема № 5 Плакаты по физике
Плакаты по физике Солитоны
Солитоны Условная структура атома
Условная структура атома Генератор электрического тока
Генератор электрического тока Механические колебания
Механические колебания Экологическое воспитание на внеурочных занятиях по физике
Экологическое воспитание на внеурочных занятиях по физике Оптимизация программы для определения частоты аудиосигнала
Оптимизация программы для определения частоты аудиосигнала Механическая работа. Энергия
Механическая работа. Энергия Внутренняя энергия
Внутренняя энергия Явления тяготения. Сила тяжести
Явления тяготения. Сила тяжести Электромагнитные колебания и волны
Электромагнитные колебания и волны Из истории открытия закона всемирного тяготения…
Из истории открытия закона всемирного тяготения…