Содержание
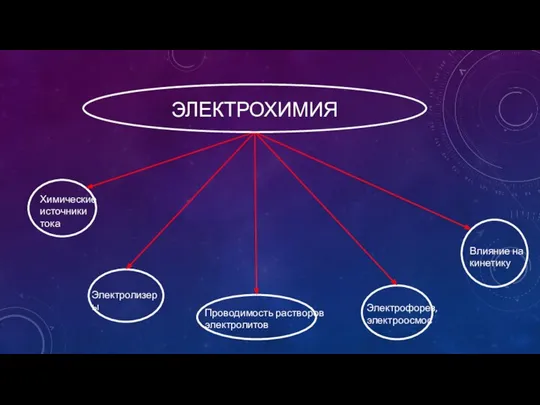
- 2. ЭЛЕКТРОХИМИЯ Химические источники тока Электролизеры Проводимость растворов электролитов Влияние на кинетику Электрофорез, электроосмос
- 3. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Выделяется или поглощается энергия в виде тепла
- 4. НАПРИМЕР, ЦИНКОВАЯ ПЛАСТИНКА Это можно юзать!
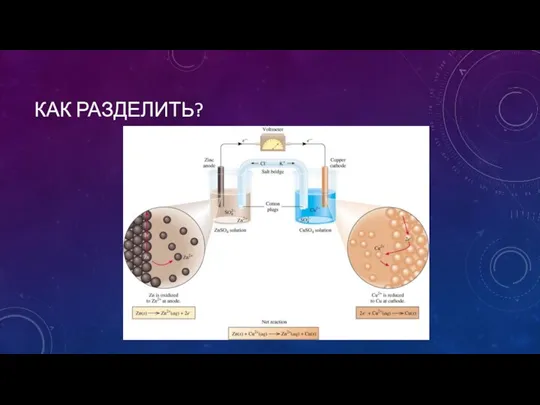
- 5. КАК РАЗДЕЛИТЬ?
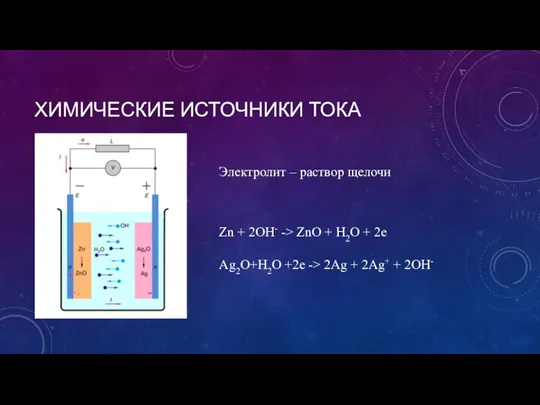
- 6. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА Zn + 2OH- -> ZnO + H2O + 2e Ag2O+H2O +2e -> 2Ag
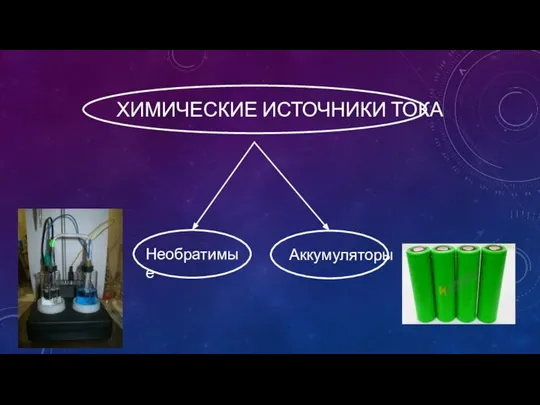
- 7. ХИМИЧЕСКИЕ ИСТОЧНИКИ ТОКА Необратимые Аккумуляторы
- 8. ПРИМЕР АККУМУЛЯТОРА – СВИНЦОВО-КИСЛОТНЫЙ Разряд – в прямом направлении, заряд – в обратном Сложности: 1) Расходование
- 9. ЗАДАНИЕ, ВСЕ КАК ВЫ ЛЮБИТЕ Покажите, что при разряде протекают прямые реакции, а при заряде –
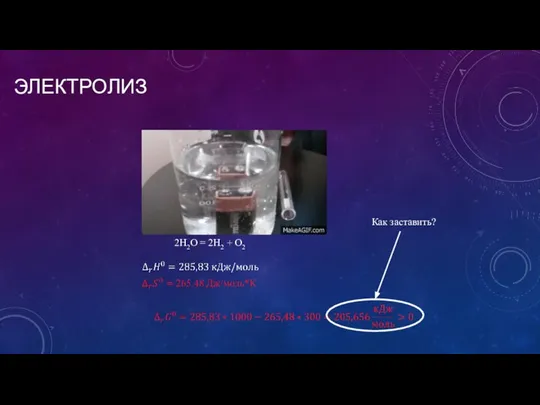
- 10. ЭЛЕКТРОЛИЗ 2H2O = 2H2 + O2 Как заставить?
- 11. ПРИМЕНЕНИЯ 1) Получение металлов и других веществ – хлора, гидроксида натрия, водорода и т. д. 2)
- 12. ЗАКОН ФАРАДЕЯ И КУЛОНОМЕТРИЯ Закон Фарадея: m = (Q/F)(M/z) => можно измерить массу выделившегося на электроде
- 13. ЭЛЕКТРОПРОВОДНОСТЬ УДЕЛЬНАЯ И МОЛЯРНАЯ В растворах электролитов есть заряженные частицы, значит эти растворы могут проводить ток.
- 14. ЗАВИСИМОСТЬ ОТ КОНЦЕНТРАЦИИ Рост – увеличение концентрации ионов. Падение – образование агрегатов, торможение противоположно направленными ионами
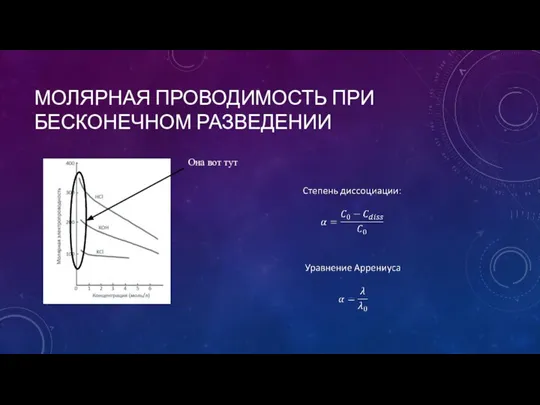
- 15. МОЛЯРНАЯ ПРОВОДИМОСТЬ ПРИ БЕСКОНЕЧНОМ РАЗВЕДЕНИИ Она вот тут
- 16. ПОМНИТЕ? БУМАГА ВСЕ СТЕРПИТ После диссоциации: CAB = CAB,0(1-α), CA+ = CB- = CAB,0 α Можно
- 17. ЕЩЕ ЗАДАНИЕ! КЛАССНО, ПРАВДА? Раствор какой соли проводит ток лучше? (концентрация 0,001 моль/л)
- 18. КОНДУКТОМЕТРИЯ
- 20. Скачать презентацию











 Перепад давления
Перепад давления Ферромагнетики. Относительная магнитная проницаемость вещества
Ферромагнетики. Относительная магнитная проницаемость вещества Термодинамика. Фазовые переходы
Термодинамика. Фазовые переходы Краткие сведения из физической оптики. Явления дифракции, дисперсии, интерференции. Лазерные источники излучения. Лекция №3
Краткие сведения из физической оптики. Явления дифракции, дисперсии, интерференции. Лазерные источники излучения. Лекция №3 Разветвленные цепи. Правила Кирхгофа
Разветвленные цепи. Правила Кирхгофа Энергия связи
Энергия связи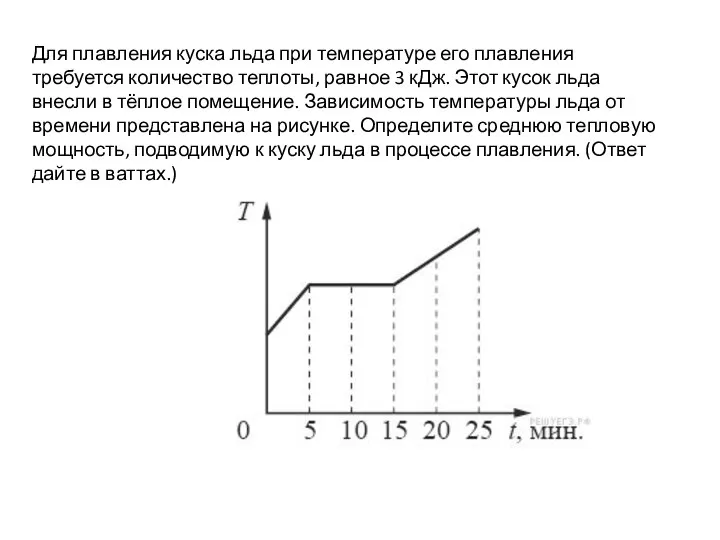 Определение тепловой мощности. ВПР, 9 класс
Определение тепловой мощности. ВПР, 9 класс Решение задач с помощью законов Ньютона
Решение задач с помощью законов Ньютона Приёмы целеполагания на уроках открытия новых знаний на уроках физики
Приёмы целеполагания на уроках открытия новых знаний на уроках физики Простые механизмы
Простые механизмы Теоретическая механика. Кинематика. Движение твердой среды
Теоретическая механика. Кинематика. Движение твердой среды Отражение и преломление света
Отражение и преломление света Сложение двух сил, направленных по одной прямой. Равнодействующая сил
Сложение двух сил, направленных по одной прямой. Равнодействующая сил Изучение процессов поглощения энергии при испарении жидкости и выделения ее при конденсации пара
Изучение процессов поглощения энергии при испарении жидкости и выделения ее при конденсации пара Решение задач на смеси
Решение задач на смеси Введение в волновую оптику. Энергия ЭМ волн. Вектор Пойнтинга. Лекция 2с 8 (1)
Введение в волновую оптику. Энергия ЭМ волн. Вектор Пойнтинга. Лекция 2с 8 (1) Балочные системы
Балочные системы Механическое движение
Механическое движение Устройство для наматывания нижней нити на шпульку
Устройство для наматывания нижней нити на шпульку Теплофизика процесса резания
Теплофизика процесса резания Электрическая диссоциация
Электрическая диссоциация Манометры
Манометры Презентация на тему Сейсмограф
Презентация на тему Сейсмограф  Устройство и принцип работы сцепления. Теоретическая подготовка водителей
Устройство и принцип работы сцепления. Теоретическая подготовка водителей Фізика прискорювачів
Фізика прискорювачів Электрические и магнитные дипольные моменты и энергия взаимодействия микрочастиц с внешним полем
Электрические и магнитные дипольные моменты и энергия взаимодействия микрочастиц с внешним полем Порядок действий при сборке конструкции/ механизма
Порядок действий при сборке конструкции/ механизма Использование простых механизмов
Использование простых механизмов