Содержание
- 2. Цель урока: Установить зависимость между термодинамическими параметрами при неизменном третьем. Задачи: 1.Образовательные: -изучить , используя групповой
- 3. ПЛАН УРОКА: I. Организационный момент. II. Подготовка к восприятию нового материала. III. Сообщение темы и цели
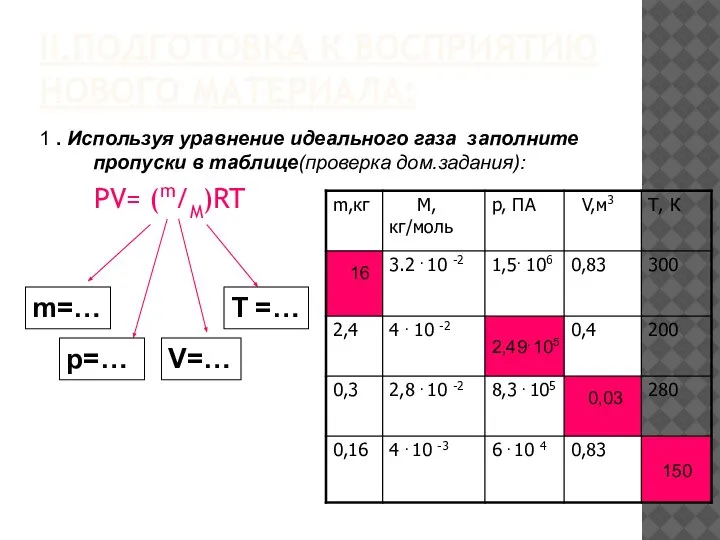
- 4. II.ПОДГОТОВКА К ВОСПРИЯТИЮ НОВОГО МАТЕРИАЛА: PV= (m/M)RT m=… p=… V=… T =… 1 . Используя уравнение
- 5. 2.Теоретический опрос в форме теста, с выбором правильного ответа: 1.Какая из приведённых формул является уравнением Клапейрона:
- 6. III. Сообщение темы и целей урока: Все знают: мир из Атомов построен, – Но был не
- 7. IV. Изучение нового материала. Мы знаем термодинамические параметры P, V, T, между которыми, согласно уравнению Менделеева
- 8. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС - V р1 р2 процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре
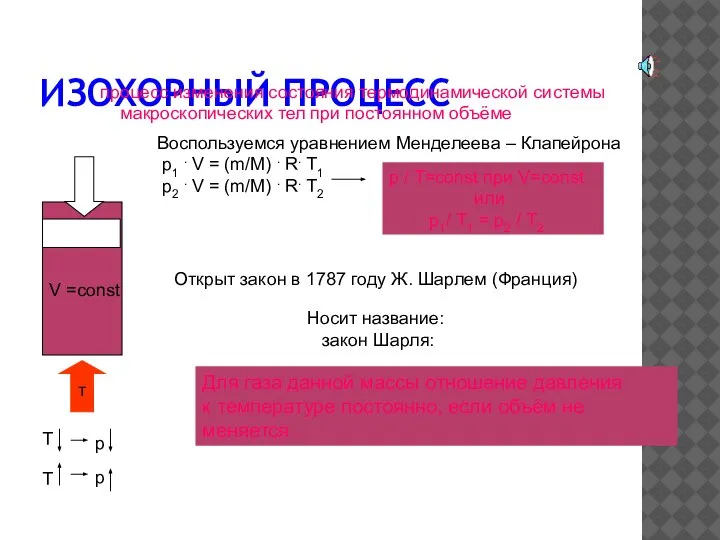
- 9. ИЗОХОРНЫЙ ПРОЦЕСС процесс изменения состояния термодинамической системы макроскопических тел при постоянном объёме Воспользуемся уравнением Менделеева –
- 10. ИЗОБАРНЫЙ ПРОЦЕСС процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении. Воспользуемся уравнением Менделеева –
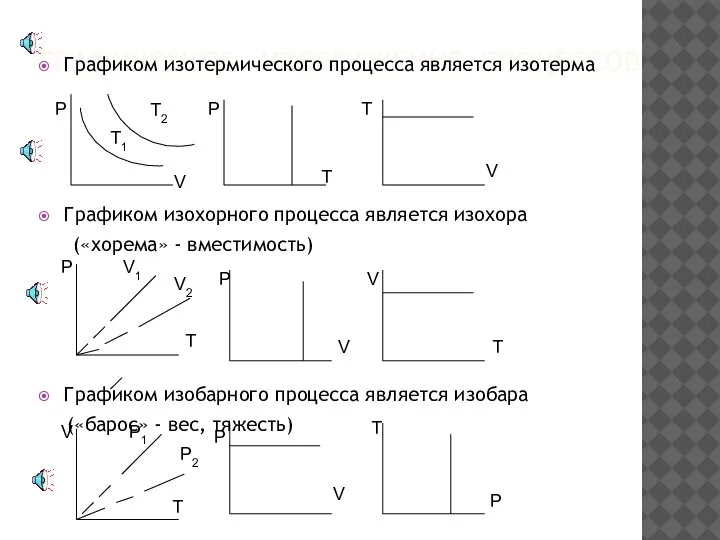
- 11. ГРАФИЧЕСКОЕ ИЗОБРАЖЕНИЕ ПРОЦЕССОВ Графиком изотермического процесса является изотерма Графиком изохорного процесса является изохора («хорема» - вместимоcть)
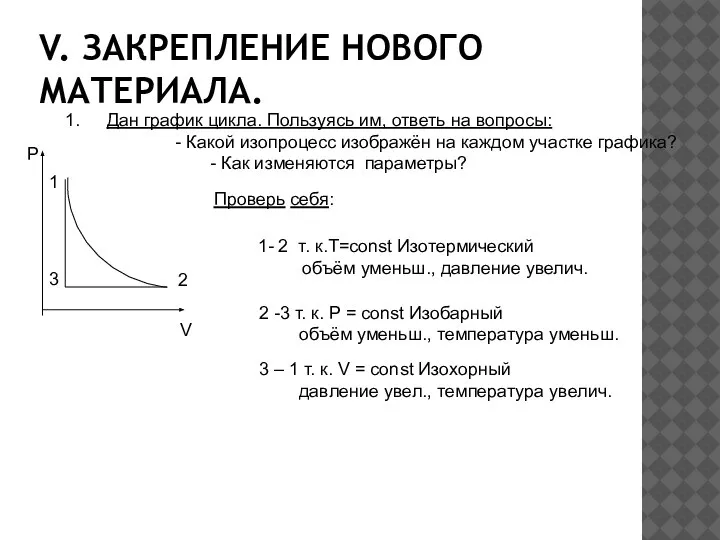
- 12. V. ЗАКРЕПЛЕНИЕ НОВОГО МАТЕРИАЛА. Дан график цикла. Пользуясь им, ответь на вопросы: - Какой изопроцесс изображён
- 13. 2. Решите задачу: № 521 ( сборник задач А.П. Рымкевич) Условие задачи: При температуре – 27о
- 15. Скачать презентацию








 Презентация на тему Второй закон Ньютона
Презентация на тему Второй закон Ньютона  Ток проводимости в металлах, его характеристики и условия существования
Ток проводимости в металлах, его характеристики и условия существования Презентация на тему КПД тепловых двигателей (8 класс)
Презентация на тему КПД тепловых двигателей (8 класс)  Физика в физкультуре
Физика в физкультуре Общее устройство сеялки
Общее устройство сеялки Строение атома и атомного ядра
Строение атома и атомного ядра Взаимодействие тел (1)
Взаимодействие тел (1) Сверхпроводи́мость
Сверхпроводи́мость Линзы. Ход лучей в линзах
Линзы. Ход лучей в линзах Становление физиологии. Ятрофизика, ятромеханика
Становление физиологии. Ятрофизика, ятромеханика Постоянные магниты
Постоянные магниты Идеальный газ в МКТ. Среднее значение квадрата скорости
Идеальный газ в МКТ. Среднее значение квадрата скорости Клей. История клея
Клей. История клея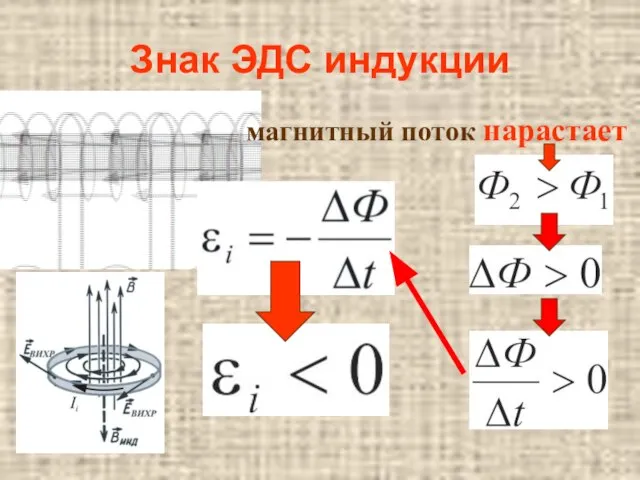 Закон электромагнитной индукции
Закон электромагнитной индукции Жоғары рұқсат етілім литографиясы
Жоғары рұқсат етілім литографиясы Энергия. Задачи
Энергия. Задачи Электричество и магнетизм. Электрическое поле в диэлектриках (Лекция 5)
Электричество и магнетизм. Электрическое поле в диэлектриках (Лекция 5) Марковские процессы
Марковские процессы Термическое разупрочнение деформированного металла
Термическое разупрочнение деформированного металла Свободные и вынужденные колебания. Резонанс
Свободные и вынужденные колебания. Резонанс Применение первого закона термодинамики к изопроцессам Шубина Ольга Владимировна Учитель физики МКОУСОШ №2 г. Орлов Кировской о
Применение первого закона термодинамики к изопроцессам Шубина Ольга Владимировна Учитель физики МКОУСОШ №2 г. Орлов Кировской о Сложение сил. Равнодействующая сил
Сложение сил. Равнодействующая сил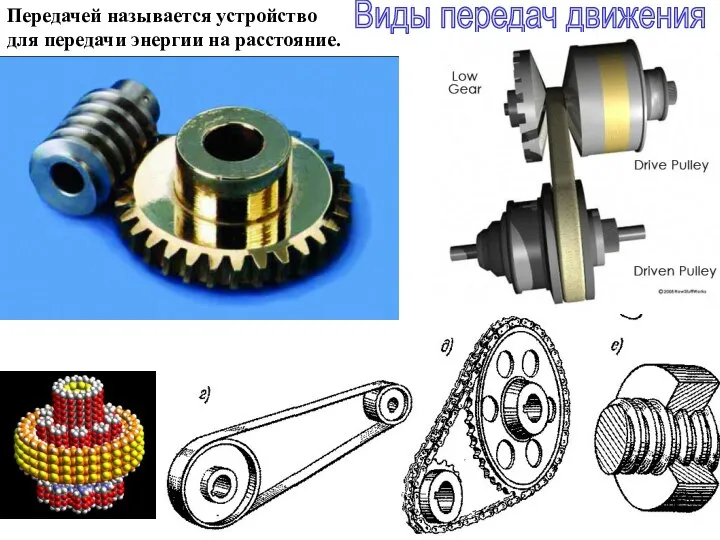 Виды передач движения
Виды передач движения Изучение процессов поглощения энергии при испарении жидкости и выделения ее при конденсации пара
Изучение процессов поглощения энергии при испарении жидкости и выделения ее при конденсации пара Лампа накаливания
Лампа накаливания Магнетизм. Переменный ток. (Лекция 5)
Магнетизм. Переменный ток. (Лекция 5) Продолжение молекулярной физики
Продолжение молекулярной физики Напряженность и потенциал
Напряженность и потенциал