Содержание
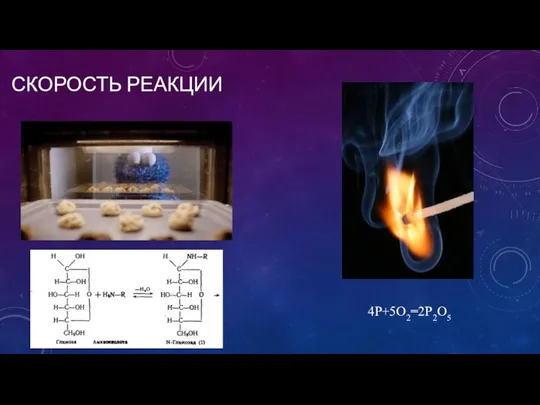
- 2. СКОРОСТЬ РЕАКЦИИ 4P+5O2=2P2O5
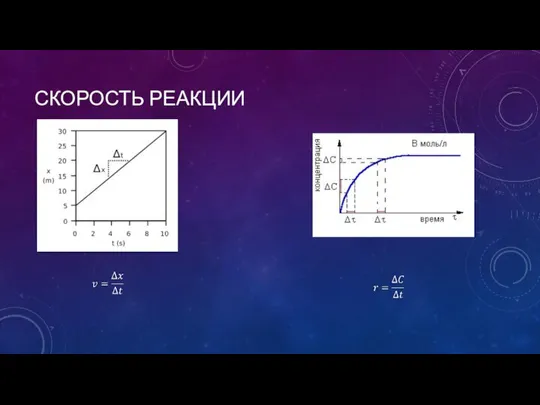
- 3. СКОРОСТЬ РЕАКЦИИ
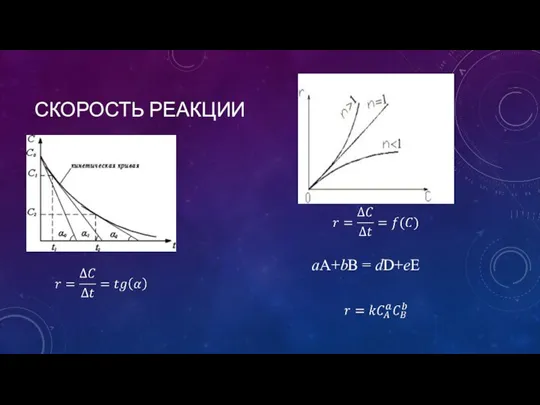
- 4. СКОРОСТЬ РЕАКЦИИ aA+bB = dD+eE
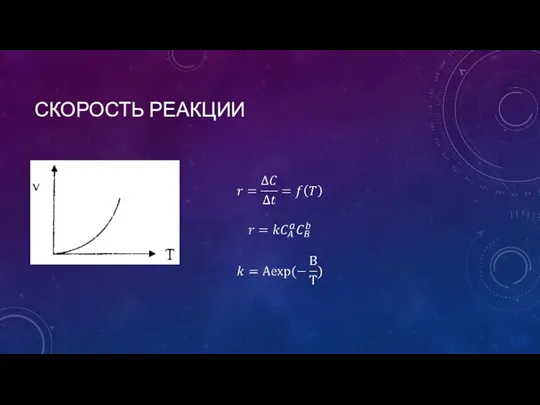
- 5. СКОРОСТЬ РЕАКЦИИ
- 6. МОЛЕКУЛЯРНО-КИНЕТИЧЕСКАЯ ТЕОРИЯ Вещество состоит из мелких частиц Они находятся в хаотичном (тепловом движении) Взаимодействуют друг с
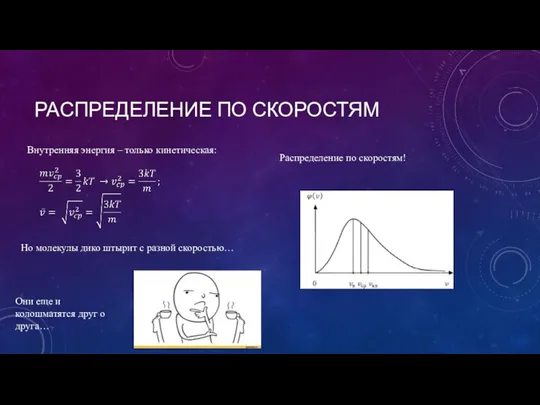
- 7. РАСПРЕДЕЛЕНИЕ ПО СКОРОСТЯМ Внутренняя энергия – только кинетическая: Но молекулы дико штырит с разной скоростью… Распределение
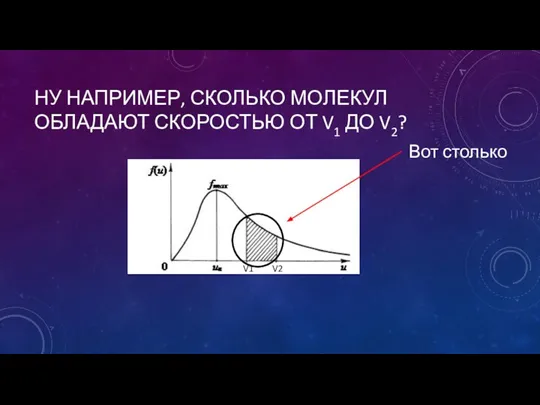
- 8. НУ НАПРИМЕР, СКОЛЬКО МОЛЕКУЛ ОБЛАДАЮТ СКОРОСТЬЮ ОТ V1 ДО V2? V1 V2 Вот столько
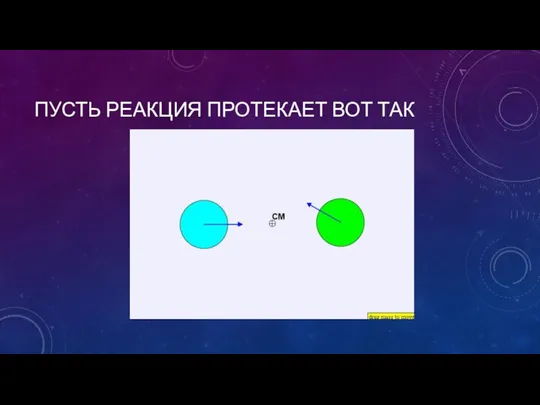
- 9. ПУСТЬ РЕАКЦИЯ ПРОТЕКАЕТ ВОТ ТАК
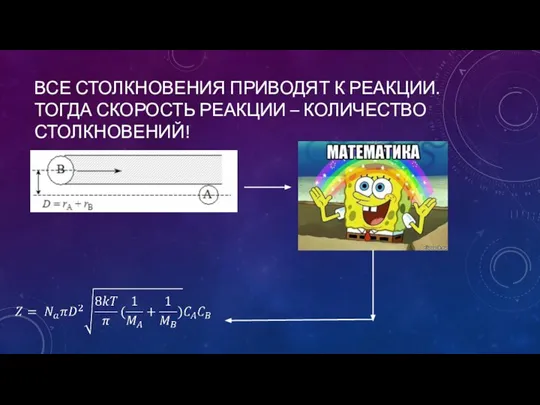
- 10. ВСЕ СТОЛКНОВЕНИЯ ПРИВОДЯТ К РЕАКЦИИ. ТОГДА СКОРОСТЬ РЕАКЦИИ – КОЛИЧЕСТВО СТОЛКНОВЕНИЙ!
- 11. ЧТО-ТО НЕ ТАК Теория Эксперимент
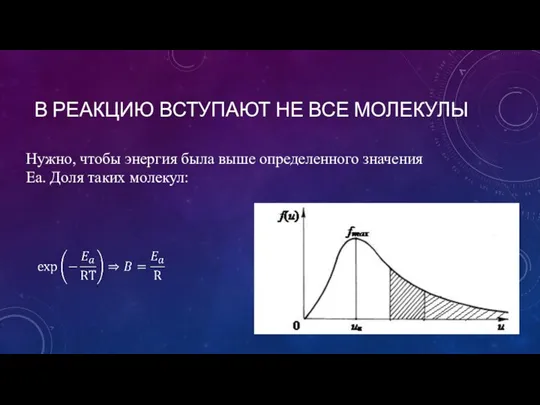
- 12. В РЕАКЦИЮ ВСТУПАЮТ НЕ ВСЕ МОЛЕКУЛЫ Нужно, чтобы энергия была выше определенного значения Ea. Доля таких
- 13. ЗАВИСИМОСТЬ ОТ ТЕМПЕРАТУРЫ Тут я лучше нарисую на доске Расчетные скорости отличаются от истинных, потому что
- 14. ДИФФУЗИЯ Направлен против изменения концентрациии, происходит сам собой, медленно, D – важная штука
- 15. СРАЗУ К ДЕЛУ. ПРОТЕКАЕТ РЕАКЦИЯ В РАСТВОРЕ Но здесь они диффундируют! Подумаем над этим
- 17. Скачать презентацию





 Сверхпроводимость. Свойства
Сверхпроводимость. Свойства 13. СВЕТОТЕХНИКА 2020
13. СВЕТОТЕХНИКА 2020 Sila_Trenia_33
Sila_Trenia_33 Перенос графена на произвольную подложку
Перенос графена на произвольную подложку Интегрирование дифференциальных уравнений движения мотоцикла
Интегрирование дифференциальных уравнений движения мотоцикла 10 плавление
10 плавление Презентация на тему Формула Ньютона-Лейбница
Презентация на тему Формула Ньютона-Лейбница  Понятие импульса
Понятие импульса Современные технологии обеспечения аэродинамических свойств легковых автомобилей
Современные технологии обеспечения аэродинамических свойств легковых автомобилей Периодическое движение. Вращение. Колебание
Периодическое движение. Вращение. Колебание Физические методы анализа
Физические методы анализа Устройство механической коробки передач
Устройство механической коробки передач Примеры некорректных задач. Уравнения математической физики. Режимы с обострением
Примеры некорректных задач. Уравнения математической физики. Режимы с обострением Гидростатическое давление в точке. Тема 1
Гидростатическое давление в точке. Тема 1 Электрический ток в различных средах
Электрический ток в различных средах Основные характеристики гребных винтов
Основные характеристики гребных винтов Сила трения
Сила трения Простые механизмы. Рычаг
Простые механизмы. Рычаг Проводники с током в магнитном поле. Лекция 7
Проводники с током в магнитном поле. Лекция 7 Введение в волновую оптику. Энергия ЭМ волн. Вектор Пойнтинга. Лекция 2с 8 (1)
Введение в волновую оптику. Энергия ЭМ волн. Вектор Пойнтинга. Лекция 2с 8 (1) Электромагнитные колебания. Колебательный контур 2022 дистант
Электромагнитные колебания. Колебательный контур 2022 дистант Внутренняя энергия
Внутренняя энергия Электроемкость и конденсаторы
Электроемкость и конденсаторы Фотоны. Давление света. Корпускулярно-волновой дуализм
Фотоны. Давление света. Корпускулярно-волновой дуализм Презентация на тему Сопротивление материалов
Презентация на тему Сопротивление материалов  памятка по термостатам
памятка по термостатам Волновые свойства света
Волновые свойства света Паровые машины. (8 класс)
Паровые машины. (8 класс)