Слайд 3Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной

связи для достижения более эффективного перекрывания орбиталей.
Слайд 4Различные орбитали, несильно отличающиеся энергиями, образуют соответствующее число гибридных орбиталей. Число гибридных

орбиталей равно числу атомных орбиталей, участвующих в гибридизации. Гибридные орбитали одинаковы по форме электронного облака и по энергии.
Слайд 5В гибридизации участвуют не только связывающие электроны, но и неподеленные электронные пары.

Слайд 6По сравнению с атомными орбиталями гибридные более вытянуты в направлении образования химических

связей и поэтому обуславливают лучшее перекрывание электронных облаков.
Слайд 7Гибридная орбиталь больше вытянута по одну сторону ядра,
чем по другую.

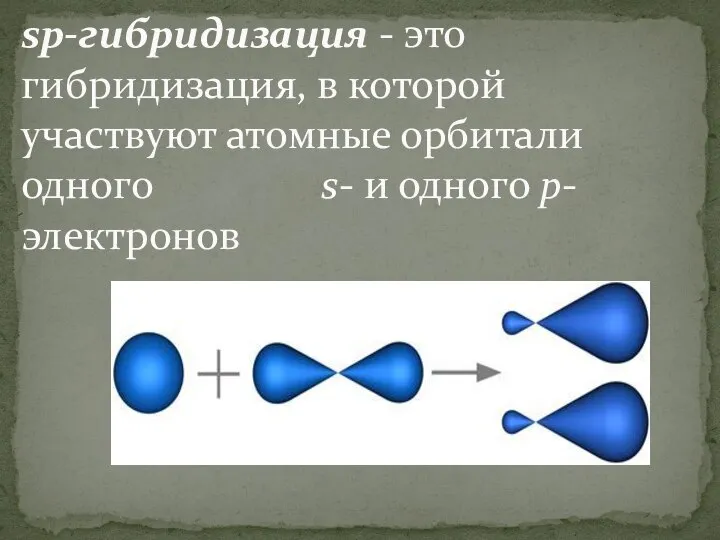
Слайд 9sp-гибридизация - это гибридизация, в которой участвуют атомные орбитали одного s- и одного p-электронов
Слайд 10
В процессе гибридизации образуются 2 гибридные орбитали, которые ориентируются друг к другу под

углом 180°
Слайд 11
Представление о sp-гибридизации орбиталей можно применить для объяснения линейной формы молекулы BeH2, в

которой атом бериллия образован гибридными
sp-орбиталями.
Слайд 12Образование молекулы фторида бериллия .
Каждый атом фтора, входящий в состав этой молекулы,

обладает одним неспаренным электроном,
который и участвует в образовании ковалентной связи.
Слайд 13
Атом бериллия в невозбужденном состоянии неспаренных электронов не имеет:
Поэтому для участия в образовании
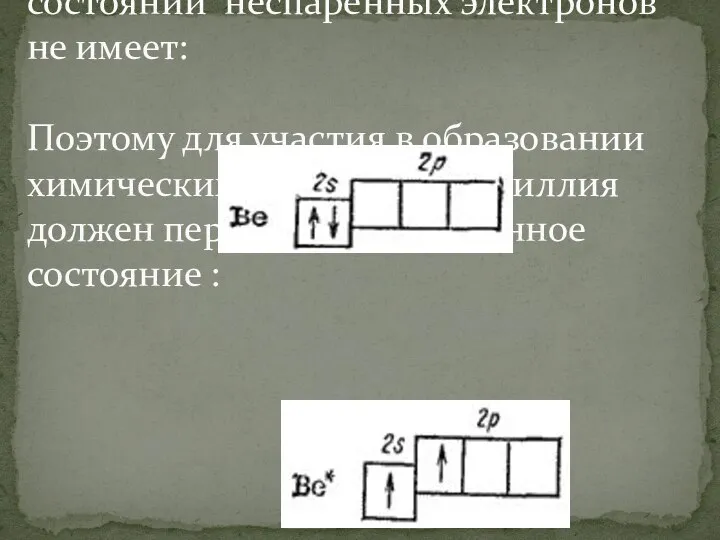
химических связей атом бериллия должен перейти в возбужденное состояние :
Слайд 14при затрате некоторой энергии вместо исходных s- и р-орбиталей атома бериллия могут

образоваться две равноценные гибридные орбитали
(sp-орбитали).
Слайд 15Примеры химических соединений, для которых характерна
sp-гибридизация: BeCl2, BeH2,CO, CO2, HCN, карбин, ацетиленовые углеводороды (алкины).

Слайд 16sp2-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и двух p-электронов

Слайд 17В результате гибридизации образуются три гибридные sp2 орбитали, расположенные в одной плоскости под углом

120° друг к другу
Слайд 18Этот тип гибридизации наблюдается в молекуле BCl3.

Слайд 19sp2-гибридизация атома бора в молекуле фторида бора .
Здесь вместо исходных одной s-
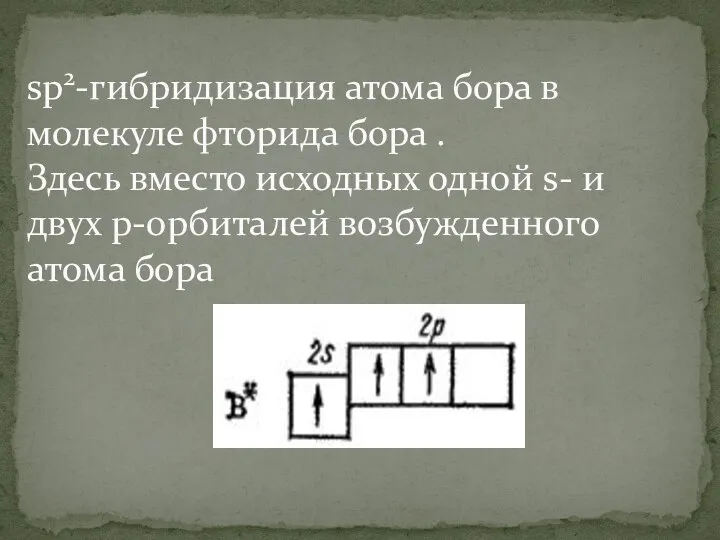
и двух р-орбиталей возбужденного атома бора
Слайд 20образуются три равноценные
sp2-орбитали. Поэтому молекула построена в форме правильного треугольника, в центре которого

расположен атом бора, а в вершинах—атомы фтора.
Слайд 21Примеры соединений, в которых наблюдается sp2-гибридизация: SO3, BCl3, BF3, AlCl3, CO32-, NO3-, графит,

этиленовые углеводороды (алкены), карбоновые кислоты и ароматические углеводороды (арены).
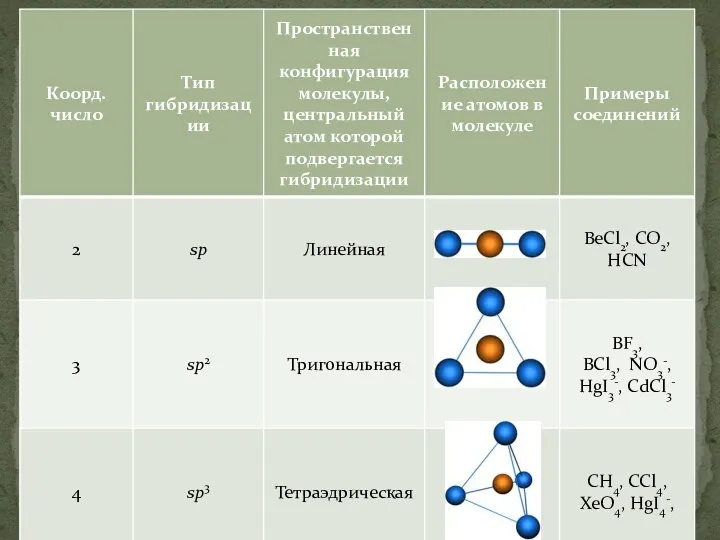
Слайд 22sp3-гибридизация – гибридизация, в которой участвуют атомные орбитали одного s- и трех
p-электронов

Слайд 23Четыре sp3-гибридные орбитали симметрично ориентированны в пространстве под углом 109°28'

Слайд 24
не всегда пространственная конфигурация молекулы соответствует тетраэдру, это зависит от числа атомов

в молекуле.
Примером тому служат молекул воды и аммиакаNH3.
Слайд 25Валентность атома азота – III, его пять электронов внешнего уровня занимают четыре

орбитали, значит, тип гибридизации – sp3, но только три орбитали принимают участие в образовании химической связи. Тетраэдр без одной вершины превращается в пирамиду. Поэтому у молекулы аммиака форма молекулы пирамидальная, угол связи искажается до 107°30′.
Слайд 26кислород в молекуле воды находится в sp3 гибридном состоянии, а форма молекулы - угловая,

угол связи составляет 104°27′.
























 Классификация композитов. Волокна и матрицы. Структура и назначение
Классификация композитов. Волокна и матрицы. Структура и назначение ТО и ТР системы питания автомобилей
ТО и ТР системы питания автомобилей Кинематика. 9 класс. Контрольная работа
Кинематика. 9 класс. Контрольная работа Струнная система с упругими опорами
Струнная система с упругими опорами Кинематика точки
Кинематика точки Применение контактных и бесконтактных аппаратов и логических элементов в схемах управления электроприводом
Применение контактных и бесконтактных аппаратов и логических элементов в схемах управления электроприводом Суд над атомом. Мультимедийный урок
Суд над атомом. Мультимедийный урок Применение законов сохранения
Применение законов сохранения Расчет расхода электрической энергии
Расчет расхода электрической энергии Ременная и цепная передачи
Ременная и цепная передачи Коронная передача
Коронная передача Радиоактивные превращения атомных ядер
Радиоактивные превращения атомных ядер Электростатика. Часть 1
Электростатика. Часть 1 Статика. Условия равновесия тел
Статика. Условия равновесия тел Подготовка к ЕГЭ
Подготовка к ЕГЭ Общие сведения о системах радиосвязи. Электропитание средств связи
Общие сведения о системах радиосвязи. Электропитание средств связи Природа звука (1)
Природа звука (1) Оптика
Оптика Закон всемирного тяготения. Исаак Ньютон
Закон всемирного тяготения. Исаак Ньютон Энергетические методы расчёта упругих систем
Энергетические методы расчёта упругих систем Исследование поверхностного натяжения жидкостей. 10 класс
Исследование поверхностного натяжения жидкостей. 10 класс Волновые свойства света
Волновые свойства света Управление образования администрации Богородского муниципального района Нижегородской области Муниципальное бюджетное образо
Управление образования администрации Богородского муниципального района Нижегородской области Муниципальное бюджетное образо Беседа Понятие об источниках тока
Беседа Понятие об источниках тока Открытия математиков в 2016 году
Открытия математиков в 2016 году Презентация на тему Опасна ли гроза
Презентация на тему Опасна ли гроза  Механические колебания и волны. Акустика
Механические колебания и волны. Акустика Зрение домашних животных
Зрение домашних животных