Содержание
- 2. Химическая кинетика - это раздел физической химии, изучающий скорости и механизмы химических реакций. Химическая кинетика изучает
- 3. Гомогенные реакции - это реакции, при которых вещества находятся в одинаковых агрегатных состояниях (фазах). Реакции между
- 4. Реакции, проходящие в одну стадию, являются простыми; сложные реакции протекают в несколько последовательных стадий. По числу
- 5. Сложные реакции Могут протекать: -последовательно друг за другом -циклически A B C D B -параллельно I
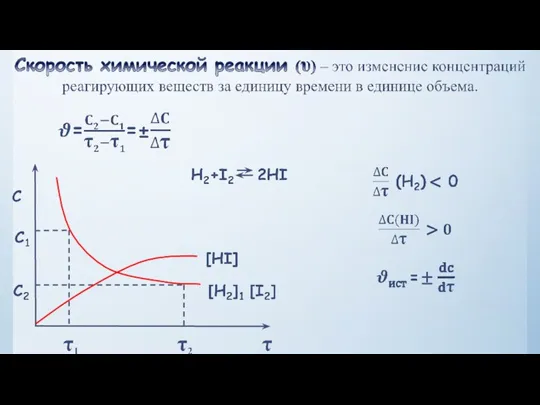
- 8. Закон действующих масс - в кинетической форме (основное уравнение кинетики) гласит, скорость элементарной химической реакции пропорциональна
- 9. Порядок и механизм реакции
- 11. Сложные реакции
- 12. Некоторые кинетические характеристики реакций
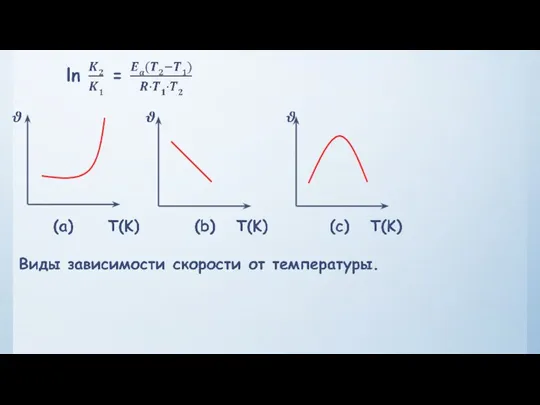
- 14. Зависимость скорости реакции от температуры.
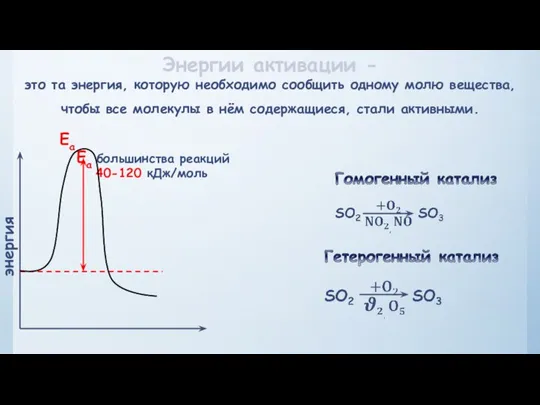
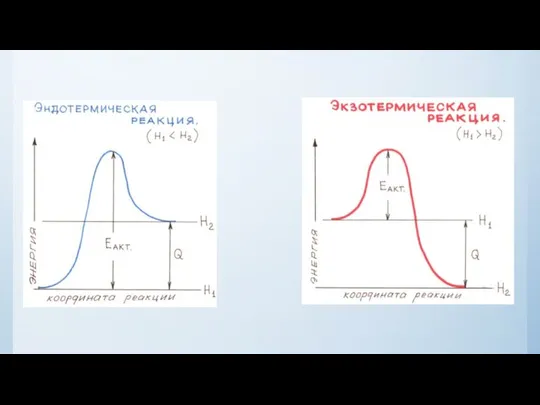
- 18. Энергии активации - это та энергия, которую необходимо сообщить одному молю вещества, чтобы все молекулы в
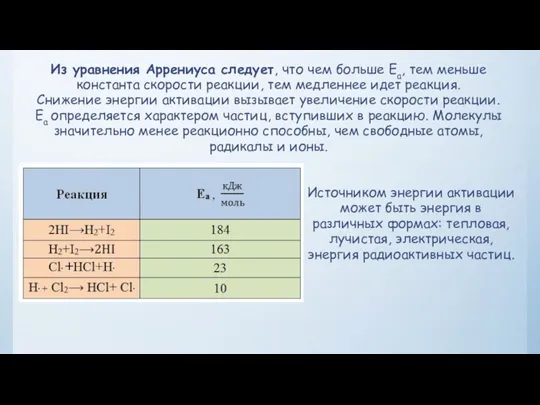
- 19. Из уравнения Аррениуса следует, что чем больше Еа, тем меньше константа скорости реакции, тем медленнее идет
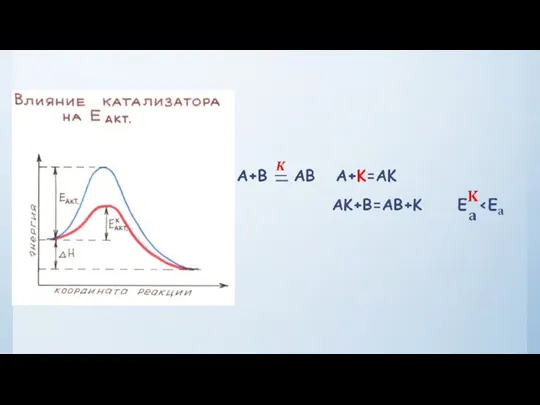
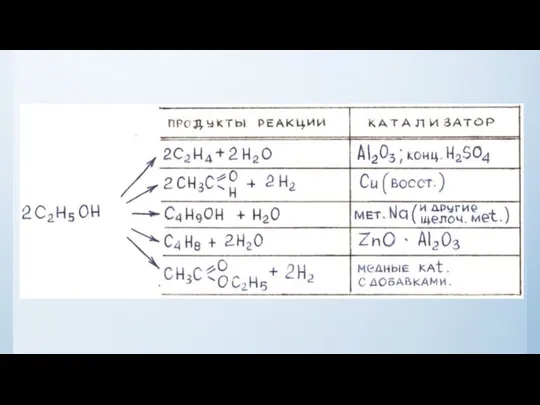
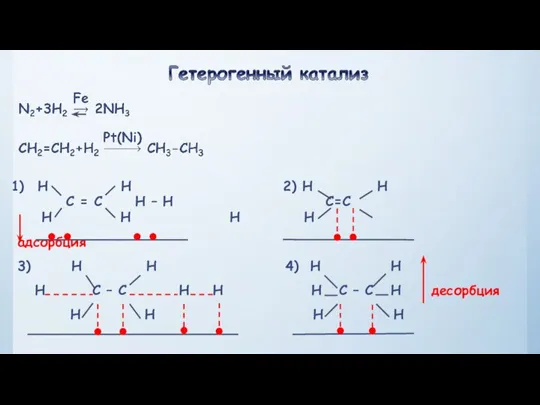
- 21. Третий фактор, влияющий на скорость реакции, катализ Катализ – явление изменения скорости реакции под влиянием катализаторов.
- 27. Скачать презентацию
















 5-1 ما المواد الموصلة للكهرباء؟
5-1 ما المواد الموصلة للكهرباء؟ Что такое сила?
Что такое сила? Классификация кристаллов на металлы, полупроводники и диэлектрики с точки зрения зонной теории
Классификация кристаллов на металлы, полупроводники и диэлектрики с точки зрения зонной теории Магнитное поле
Магнитное поле Сила трения 7 класс
Сила трения 7 класс Презентация на тему Конспект и презентация к уроку повторения
Презентация на тему Конспект и презентация к уроку повторения  Производная в электродинамике
Производная в электродинамике Постоянный электрический ток
Постоянный электрический ток A no-go theorem on the nature of the gravitational field beyond quantum theory
A no-go theorem on the nature of the gravitational field beyond quantum theory Электростатика. Сила Кулона
Электростатика. Сила Кулона Источники звука. Звуковые колебания
Источники звука. Звуковые колебания Диффузия. Роберт Броун
Диффузия. Роберт Броун Поколения ядерных реакторов. Лекция 6
Поколения ядерных реакторов. Лекция 6 Цена деления прибора
Цена деления прибора Параллельное соединение проводников
Параллельное соединение проводников Безопасность дорожного движения и особенности управления грузовым автомобилем
Безопасность дорожного движения и особенности управления грузовым автомобилем Кинематика. Материя. Виды движения
Кинематика. Материя. Виды движения Урок 01 Магнітні явища. Дослід Ерстеда. Магнітне поле
Урок 01 Магнітні явища. Дослід Ерстеда. Магнітне поле Световые волны. Дисперсия. Интерференция
Световые волны. Дисперсия. Интерференция Презентация на тему Оптика
Презентация на тему Оптика  Сила тяжести
Сила тяжести Давление твердых тел, жидкостей и газов
Давление твердых тел, жидкостей и газов Концептуальные основы современной химии. Синергетика и самоорганизация
Концептуальные основы современной химии. Синергетика и самоорганизация Энергия топлива
Энергия топлива Физический диктант
Физический диктант Применение первого начала термодинамики к изопроцессам
Применение первого начала термодинамики к изопроцессам Здравствуй, физика!
Здравствуй, физика! Равномерное движение по окружности
Равномерное движение по окружности