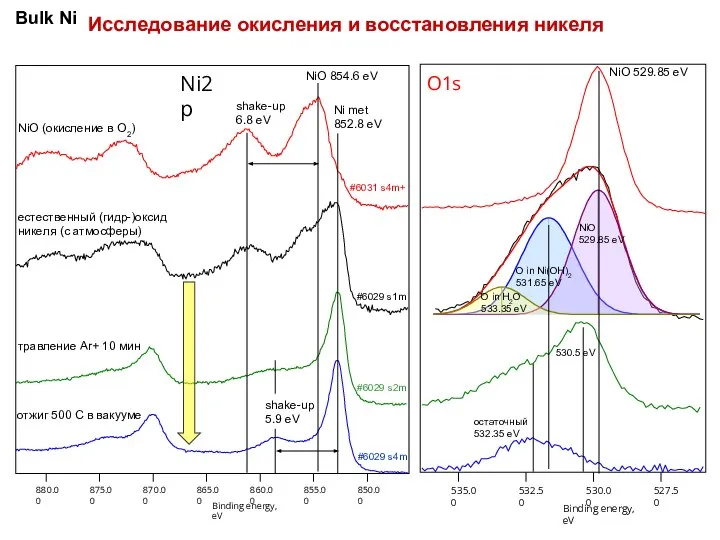
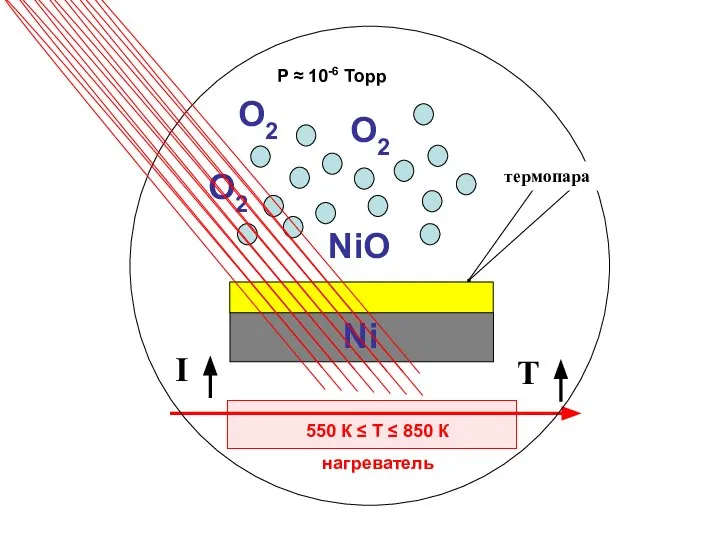
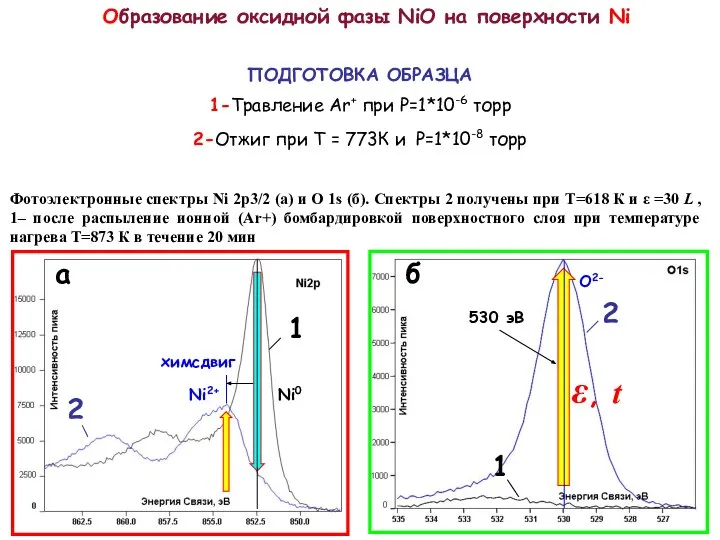
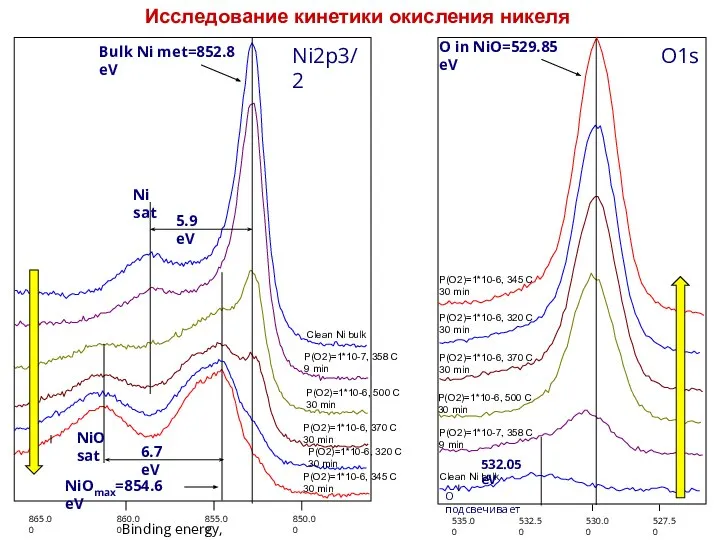
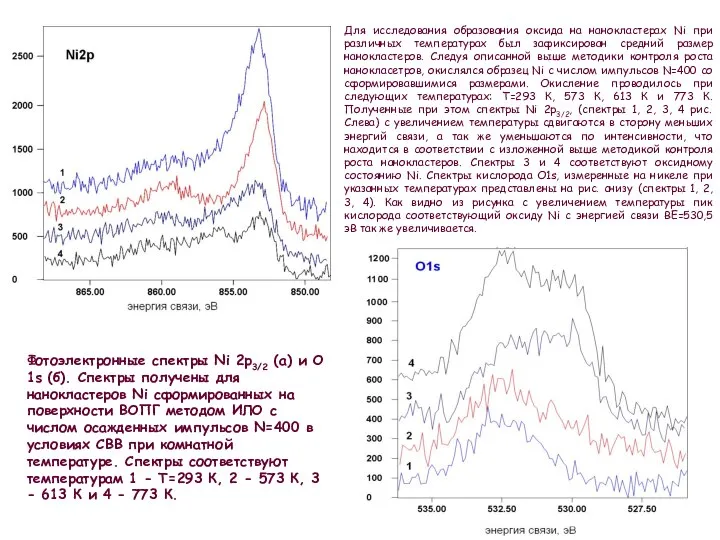
нанокластеров Ni сформированных на поверхности ВОПГ методом ИЛО с числом осажденных импульсов N=400 в условиях СВВ при комнатной температуре. Спектры соответствуют температурам 1 - T=293 К, 2 - 573 К, 3 - 613 К и 4 - 773 К.
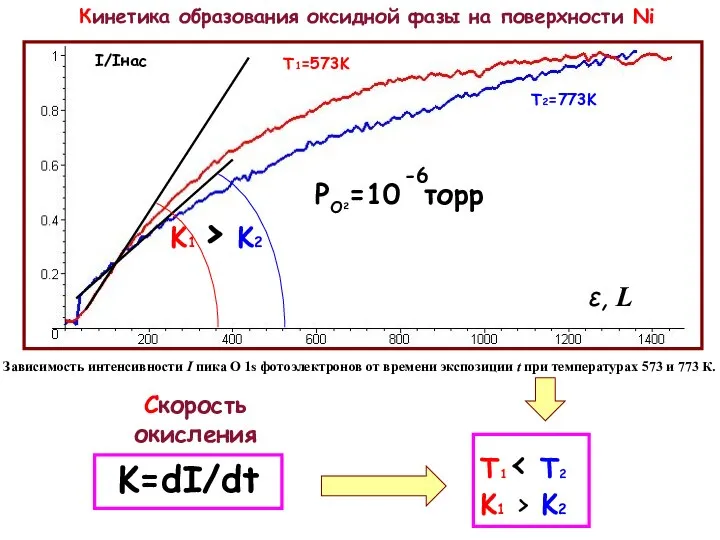
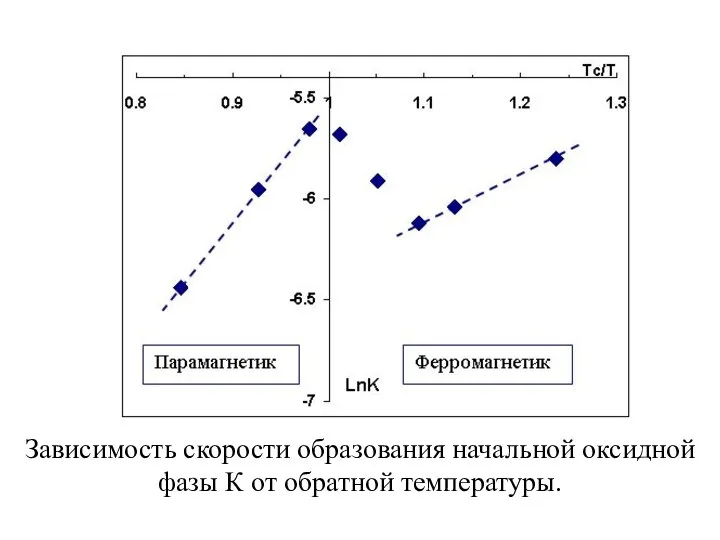
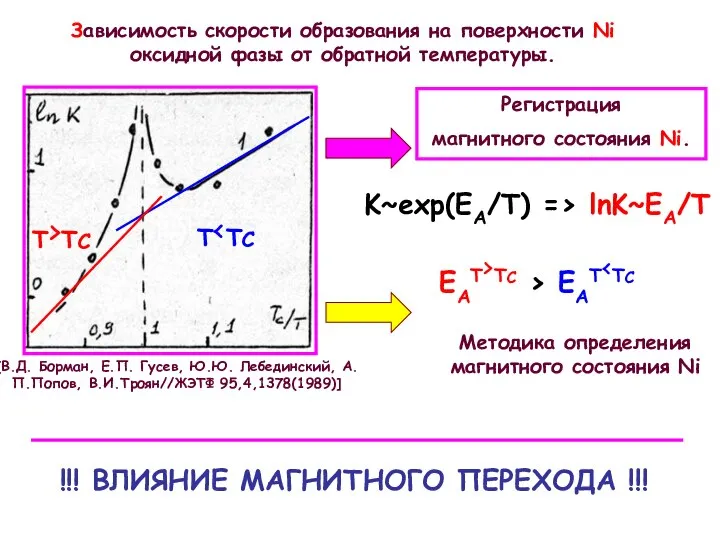
Для исследования образования оксида на нанокластерах Ni при различных температурах был зафиксирован средний размер нанокластеров. Следуя описанной выше методики контроля роста нанокласетров, окислялся образец Ni с числом импульсов N=400 cо сформировавшимися размерами. Окисление проводилось при следующих температурах: T=293 К, 573 К, 613 К и 773 К. Полученные при этом спектры Ni 2p3/2, (спектры 1, 2, 3, 4 рис. Слева) с увеличением температуры сдвигаются в сторону меньших энергий связи, а так же уменьшаются по интенсивности, что находится в соответствии с изложенной выше методикой контроля роста нанокластеров. Спектры 3 и 4 соответствуют оксидному состоянию Ni. Спектры кислорода O1s, измеренные на никеле при указанных температурах представлены на рис. снизу (спектры 1, 2, 3, 4). Как видно из рисунка с увеличением температуры пик кислорода соответствующий оксиду Ni c энергией связи ВE=530,5 эВ так же увеличивается.



 Дискретность электрического заряда. Ионы и электроны. Строение атома. Раздел 1. АФ1.1
Дискретность электрического заряда. Ионы и электроны. Строение атома. Раздел 1. АФ1.1 Давление. Обозначение и единицы измерения давления
Давление. Обозначение и единицы измерения давления Лекция 1 Ядерно-топливный цикл
Лекция 1 Ядерно-топливный цикл Условия равновесия тел. Виды равновесия
Условия равновесия тел. Виды равновесия Зимний тепловой режим помещения. Лекция13
Зимний тепловой режим помещения. Лекция13 Электрический ток в электролитах
Электрический ток в электролитах Конденсатор. Энергия заряженного конденсатора
Конденсатор. Энергия заряженного конденсатора Классификация томографов и магнитов
Классификация томографов и магнитов Презентация на тему Лазеры
Презентация на тему Лазеры  Ворот-разновидность рычага
Ворот-разновидность рычага Определение цены деления измерительного прибора
Определение цены деления измерительного прибора Последовательность соединения проводников
Последовательность соединения проводников Основные положения МКТ
Основные положения МКТ Электропроводность горных пород
Электропроводность горных пород ВКР: Пороговые значения достаточной статистики. Задачи обнаружения сигнала со случайной начальной фазой
ВКР: Пороговые значения достаточной статистики. Задачи обнаружения сигнала со случайной начальной фазой Масса тела
Масса тела Исследование деформаций в тонкостенной цилиндрической оболочке
Исследование деформаций в тонкостенной цилиндрической оболочке Механическое движение
Механическое движение Тест. Механические колебания
Тест. Механические колебания Презентация без названия
Презентация без названия Презентация на тему Сила. Явление тяготения. Сила тяжести
Презентация на тему Сила. Явление тяготения. Сила тяжести  Лекция 3(ОИ) (студентам)
Лекция 3(ОИ) (студентам) Оптика. Раздел 5
Оптика. Раздел 5 Работа силы упругости. Потенциальная энергия упруго деформированного тела
Работа силы упругости. Потенциальная энергия упруго деформированного тела Методическая разработка по применению первого закона термодинамики к решению графических задач
Методическая разработка по применению первого закона термодинамики к решению графических задач Судовые спасательные средства. Индивидуальные спасательные средства. Тема 2.2
Судовые спасательные средства. Индивидуальные спасательные средства. Тема 2.2 Электромагнитные волны
Электромагнитные волны Электризация тел
Электризация тел