Содержание
- 2. Курс лекций по молекулярной физике и термодинамике Физика! Т П У Лектор – Поздеева Э.В.
- 3. Тема 2. РАСПРЕДЕЛЕНИЕ ГАЗОВЫХ МОЛЕКУЛ ПО СКОРОСТЯМ И ЭНЕРГИЯМ 2.1. Скорости газовых молекул. Опыт Штерна 2.2.
- 5. 2.1. Скорости газовых молекул. Опыт Штерна В средине XIX века была сформулирована молекулярно-кинетическая теория, но тогда
- 6. Теоретики первыми нашли выход. Из уравнения молекулярно-кинетической теории газов известно, что . Отсюда среднеквадратичная скорость равна:
- 7. Получена хорошая формула для расчета среднеквадратичной скорости, но масса молекулы неизвестна. Запишем по другому значение υкв:
- 8. Например, при плотности азота, равной 1,25 кг/м3, при t = 0° С и , скорости молекул
- 9. O. STERN Проверка того факта, что атомы и молекулы идеальных газов в термически равновесном пучке имеют
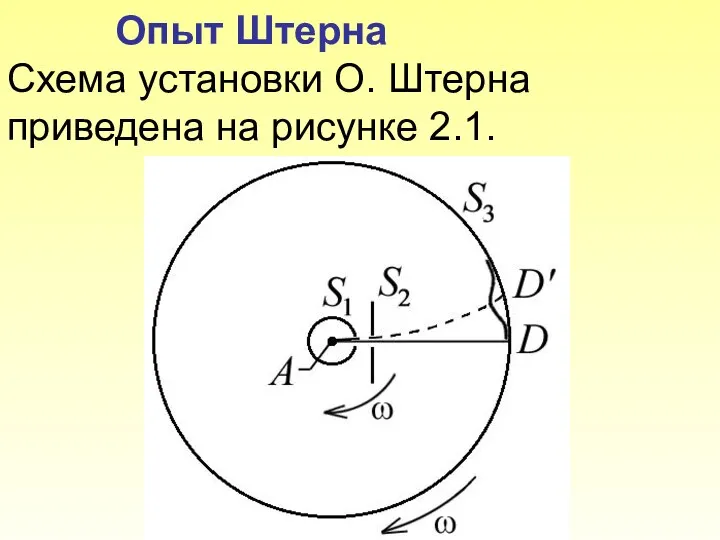
- 10. Опыт Штерна Схема установки О. Штерна приведена на рисунке 2.1. Рис. 2.1
- 11. Платиновая нить А, покрытая снаружи серебром, располагается вдоль оси коаксиальных цилиндров S1, S3. Внутри цилиндров поддержи-вается
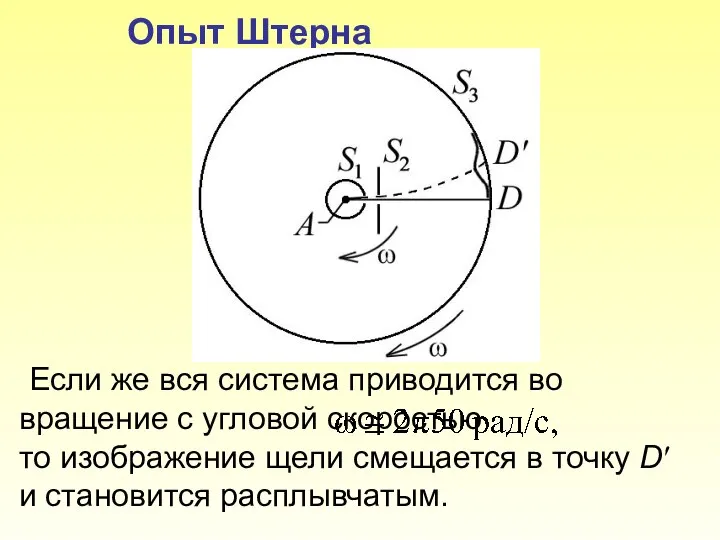
- 12. Опыт Штерна Если же вся система приводится во вращение с угловой скоростью то изображение щели смещается
- 13. Пусть l – расстояние между D и, измеренное вдоль поверхности цилиндра S3, где – линейная скорость
- 14. Температура нити в опытах Штерна равнялась 1200°С, что соответствует среднеквадратичной скорости молекул серебра В эксперименте получился
- 15. Ещё в XIX веке Дж. Максвелл утверждал, что молекулы, беспорядочно сталкиваясь друг с другом, как-то «распределяются»
- 16. 2.2. Вероятность события. Понятие о распределении молекул газа по скоростям С точки зрения атомно-молекулярного строения вещества
- 17. Большое число сталкивающихся атомов и молекул обуславливает важные закономерности в поведении статистических переменных, не свойственные отдельным
- 18. Математическое определение вероятности: вероятность какого-либо события – это предел, к которому стремится отношение числа случаев, приводящих
- 19. По определению Лапласа, вероятность можно представить как отношение числа благоприятных случаев к числу возможных случаев.
- 20. Определить распределение молекул по скоростям вовсе не значит, что нужно определить число молекул, обладающих той, ли
- 21. Итак, молекулы движутся хаотически. Среди них есть и очень быстрые, и очень медленные. Благодаря беспорядочному движению
- 23. Нам необходимо знать: сколько молекул обладает скоростями, лежащими в интервале, включаю-щем заданную скорость? Так всегда ставятся
- 24. Мы будем искать число частиц (Δn) скорости которых лежат в определённом интервале значения скорости Δυ (
- 25. Ясно так же, что Δn должно быть пропорционально концентрации молекул (n). Число Δn зависит и от
- 26. И так, Здесь f(υ) – функция распределения молекул по скоростям, n – концентрация молекул и Δυ
- 27. Таким образом, f(υ) – имеет смысл вероятности, то есть показывает, какова вероятность любой молекулы газа в
- 28. 2.3. Функция распределения Максвелла Пусть имеется n тождественных молекул, находящихся в состоянии беспорядочного теплового движения при
- 29. В результате каждого столкновения проекции скорости молекулы испытывают случайное изменение на Δυx, Δυy, Δυz, причем изменения
- 30. При этом, мы не можем ничего определенного сказать о точном значении скорости той или иной частицы
- 31. Максвелл Джеймс Клерк (1831 – 1879) – английский физик. Работы посвящены электродинамике, молекулярной физике, общей статике,
- 32. Вывод формулы функции распределения молекул по скоростям есть в учебнике Ю.И Тюрина. и др.(ч. 1), или
- 34. Скорость – векторная величина. Для проекции скорости на ось х (x-ой состав-ляющей скорости), имеем тогда или
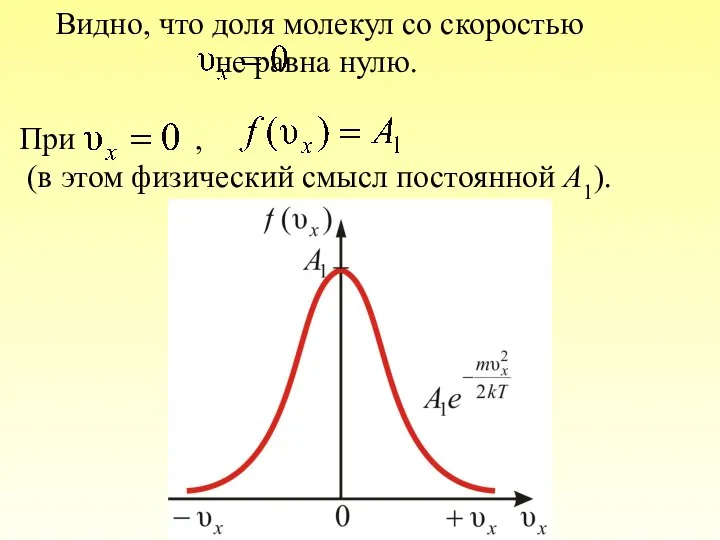
- 35. Видно, что доля молекул со скоростью не равна нулю. При , (в этом физический смысл постоянной
- 37. Приведённое выражение и график справедливы для распределения молекул газа по x-ым компонентам скорости. Очевидно, что и
- 38. Вероятность того, что скорость молекулы одновременно удовлетворяет трём условиям: x – компонента скорости лежит в интервале
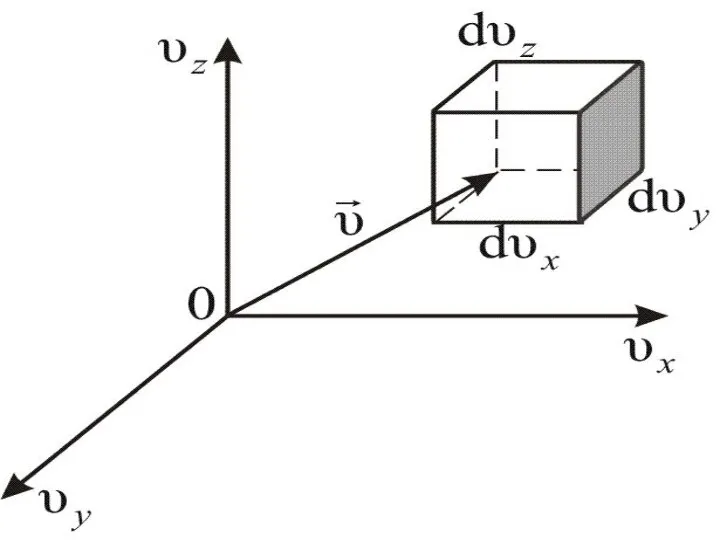
- 39. Или (2.3.2) Этой формуле можно дать геометрическое истолкование: dnxyz – это число молекул в параллелепипеде со
- 41. Величина (dnxyz) не может зависеть от направления вектора скорости. Поэтому надо получить функцию распределения молекул по
- 44. Этот шаровой слой складывается из тех параллелепипедов, о которых говорилось выше. Объём этого шарового слоя: Общее
- 45. Отсюда следует закон Максвелла – распределение молекул по абсолютным значениям скоростей: (2.3.3) где – доля всех
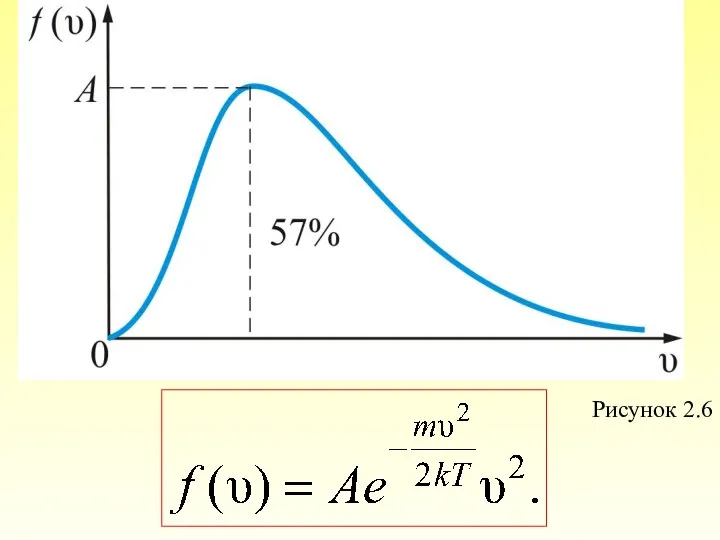
- 46. При получаем плотность вероятности, или функцию распределения молекул по скоростям: (2.3.4) Эта функция обозначает долю молекул
- 47. Обозначим тогда, из (2.3.4) получим: (2.3.5) График этой функции показан на рис. 2.6.
- 48. Рисунок 2.6
- 49. Выводы: - Вид распределения молекул газа по скоростям, для каждого газа зависит от рода газа (m)
- 50. Значит распределение Максвелла характеризует распределение молекул по значениям кинетической энергии (то есть показывает, какова вероятность при
- 52. Рассмотрим пределы применимости классического описания распределения частиц по скоростям. Для этого воспользуемся соотношением неопределенностей Гейзенберга. Согласно
- 53. Здесь – фундаментальная константа (постоянная Планка), определяющая масштаб квантовых (микроскопических процессов). Таким образом, если частица находится
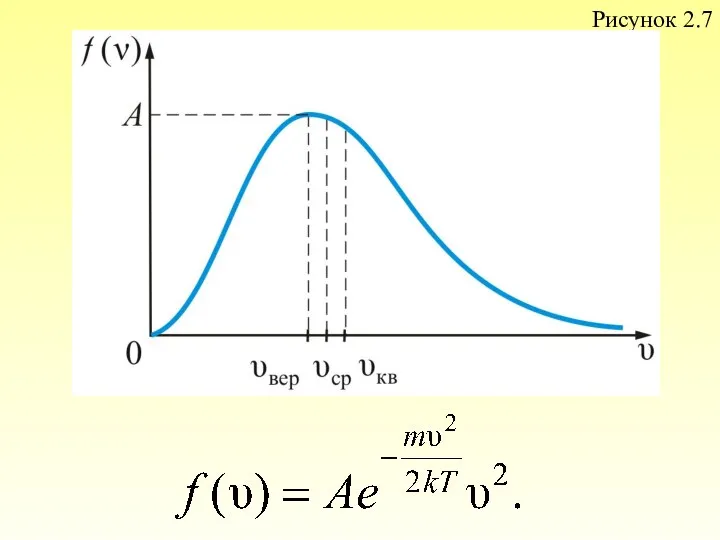
- 54. Наиболее вероятная, среднеквадратичная и средняя арифметическая скорости молекул газа Рассмотрим, как изменяется с абсолютной величиной скорости
- 55. Рисунок 2.7
- 56. Из графика видно, что при «малых» V, т.е. при , имеем ;затем достигает максимума А и
- 57. Величина скорости, на которую приходится максимум зависимости называют наиболее вероятной скоростью. Величину этой скорости найдем из
- 58. – наиболее вероятная скорость одной молекулы. для одного моля газа:
- 59. Среднюю квадратичную скорость найдем используя соотношение : – для одной молекулы. (2.3.8) – для одного моля
- 60. Средняя арифметическая скорость − υср где – число молекул со скоростью от υ до . Если
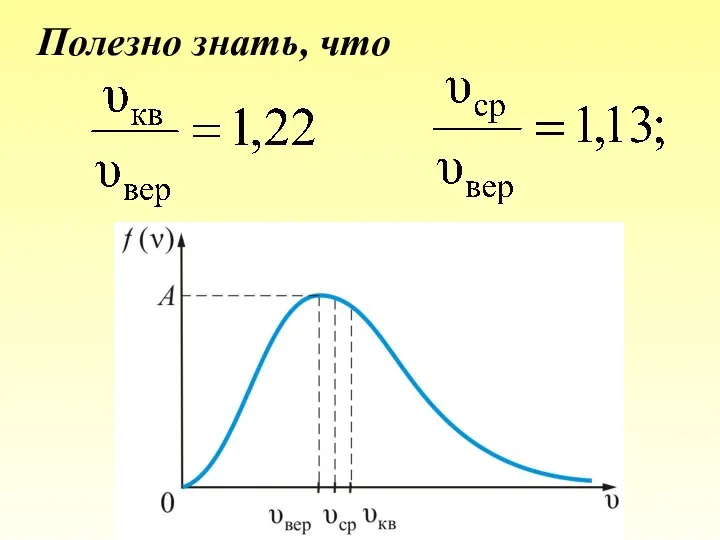
- 61. Полезно знать, что
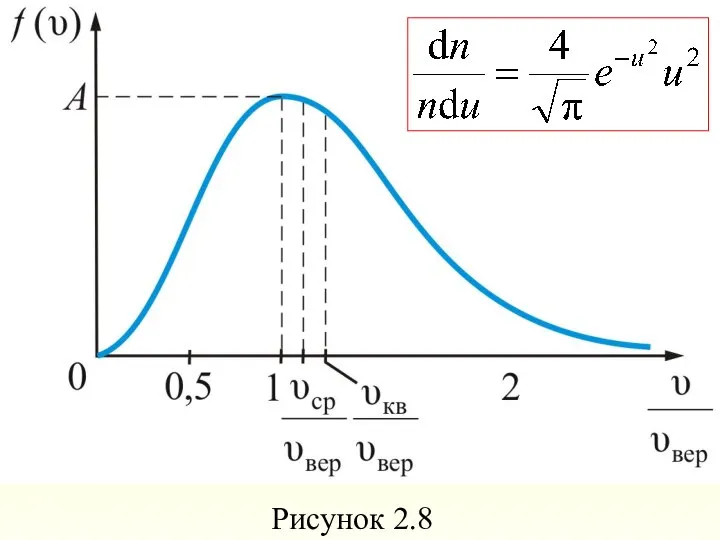
- 62. Формула Максвелла для относительных скоростей Для решения многих задач удобно использовать формулу Максвелла, где скорость выражена
- 63. Это уравнение универсальное. В таком виде функция распределения не зависит ни от рода газа, ни от
- 64. Рисунок 2.8
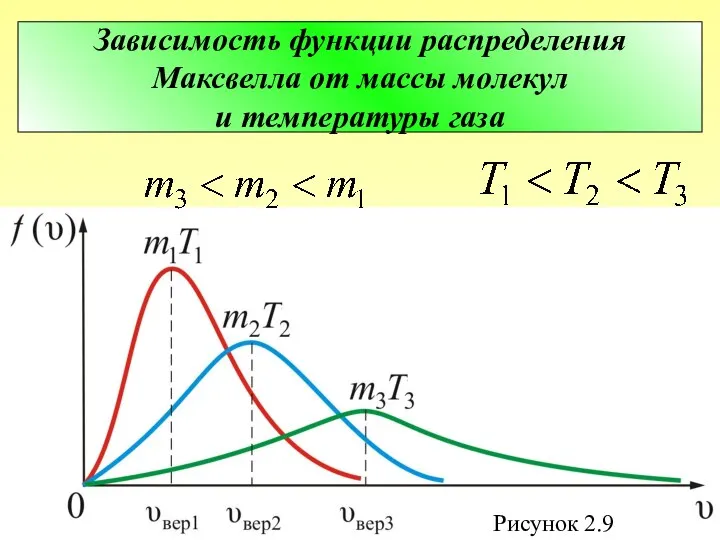
- 65. Зависимость функции распределения Максвелла от массы молекул и температуры газа Рисунок 2.9
- 66. Из рис. 2.9 можно проследить за изменением при изменении m и T: (при ) или (при
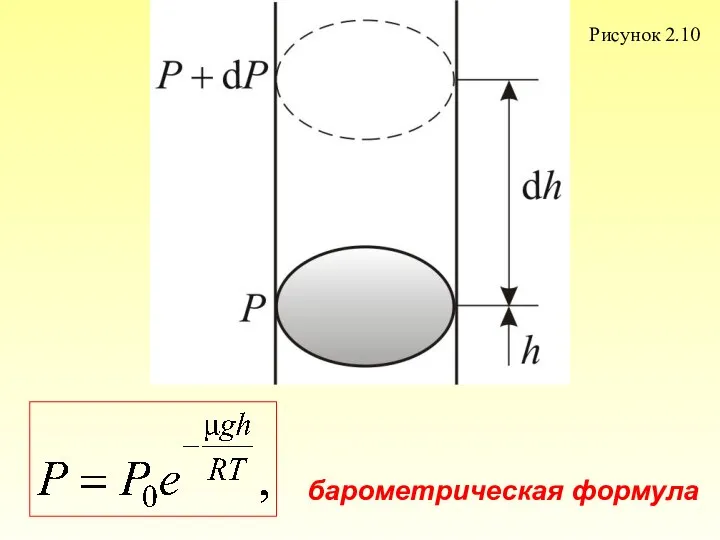
- 67. 2.4. Барометрическая формула Рассмотрим ещё один, очень важный закон. Атмосферное давление на какой-либо высоте h обусловлено
- 68. Рисунок 2.10 барометрическая формула
- 69. Причём , dР
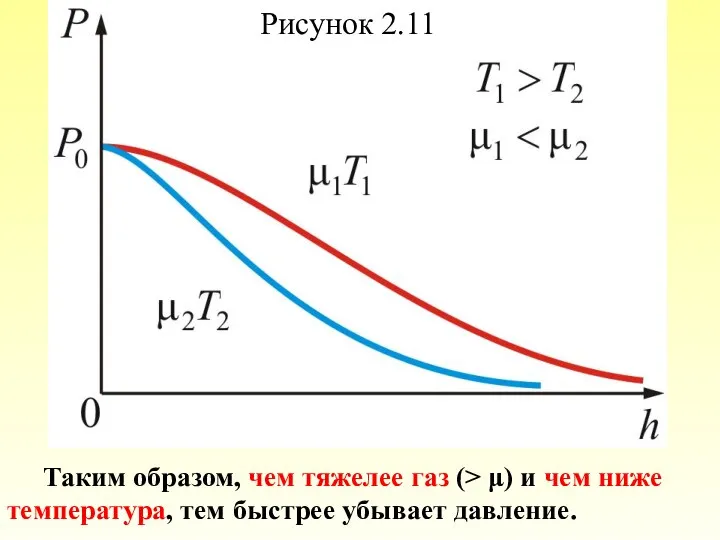
- 70. Из барометрической формулы следует, что P убывает с высотой тем быстрее, чем тяжелее газ (чем больше
- 71. Рисунок 2.11 Таким образом, чем тяжелее газ (> μ) и чем ниже температура, тем быстрее убывает
- 72. 2.5. Распределение Больцмана Распределение Больцмана определяет распределение частиц в силовом поле в условиях теплового равновесия.
- 73. Больцман Людвиг (1844 – 1906) – австрийский физик- теоретик, один из основоположников классической статистической физики. Основные
- 74. Пусть идеальный газ находится в поле консервативных сил, в условиях теплового равновесия. При этом, концентрация газа
- 75. Если известно число молекул в единичном объеме, то известно и давление, и наоборот. Давление и плотность
- 76. Исходя из основного уравнения молекулярно-кинетической теории: , заменим P и P0 в барометрической формуле (2.4.1) на
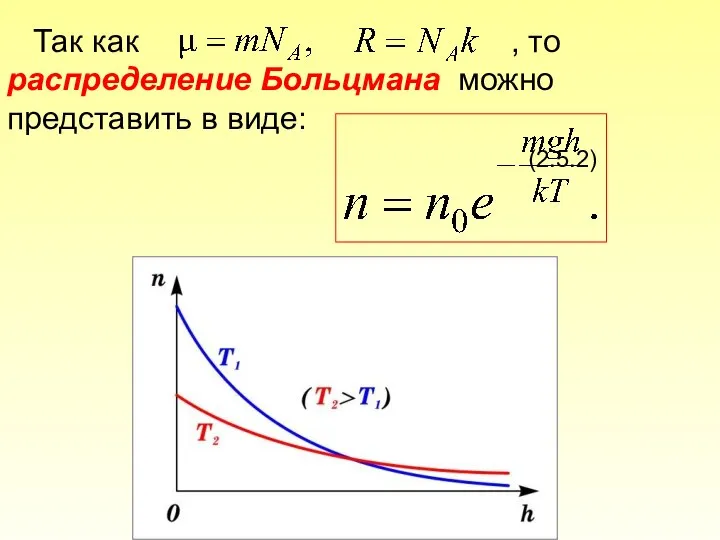
- 78. Так как , то распределение Больцмана можно представить в виде: (2.5.2)
- 79. С уменьшением температуры число молекул на высотах, отличных от нуля, убывает. При тепловое движение прекращается, все
- 80. Так как –потенциальная энергия, следовательно, распределение Больцмана характеризует распределение частиц по значениям потенциальной энергии: (2.5.3) –
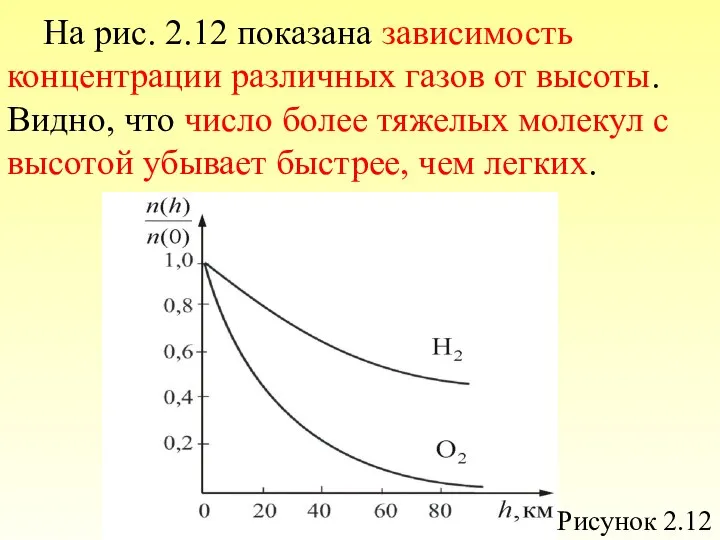
- 81. На рис. 2.12 показана зависимость концентрации различных газов от высоты. Видно, что число более тяжелых молекул
- 82. Из (2.5.3) можно получить, что отношение концентраций молекул в точках с U1 и U2 обладающих именно
- 83. 2.6. Закон распределения Максвелла-Больцмана В п. 2.3 мы получили выражение для распределения молекул по скоростям (распределение
- 84. Из этого выражения легко найти распределение молекул газа по значениям кинетической энергии K. Для этого перейдём
- 85. Отсюда получим функцию распределения молекул по энергиям теплового движения: (2.6.2) Средняя кинетическая энергия молекулы идеального газа:
- 86. Итак, закон Максвелла даёт распределение частиц по значениям кинетической энергии а закон Больцмана – распределение частиц
- 87. Обозначим – полная энергия. Тогда (2.6.4) Это и есть закон распределения Максвелла-Больцмана. Здесь n0 – число
- 88. В последнем выражении, потенциальная и кинетическая энергии, а следовательно и полная энергия Е, могут принимать непрерывный
- 89. где Ni – число частиц, находящихся в состоянии с энергией Еi, а А – коэффициент пропорциональности,
- 90. Тогда, окончательное выражение распределения Масвелла-Больцмана для случая дискретных значений будет иметь вид: (2.6.6)
- 91. 2.7. Распределение Бозе-Эйнштейна, Ферми-Дирака Если у нас имеется термодинамическая система состоящая из N частиц, энергии которых
- 92. Основная задача этой статистики состоит в определении среднего числа частиц, находящихся в ячейке фазового пространства: «координаты
- 93. распределение Бозе-Эйнштейна: ; (2.7.1) распределение Ферми-Дирака: . (2.7.2)
- 94. Первая формула описывает квантовые частицы с целым спином (собственный момент количетсва движения). Их называют бозоны (например,
- 96. Скачать презентацию












































































 Физика плазмы
Физика плазмы Взаимодействие цвета и вещества
Взаимодействие цвета и вещества Качество электроэнергии. Компенсация реактивной мощности
Качество электроэнергии. Компенсация реактивной мощности Атмосферное давление. Решение экспериментальных задач
Атмосферное давление. Решение экспериментальных задач Фазовые переходы. Термодинамика ТМП (Термоупругие мартенситные превращения)
Фазовые переходы. Термодинамика ТМП (Термоупругие мартенситные превращения) Презентация на тему Испарение. Насыщенный и ненасыщенный пар
Презентация на тему Испарение. Насыщенный и ненасыщенный пар  Расчёт количества теплоты при плавлении и кристаллизации тел
Расчёт количества теплоты при плавлении и кристаллизации тел Реактивная сила
Реактивная сила Презентация на тему Электромагнитные колебания решение задач
Презентация на тему Электромагнитные колебания решение задач  Вторая жизнь солнечным батареям
Вторая жизнь солнечным батареям Самолёт
Самолёт Сверхпроводи́мость
Сверхпроводи́мость Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Магнитная индукция
Магнитная индукция Гидравлические системы. 2 класс
Гидравлические системы. 2 класс Досліди Фарадея. Явище електромагнітної індукції. 9кл
Досліди Фарадея. Явище електромагнітної індукції. 9кл ААМЖЗ жағдайында металл сымдарды үздіксіз орауға арналған электржетегін жасау
ААМЖЗ жағдайында металл сымдарды үздіксіз орауға арналған электржетегін жасау Определение характеристик посадок для гладких элементов деталей
Определение характеристик посадок для гладких элементов деталей Магнитное поле
Магнитное поле Основы постановки научного эксперимента. ЯМР-спектроскопия. (Лекция 8)
Основы постановки научного эксперимента. ЯМР-спектроскопия. (Лекция 8) Исследование закономерностей параллельного соединения проводников
Исследование закономерностей параллельного соединения проводников Изменения школьного процесса обучения физике в условиях обновления образования
Изменения школьного процесса обучения физике в условиях обновления образования Воль-амперная характеристика полупроводникового диода и лампы нагревания. Лабораторная работа
Воль-амперная характеристика полупроводникового диода и лампы нагревания. Лабораторная работа Дифракция света
Дифракция света Құрылтак шарттары
Құрылтак шарттары Изучение движения тела, брошенного горизонтально
Изучение движения тела, брошенного горизонтально Итоговая контрольная работа по физике (7 класс)
Итоговая контрольная работа по физике (7 класс) Волны в океане
Волны в океане