Содержание
- 2. Радиоматериалы и радиокомпоненты (РМ и РК) Контрольные мероприятия: Основная литература: Пасынков В. В., Сорокин В. С.
- 3. Физические основы микроэлектроники (ФОМ) Контрольные мероприятия: Основная литература: Епифанов Г.И. Физические основы микроэлектроники, М.: Советское радио,
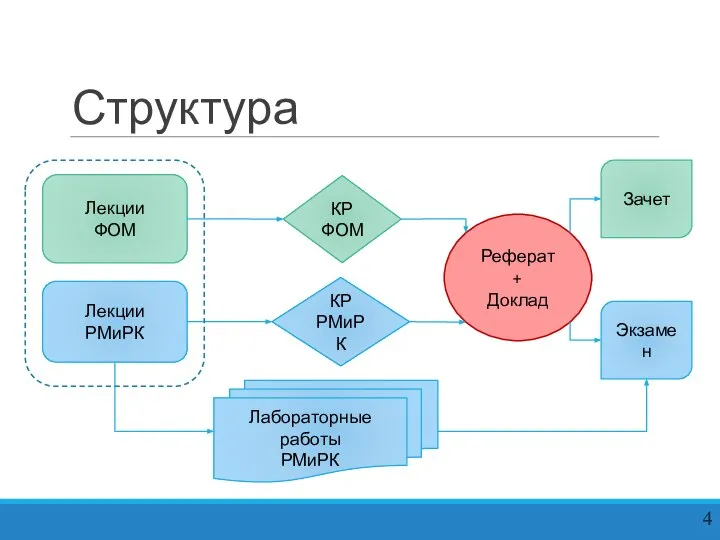
- 4. Структура Реферат + Доклад Лекции ФОМ КР ФОМ Лабораторные работы РМиРК Лекции РМиРК КР РМиРК Зачет
- 5. Реферат Структура реферата: Титульный лист Аннотация (на двух языках) Содержание Введение 1 Общие сведения о материале
- 6. Оформление реферата Страницы текста должны соответствовать формату А4 Текст должен быть выполнен на одной стороне листа
- 7. Лекция №1 Введение
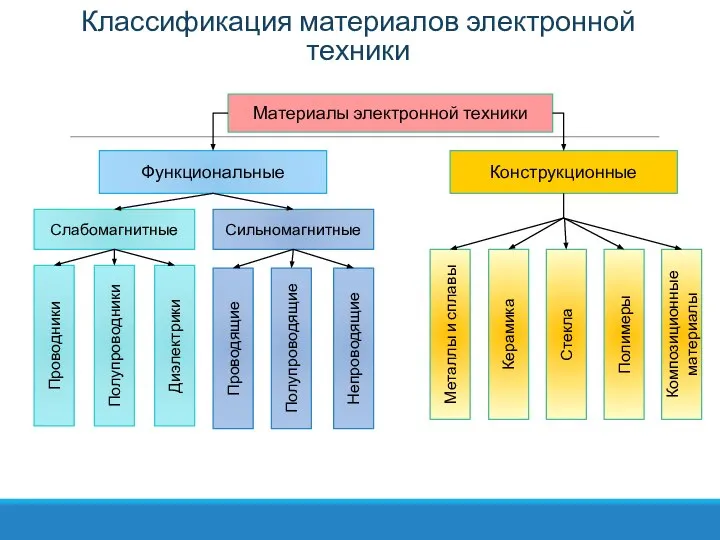
- 8. Классификация материалов электронной техники Материалы электронной техники Функциональные Конструкционные Слабомагнитные Сильномагнитные Проводники Полупроводники Диэлектрики Проводящие Полупроводящие
- 9. Функциональные МЭТ Под функциональными МЭТ следует понимать материалы, которые обеспечивают реализацию определенных функций в элементах электронной
- 10. Качественное различие между материалами состоит в том, что для металлов проводящее состояние является основным, а для
- 11. Конструкционные МЭТ Конструкционными называются материалы, предназначенные для изготовления корпусов и деталей различных приборов и устройств электронной
- 12. Общие сведения о строении вещества Атомы любого вещества состоят из положительно заряженного ядра и окружающих его
- 13. Полная энергия электрона Э в атоме складывается из кинетической энергии движения по орбите Эк и потенциальной
- 14. Энергия электронов в атомах должна быть квантованной, т.е. электроны могут занимать лишь вполне определенные энергетические уровни,
- 15. Открытие волновых свойств у элементарных частиц и создание квантовой механики повлекли за собой изменение представлений о
- 16. Состояниям с квантовыми числами п = 1, 2, 3, 4, 5, 6, 7 присвоены буквенные обозначения
- 17. Наряду с азимутальным вращением электрон вращается вокруг собственной оси. Представление электрона в виде волчка безусловно является
- 18. Основные видыхимической связи Если при уменьшении расстояния между атомами энергия системы понижается по сравнению с суммарной
- 19. За нулевой уровень отсчета потенциальной энергии принимают уединенное состояние атомов, когда они бесконечно удалены друг от
- 20. Ковалентная связь Ковалентная связь. Эта связь образуется путем спаривания валентных электронов соседних атомов при перекрытии электронных
- 21. Ковалентная связь возникает не только между одинаковыми атомами, но и между атомами различных элементов. Молекулы с
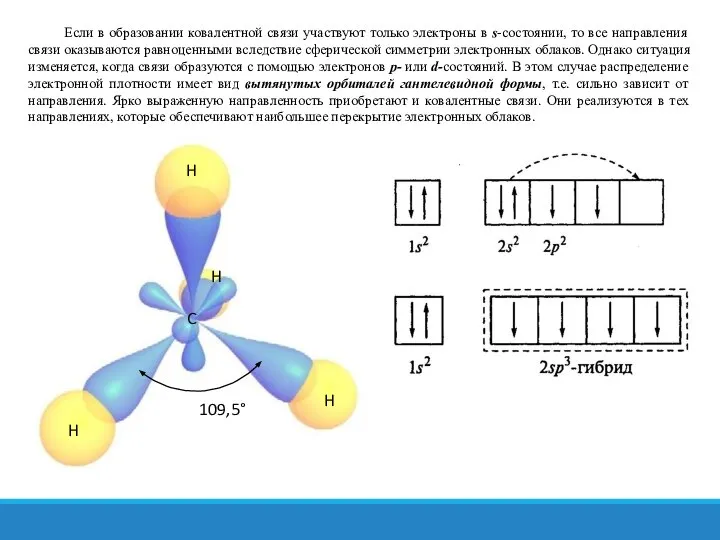
- 22. Если в образовании ковалентной связи участвуют только электроны в s-состоянии, то все направления связи оказываются равноценными
- 23. Гибридизация валентных электронов углеродного атома сопровождается искажением их электронных облаков. Вместо конфигураций, свойственных s- и p-состояниям,
- 24. Ковалентная связь
- 25. Ионная связь Способность атомов захватывать или отдавать электрон при образовании химических связей характеризуется их электроотрицательностью. За
- 26. При этом энергией сродства к электрону называют то количество энергии, которое выделяется в случае присоединения электрона
- 27. Для кристаллических структур с определенным значением К существуют пределы устойчивости, определяемые геометрическим фактором. Предельным является такое
- 28. Металлическая связь Металлическая связь. Эта связь существует в системах, построенных из положительных атомных остовов, находящихся в
- 29. Об отсутствии насыщения связей в металле свидетельствует тот факт, что число связей у каждого атома существенно
- 30. Металлическая связь
- 31. Молекулярная связь Молекулярная связь (связь Ван-дер-Ваальса). Эта связь наблюдается у ряда веществ между молекулами с ковалентным
- 32. Связь Ван-дер-Ваальса является наиболее универсальной среди всех видов связей. Она возникает между любыми частицами, но это
- 33. Элементы зонной теории
- 34. Микроэлектроника — подраздел электроники, связанный с изучением и производством электронных компонентов с геометрическими размерами характерных элементов
- 35. Закон Мура
- 36. Микро- и нано- электроника В Техническом комитете ISO/ТК 229 под нанотехнологиями подразумевается следующее: знание и управление
- 37. Современные микросхемы Технологии позволяют изготовить микросхемы, в которых характеристическая величина, минимального элемента составляет 14 нм. 1
- 38. Классификация ИС по степени интеграции В зависимости от степени интеграции применяются следующие названия интегральных схем: малая
- 39. Топология ИМС Это чертеж, определяющий форму, размеры и взаимное расположение элементов и соединений ИМС в плоскости,
- 40. Общая топология
- 41. Общая топология БИС и СБИС
- 42. 3D-модель кристалла ИМС
- 43. Структура ИМС Это последовательность слоев в составе микросхемы по нормали к поверхности кристалла, различающихся материалом, толщиной
- 44. Структура БИС и СБИС
- 45. Топология транзистора Микрофотография полевого n – канального транзистора (x10) Микрофотография полевого p – канального транзистора (x10)
- 46. Микросхемы будущего Микросхемы из углеродных нано материалах в разы энергоэффективнее. Одной из причин является повеления квантовых
- 47. Варианты исполнения Корпусные ИМС Бескорпусные ИМС Полупроводниковый кристалл, предназначенный для монтажа в гибридную микросхему или микросборку.
- 48. Корпус ИМС Это часть конструкции микросхемы, предназначенная для защиты от внешних воздействий и для соединения с
- 49. Шаг выводов корпусов ИМС Российские 2,5 мм 1,25 мм Импортные 1/10 дюйма (2,54 мм) 1/20 дюйма
- 51. Скачать презентацию
Слайд 2Радиоматериалы и радиокомпоненты
(РМ и РК)
Контрольные мероприятия:
Основная литература:
Пасынков В. В., Сорокин В. С.
Радиоматериалы и радиокомпоненты
(РМ и РК)
Контрольные мероприятия:
Основная литература:
Пасынков В. В., Сорокин В. С.

Сорокин В.С., Антипов Б.Л., Лазарева Н.П. Материалы и элементы электронной техники. В 2-х томах. Том 1 М: Издательство «Лань», 2015 - 448с.
Сорокин В.С., Антипов Б.Л., Лазарева Н.П. Материалы и элементы электронной техники. В 2-х томах. Том 2 М.: Издательство «Лань», 2015 – 384с.
Петров К.С. Радиоматериалы, радиокомпоненты и электроника: Учебное пособие. – СПб.: Питер, 2006. - 522 с.
Слайд 3Физические основы микроэлектроники
(ФОМ)
Контрольные мероприятия:
Основная литература:
Епифанов Г.И. Физические основы микроэлектроники, М.: Советское радио,
Физические основы микроэлектроники
(ФОМ)
Контрольные мероприятия:
Основная литература:
Епифанов Г.И. Физические основы микроэлектроники, М.: Советское радио,

Гуртов В.А. Твердотельная электроника М.: Техносфера, 2008. - 512 с. – ISBN: 978-5-94836-187-1 (3-е изд., доп.)
Мартинес-Дуарт Дж. М., Мартин-Палма Р.Дж., Агулло-Руеда Ф. «Нанотехнологии для микро и оптоэлектроники». М:. Техносфера, 2007. -368с.
Марголин В.И., Жабреев В.А., Турик В.А. Физические основы микроэлектроники, Учебник - М.: Издательский центр «Академия», 2008 – 400 с.
Ефимов Е.И., Козырь И.Я. Основы микроэлектроники. Учебное пособие для вузов. Спб: Издательство «Лань», 2008 – 384 с.
Слайд 4Структура
Реферат
+
Доклад
Лекции
ФОМ
КР ФОМ
Лабораторные работы
РМиРК
Лекции
РМиРК
КР РМиРК
Зачет
Экзамен
Структура
Реферат
+
Доклад
Лекции
ФОМ
КР ФОМ
Лабораторные работы
РМиРК
Лекции
РМиРК
КР РМиРК
Зачет
Экзамен
Слайд 5Реферат
Структура реферата:
Титульный лист
Аннотация (на двух языках)
Содержание
Введение
1 Общие сведения о материале
1.1 Структура и
Реферат
Структура реферата:
Титульный лист
Аннотация (на двух языках)
Содержание
Введение
1 Общие сведения о материале
1.1 Структура и

1.2 Свойства
1.3 Особенности
2 Применение материала в …..
2.1 Общие сведения
2.2 Конкретизация
3 Управление качеством изделия из этого материала
Заключение
Список используемых источников
(… должны присутствовать источники литературы выпущенные в ближайшие 10 лет)
Выбрать тему?
Слайд 6Оформление реферата
Страницы текста должны соответствовать формату А4
Текст должен быть выполнен на одной
Оформление реферата
Страницы текста должны соответствовать формату А4
Текст должен быть выполнен на одной

правое 10 мм; верхнее, и нижнее – 20 мм; левое – 30 мм.
Высота шрифта: А = 12 пт;
Высота букв в заголовках разделов: А + 2 пт = 14 пт;
Красная строка (абзац): 1,25;
Межстрочный интервал: Полуторный;
Расстояние между заголовками и текстом: Пропустить строку;
Расстояние между таблицей и основным текстом (до и после таблицы): Пропустить строку;
Расстояние между рисунком и основным текстом ( до и после рисунка): Пропустить строку;
Расстояние между формулой и основным текстом (до и после формулы, уравнения): Пропустить строку;
В тексте не допускается применять подчеркивание.
Оформление текста по ГОСТ 7.32-2001
Слайд 7Лекция №1
Введение
Лекция №1
Введение

Слайд 8Классификация материалов электронной техники
Материалы электронной техники
Функциональные
Конструкционные
Слабомагнитные
Сильномагнитные
Проводники
Полупроводники
Диэлектрики
Проводящие
Полупроводящие
Непроводящие
Металлы и сплавы
Керамика
Стекла
Полимеры
Композиционные материалы
Классификация материалов электронной техники
Материалы электронной техники
Функциональные
Конструкционные
Слабомагнитные
Сильномагнитные
Проводники
Полупроводники
Диэлектрики
Проводящие
Полупроводящие
Непроводящие
Металлы и сплавы
Керамика
Стекла
Полимеры
Композиционные материалы
Слайд 9Функциональные МЭТ
Под функциональными МЭТ следует понимать материалы, которые обеспечивают реализацию определенных функций
Функциональные МЭТ
Под функциональными МЭТ следует понимать материалы, которые обеспечивают реализацию определенных функций

В качестве примеров функциональных МЭТ можно назвать резистивные, конденсаторные и электроизоляционные материалы, высокопроводящие и сверхпроводящие вещества, материалы для хранения и записи информации, материалы с нелинейными электрическими свойствами, материалы для активных элементов полупроводниковой электроники, таких как диоды, транзисторы, лазеры, фотодетекторы и др.
По реакции на внешнее электрическое поле функциональные МЭТ принято подразделять на проводники, полупроводники и диэлектрики.
Объективным критерием, по которому определяют принадлежность материала к той или иной группе, является удельное электрическое сопротивление ρ в нормальных условиях эксплуатации.
Формально к проводникам относятся материалы с удельным электрическим сопротивлением ρ < 10-5 Ом·м, а к диэлектрикам — материалы, у которых ρ > 108 Ом·м.
При этом важно иметь в виду, что удельное сопротивление хороших проводников электрического тока может составлять всего лишь 10-8 Ом·м, а у лучших диэлектриков оно превосходит значения 1016 Ом·м. Удельное сопротивление полупроводников в зависимости от строения и состава материалов, а также от условий их эксплуатации может изменяться в очень широких пределах — от 10-5 до 108 Ом·м.
Слайд 10Качественное различие между материалами состоит в том, что для металлов проводящее состояние
Качественное различие между материалами состоит в том, что для металлов проводящее состояние

Развитие радиотехники потребовало создания диэлектриков, в которых специфические высокочастотные свойства сочетаются с необходимыми теплофизическими и физико-механическими характеристиками, а также с высоким удельным сопротивлением. Такие материалы получили название высокочастотных диэлектриков. Кроме того, в зависимости от функций, выполняемых диэлектриками в электронной аппаратуре, они подразделяются на активные и пассивные материалы. С помощью активных диэлектриков осуществляется преобразование различных сигналов и управление параметрами электрических цепей. К пассивным относятся электроизоляционные и конденсаторные материалы.
Слайд 11Конструкционные МЭТ
Конструкционными называются материалы, предназначенные для изготовления корпусов и деталей различных приборов
Конструкционные МЭТ
Конструкционными называются материалы, предназначенные для изготовления корпусов и деталей различных приборов

К ним предъявляются прежде всего жесткие эксплуатационные, технологические и экономические требования.
Конструкционные материалы принято подразделять на:
материалы общего назначения (универсальные) и
конструкционные материалы со специальными свойствами (специализированные).
Основные эксплуатационные требования к конструкционным материалам сводятся к достижению высокой конструкционной прочности изготовляемых деталей и узлов, а также обеспечению устойчивого «иммунитета» к воздействию внешней среды.
Под конструкционной прочностью понимают комплекс механических свойств, гарантирующих надежную и длительную эксплуатацию материала в заданных условиях.
Слайд 12Общие сведения о строении вещества
Атомы любого вещества состоят из положительно заряженного ядра
Общие сведения о строении вещества
Атомы любого вещества состоят из положительно заряженного ядра

Масса электрона в 1 836 раз меньше массы протона и нейтрона
Это означает, что практически вся масса атома сосредоточена в ядре. Вместе с тем размер ядра очень мал и сопоставим с размером электрона. Если ядро представить в виде шарика, то его радиус, м, можно довольно точно оценить по формуле:
- массовое число элемента, т. е. суммарное число нуклонов в ядре.
В простейшей планетарной модели атома, предложенной Резерфордом, электроны вращаются по круговым орбитам относительно ядра. Условию сохранения радиуса орбиты отвечает равновесие между центробежной силой, отбрасывающей электрон от ядра, и силой кулоновского притяжения:
где m — масса электрона; v — скорость движения электрона по орбите; Z — атомный номер;
е — заряд электрона; Ze — заряд ядра;
— электрическая постоянная,
Слайд 13Полная энергия электрона Э в атоме складывается из кинетической энергии движения по
Полная энергия электрона Э в атоме складывается из кинетической энергии движения по

Основной недостаток планетарной модели Резерфорда заключается в ее противоречивости. С ее помощью не удалось объяснить стабильность атомной структуры. Согласно законам классической электродинамики периодическое движение электрона с центростремительным ускорением должно сопровождаться излучением электромагнитных волн, причем частота этого монохроматического излучения должна соответствовать частоте вращения. Результатом излучения должно быть уменьшение энергии электрона и превращение круговой траектории движения в спираль. Конечным итогом такого процесса является падение электрона на ядро.
Чтобы устранить противоречия планетарной модели, Н.Бор постулировал квантовые условия для движения электронов в атоме. В соответствии с постулатом Бора стабильны только такие круговые орбиты, для которых момент количества движения оказывается кратным постоянной Планка:
где п — главное квантовое число, п = 1, 2, 3, ...;
— постоянная Планка; h = 6,62 • 10-34 Дж • с.
Энергетические уровни и радиусы стационарных орбит, которые может иметь электрон в атоме:
Слайд 14 Энергия электронов в атомах должна быть квантованной, т.е. электроны могут занимать лишь
Энергия электронов в атомах должна быть квантованной, т.е. электроны могут занимать лишь

По мере возрастания главного квантового числа n увеличивается плотность расположения уровней на энергетической шкале. Соответственно уменьшается дискретность энергии и поведение электрона приближается к классическому. Значение n= ∞ определяет границу между сплошными и дискретными состояниями. Переход электрона в область состояний со сплошным энергетическим спектром означает его отрыв от атома с некоторой кинетической энергией, т.е. ионизацию атома. Энергия ионизации определяется глубиной залегания основного состояния относительно сплошного спектра.
Для атома водорода Эп = -13,6 эВ. Этому состоянию соответствует радиус электронной орбиты
а0 = 0,53 • 10-10 м, который в физике принято называть боровским радиусом.
Схема энергетических уровней атома водорода
Слайд 15 Открытие волновых свойств у элементарных частиц и создание квантовой механики повлекли за
Открытие волновых свойств у элементарных частиц и создание квантовой механики повлекли за
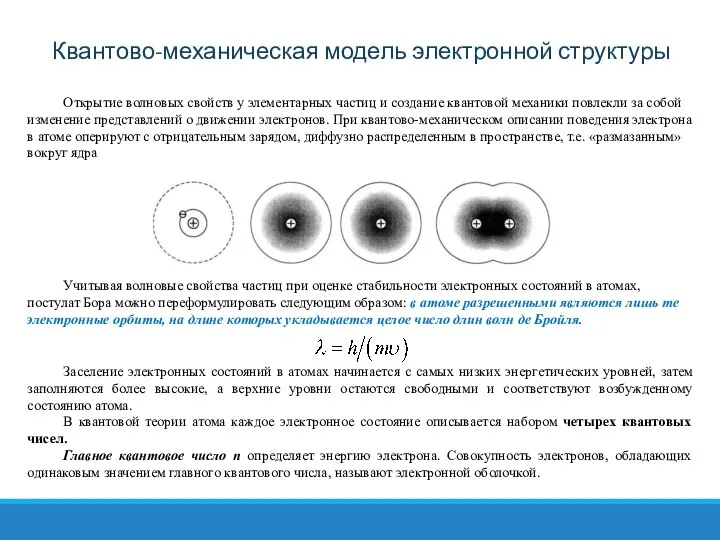
Учитывая волновые свойства частиц при оценке стабильности электронных состояний в атомах, постулат Бора можно переформулировать следующим образом: в атоме разрешенными являются лишь те электронные орбиты, на длине которых укладывается целое число длин волн де Бройля.
Заселение электронных состояний в атомах начинается с самых низких энергетических уровней, затем заполняются более высокие, а верхние уровни остаются свободными и соответствуют возбужденному состоянию атома.
В квантовой теории атома каждое электронное состояние описывается набором четырех квантовых чисел.
Главное квантовое число п определяет энергию электрона. Совокупность электронов, обладающих одинаковым значением главного квантового числа, называют электронной оболочкой.
Квантово-механическая модель электронной структуры
Слайд 16 Состояниям с квантовыми числами п = 1, 2, 3, 4, 5, 6,
Состояниям с квантовыми числами п = 1, 2, 3, 4, 5, 6,

Квантовое число l может принимать одно из следующих значений: l = 0, 1, 2, 3, …, (n - 1).
Поскольку азимутальное число l всегда меньше n, возможна следующая последовательность состояний электронов:
1s, 2s, 2р, 3s, 3р, 3d, 4s, 4р, 4d, 4f и т.д.
Если атом находится в магнитном поле, направление которого совпадает с осью Z, то проекция момента количества движения на эту ось LZ тоже принимает дискретные значения, характеризуемые магнитным квантовым числом m:
Поскольку проекция не может быть больше величины самого момента L, должно выполняться условие , т. е. магнитное квантовое число может принимать значения 0, ±1, ±2, ±3, ... ± l.
Слайд 17 Наряду с азимутальным вращением электрон вращается вокруг собственной оси. Представление электрона в
Наряду с азимутальным вращением электрон вращается вокруг собственной оси. Представление электрона в

где s — спиновое квантовое число, s = ±1 /2.
Число электронов z в каждой полностью заполненной оболочке определяется выражением
Для полностью заполненной оболочки характерно равенство суммарного орбитального и суммарного спинового моментов.
Поведение частиц с полуцелым спиновым квантовым числом, какими являются электроны, подчиняется принципу Паули (правило запрета). Согласно этому принципу в атоме (или в какой- либо другой квантовой системе) не может быть даже двух электронов, обладающих одинаковой совокупностью четырех квантовых чисел.
В одном энергетическом состоянии может находиться только один электрон. В общем случае на энергетическом уровне могут находиться два электрона, но эти электроны будут различаться направлением проекции спинового момента.
Принцип Паули дает объяснение периодической повторяемости свойств атомов, относящихся к различным химическим элементам. Химические свойства атомов определяются в первую очередь числом электронов внешней оболочки и энергией их связи с атомом. Электроны, находящиеся во внешней оболочке, называются валентными.
Слайд 18Основные видыхимической связи
Если при уменьшении расстояния между атомами энергия системы понижается по
Основные видыхимической связи
Если при уменьшении расстояния между атомами энергия системы понижается по

Устойчивая структура образуется в том случае, когда силы притяжения уравновешиваются силами отталкивания. При этом силы притяжения препятствуют удалению частиц друг от друга, а силы отталкивания противодействуют их слиянию. Притяжение между частицами сопровождается уменьшением потенциальной энергии притяжения системы Эпр. При малых расстояниях преобладают силы отталкивания между одноименными зарядами соседних атомов. Силы отталкивания, обусловленные взаимодействием ядер, играют основную роль при сближении легких атомов, ядра которых сравнительно слабо экранированы электронными оболочками. Во всех других случаях преобладает отталкивание электронов соседних атомов, причем природа этого отталкивания связана не столько с кулоновским взаимодействием, сколько с принципом запрета Паули.
Действительно, перекрытие электронных облаков двух близко расположенных атомов приведет к тому, что число электронов в каждой из взаимодействующих оболочек превысит допустимую квоту, определяемую принципом Паули. Поэтому такой процесс может происходить в том случае, если избыточные электроны займут свободные состояния с более высокой энергией. В результате увеличивается полная энергия системы, что эквивалентно появлению сил отталкивания.
Слайд 19За нулевой уровень отсчета потенциальной энергии принимают уединенное состояние атомов, когда они
За нулевой уровень отсчета потенциальной энергии принимают уединенное состояние атомов, когда они
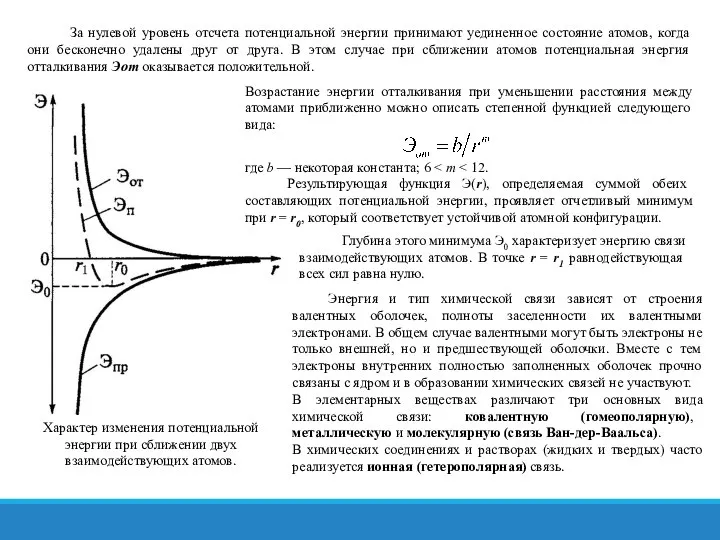
Возрастание энергии отталкивания при уменьшении расстояния между атомами приближенно можно описать степенной функцией следующего вида:
Характер изменения потенциальной энергии при сближении двух взаимодействующих атомов.
где b — некоторая константа; 6 < т < 12.
Результирующая функция Э(r), определяемая суммой обеих составляющих потенциальной энергии, проявляет отчетливый минимум при r = r0, который соответствует устойчивой атомной конфигурации.
Глубина этого минимума Э0 характеризует энергию связи взаимодействующих атомов. В точке r = r1 равнодействующая всех сил равна нулю.
Энергия и тип химической связи зависят от строения валентных оболочек, полноты заселенности их валентными электронами. В общем случае валентными могут быть электроны не только внешней, но и предшествующей оболочки. Вместе с тем электроны внутренних полностью заполненных оболочек прочно связаны с ядром и в образовании химических связей не участвуют.
В элементарных веществах различают три основных вида химической связи: ковалентную (гомеополярную), металлическую и молекулярную (связь Ван-дер-Ваальса).
В химических соединениях и растворах (жидких и твердых) часто реализуется ионная (гетерополярная) связь.
Слайд 20Ковалентная связь
Ковалентная связь. Эта связь образуется путем спаривания валентных электронов соседних атомов
Ковалентная связь
Ковалентная связь. Эта связь образуется путем спаривания валентных электронов соседних атомов

В основе ковалентной связи лежит обменное электронное взаимодействие, которое имеет чисто квантовую природу. Чем больше степень перекрытия электронных оболочек, тем больше энергия обменного взаимодействия, тем сильнее химическая связь. Характер обменного взаимодействия существенно зависит от направления спинов электронов, участвующих в образовании связи между атомами. Устойчивое состояние системы реализуется лишь при антипараллельной ориентации спинов спариваемых электронов.
Слайд 21 Ковалентная связь возникает не только между одинаковыми атомами, но и между атомами
Ковалентная связь возникает не только между одинаковыми атомами, но и между атомами

Молекулы с ковалентными связями подразделяются на полярные и неполярные, которые по-разному ведут себя в электрическом поле.
В общем случае следует отличать полярность молекулы в целом от полярности содержащихся в ней связей. Для двухатомных молекул эти понятия совпадают, причем при взаимодействии двух атомов различной природы ковалентные связи практически всегда полярны. В этом случае максимум плотности электронного заряда смещается в сторону более металлоидного атома.
Неполярные молекулы обладают центром симметрии, и благодаря симметричному распределению зарядов у них отсутствует электрический момент при отсутствии внешнего поля. При этом неполярная молекула может быть построена исключительно с помощью полярных связей. В полярных молекулах, называемых диполями, центры противоположных по знаку зарядов находятся на некотором расстоянии l друг от друга. Это расстояние называют плечом диполя. Важнейшей характеристикой полярной молекулы является дипольный (электрический) момент, под которым понимают произведение заряда на плечо:
В типичных случаях дипольный момент молекул имеет значение 10-30...2· 10-29 Кл·м.
Слайд 22 Если в образовании ковалентной связи участвуют только электроны в s-состоянии, то все
Если в образовании ковалентной связи участвуют только электроны в s-состоянии, то все
H
H
H
H
C
109,5°
Слайд 23 Гибридизация валентных электронов углеродного атома сопровождается искажением их электронных облаков. Вместо конфигураций,
Гибридизация валентных электронов углеродного атома сопровождается искажением их электронных облаков. Вместо конфигураций,
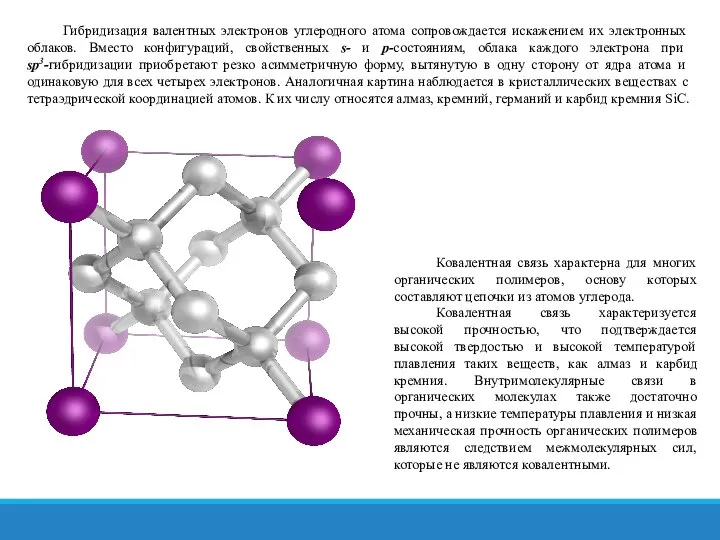
Ковалентная связь характерна для многих органических полимеров, основу которых составляют цепочки из атомов углерода.
Ковалентная связь характеризуется высокой прочностью, что подтверждается высокой твердостью и высокой температурой плавления таких веществ, как алмаз и карбид кремния. Внутримолекулярные связи в органических молекулах также достаточно прочны, а низкие температуры плавления и низкая механическая прочность органических полимеров являются следствием межмолекулярных сил, которые не являются ковалентными.
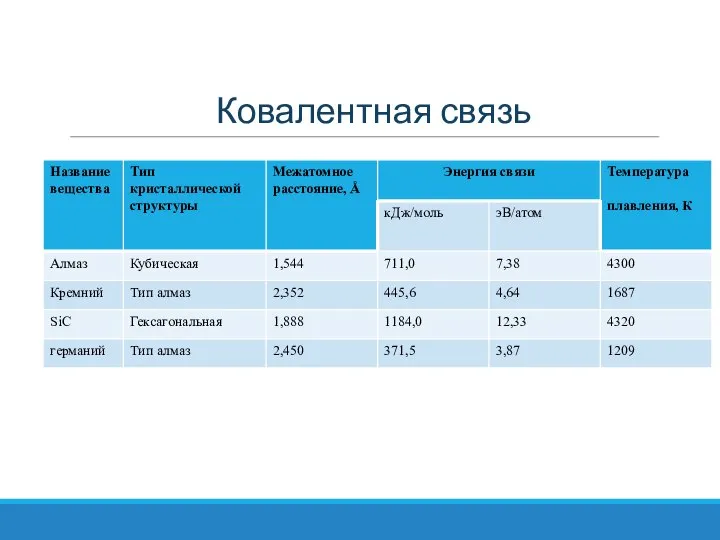
Слайд 24Ковалентная связь
Ковалентная связь
Слайд 25Ионная связь
Способность атомов захватывать или отдавать электрон при образовании химических связей характеризуется
Ионная связь
Способность атомов захватывать или отдавать электрон при образовании химических связей характеризуется
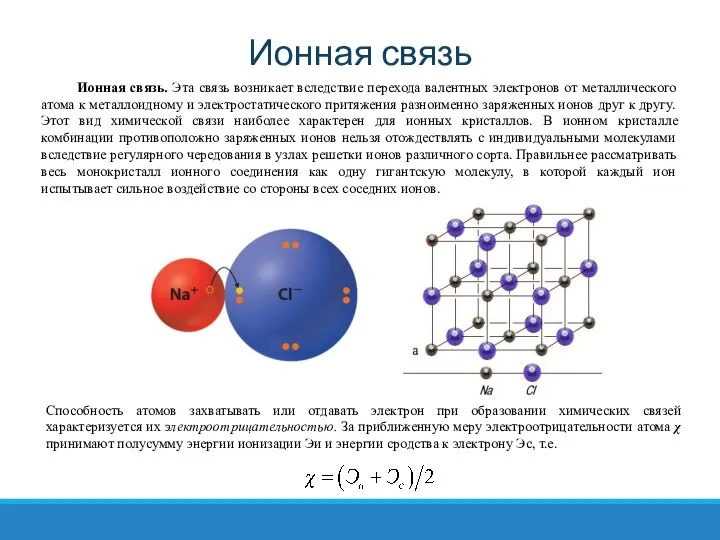
Ионная связь. Эта связь возникает вследствие перехода валентных электронов от металлического атома к металлоидному и электростатического притяжения разноименно заряженных ионов друг к другу. Этот вид химической связи наиболее характерен для ионных кристаллов. В ионном кристалле комбинации противоположно заряженных ионов нельзя отождествлять с индивидуальными молекулами вследствие регулярного чередования в узлах решетки ионов различного сорта. Правильнее рассматривать весь монокристалл ионного соединения как одну гигантскую молекулу, в которой каждый ион испытывает сильное воздействие со стороны всех соседних ионов.
Слайд 26При этом энергией сродства к электрону называют то количество энергии, которое выделяется
При этом энергией сродства к электрону называют то количество энергии, которое выделяется

Наименьшей электроотрицательностью характеризуются атомы щелочных металлов, которые легко отдают электрон (малая Эи) и в то же время имеют малое электронное сродство. Наоборот, наибольшей χ обладают атомы галогенов, которые легко принимают электрон для завершения внешней оболочки. Чем больше разность электроотрицательностей атомов, участвующих в образовании химической связи, тем больше степень ионности соединения.
Атомы инертных газов имеют замкнутые электронные оболочки и распределение заряда в них характеризуется сферической симметрией. Поэтому катионы и анионы тоже можно рассматривать как правильные сферы разных размеров, причем катионы, отдающие электроны, как правило, обладают меньшими размерами и располагаются в междоузлиях, образованных при плотной упаковке более крупных шаров — анионов. Сферическая симметрия электростатического поля обусловливает отсутствие направленности ионной связи.
Число ближайших соседей, окружающих данный ион в кристаллической решетке, называют координационным числом К.
В случае кулоновского взаимодействия каждый катион стремится окружить себя максимальным числом анионов, т.е. образовать структуру с возможно более высоким координационным числом. В этом проявляется ненасыщенность ионной связи и ее принципиальное отличие от ковалентной. Структура ионных кристаллов, а следовательно, и значения координационных чисел зависят от соотношения размеров катиона rк и аниона rа. Условию устойчивости структуры соответствует такое соотношение радиусов частиц rк/rа, при котором каждый ион соприкасается с ионами противоположного знака. Координационное число К возрастает с увеличением размера катиона, т.е. по мере приближения соотношения rк/rа к единице.
Слайд 27 Для кристаллических структур с определенным значением К существуют пределы устойчивости, определяемые геометрическим
Для кристаллических структур с определенным значением К существуют пределы устойчивости, определяемые геометрическим
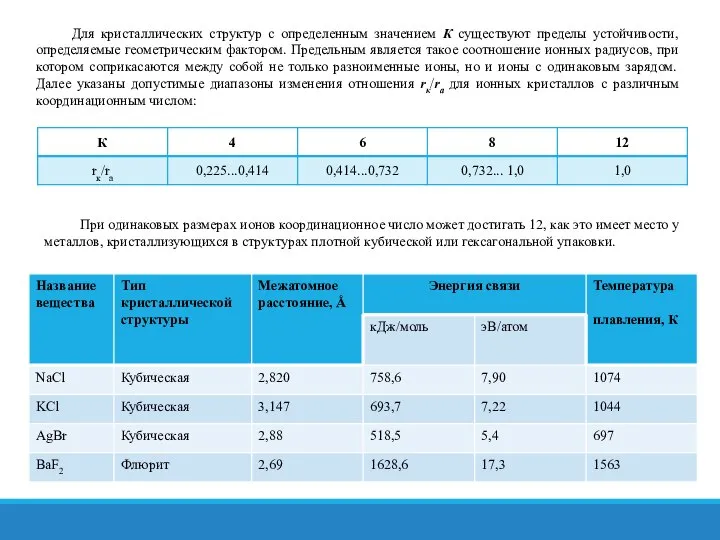
При одинаковых размерах ионов координационное число может достигать 12, как это имеет место у металлов, кристаллизующихся в структурах плотной кубической или гексагональной упаковки.
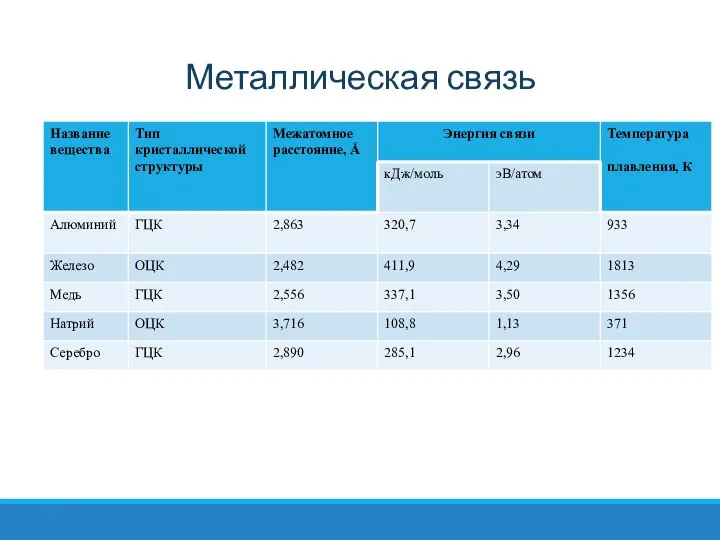
Слайд 28Металлическая связь
Металлическая связь. Эта связь существует в системах, построенных из положительных атомных
Металлическая связь
Металлическая связь. Эта связь существует в системах, построенных из положительных атомных

Металлическую связь можно рассматривать до некоторой степени как ковалентную связь, поскольку в основе этих связей лежит обобществление внешних валентных электронов. Специфика металлической связи состоит в том, что в обобществлении электронов участвуют все атомы кристалла и обобществленные электроны не локализуются вблизи своих атомов, а свободно перемещаются внутри всей решетки, образуя электронное облако. Последнее оказывает «цементирующее» действие на кристалл, объединяя в единую систему всю совокупность одноименно заряженных ионов.
Схема внутреннего строения металлов:
1 — атомные остовы;
2 — свободные электроны
Под влиянием двух противоположных сил: «стягивающего» действия коллективизированных электронов и сил отталкивания между ионами — последние фиксируются на некотором равновесном расстоянии друг от друга, соответствующем минимуму потенциальной энергии системы.
Металлические связи являются ненасыщенными и ненаправленными. Отсутствие направленности связей экспериментально подтверждается равномерным распределением заряда валентных электронов по объему металлических кристаллов.
Слайд 29 Об отсутствии насыщения связей в металле свидетельствует тот факт, что число связей
Об отсутствии насыщения связей в металле свидетельствует тот факт, что число связей

В системах с ненасыщенными связями проявляется тенденция к формированию структур с максимально высокими координационными числами. Действительно, большинство чистых металлов имеют структуру, соответствующую наиболее плотной шаровой упаковке кубического или гексагонального типа (К= 12), либо ближайшую к ним по плотности структуру объемно-центрированного куба (К = 8).
Из-за больших межатомных расстояний металлическая связь характеризуется меньшей энергией в сравнении с ковалентной и ионной связями. Не имея локализованных связей, металлические кристаллы не разрушаются при изменении положений атомов, т.е. им свойственна пластичность (ковкость) при деформациях. Благодаря наличию свободных электронов металлы обладают высокой электро- и теплопроводностью.
Металлическая связь
Слайд 30Металлическая связь
Металлическая связь
Слайд 31Молекулярная связь
Молекулярная связь (связь Ван-дер-Ваальса). Эта связь наблюдается у ряда веществ между
Молекулярная связь
Молекулярная связь (связь Ван-дер-Ваальса). Эта связь наблюдается у ряда веществ между

Подобное притяжение между флуктуирующими диполями получило название дисперсионного взаимодействия.
Если молекулы обладают постоянным электрическим моментом, т. е. являются диполями от природы, то между ними возникает электростатическое взаимодействие, стремящееся расположить молекулы в строгом порядке, которому соответствует минимум потенциальной энергии системы. Такой тип взаимодействия полярных молекул, зависящий от их ориентации, называют ориентационным.
Слайд 32Связь Ван-дер-Ваальса является наиболее универсальной среди всех видов связей. Она возникает между
Связь Ван-дер-Ваальса является наиболее универсальной среди всех видов связей. Она возникает между
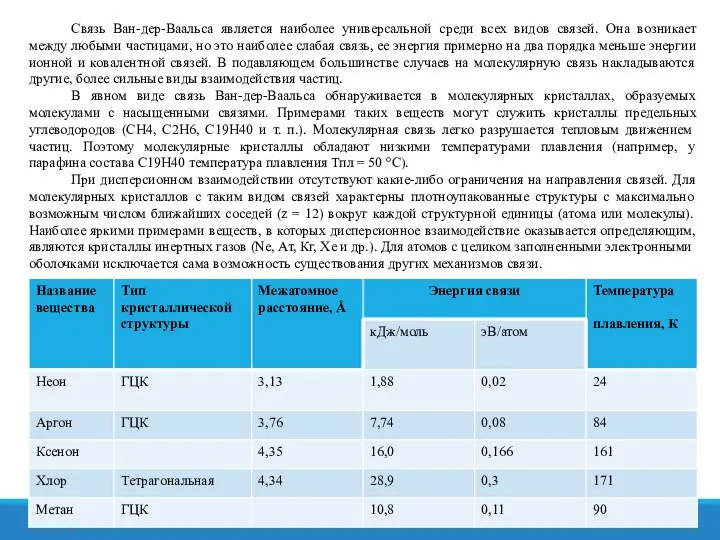
В явном виде связь Ван-дер-Ваальса обнаруживается в молекулярных кристаллах, образуемых молекулами с насыщенными связями. Примерами таких веществ могут служить кристаллы предельных углеводородов (СН4, С2Н6, С19Н40 и т. п.). Молекулярная связь легко разрушается тепловым движением частиц. Поэтому молекулярные кристаллы обладают низкими температурами плавления (например, у парафина состава С19Н40 температура плавления Тпл = 50 °С).
При дисперсионном взаимодействии отсутствуют какие-либо ограничения на направления связей. Для молекулярных кристаллов с таким видом связей характерны плотноупакованные структуры с максимально возможным числом ближайших соседей (z = 12) вокруг каждой структурной единицы (атома или молекулы). Наиболее яркими примерами веществ, в которых дисперсионное взаимодействие оказывается определяющим, являются кристаллы инертных газов (Ne, Ат, Кг, Хе и др.). Для атомов с целиком заполненными электронными оболочками исключается сама возможность существования других механизмов связи.
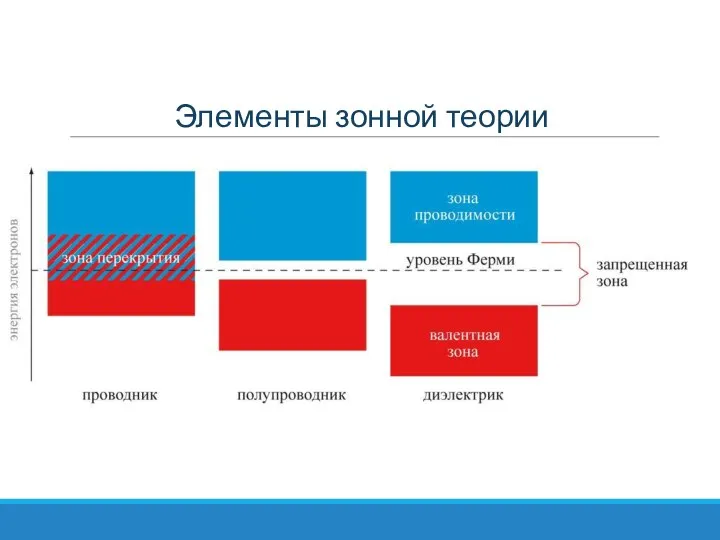
Слайд 33Элементы зонной теории
Элементы зонной теории
Слайд 34 Микроэлектроника — подраздел электроники, связанный с изучением и производством электронных компонентов с геометрическими размерами характерных элементов порядка
Микроэлектроника — подраздел электроники, связанный с изучением и производством электронных компонентов с геометрическими размерами характерных элементов порядка

Основная задача которого – создание высоконадежных экономичных микроминиатюрных электронных схем и устройств, которые могут иметь сложную функциональную структуру.
Большинство компонентов обычной электроники: резисторы, конденсаторы, катушки ндуктивности, диоды, транзисторы, изоляторы и проводник — также применяются и в микроэлектронике, но уже в виде миниатюрных устройств в интегральном исполнении.
Микроэлектроника
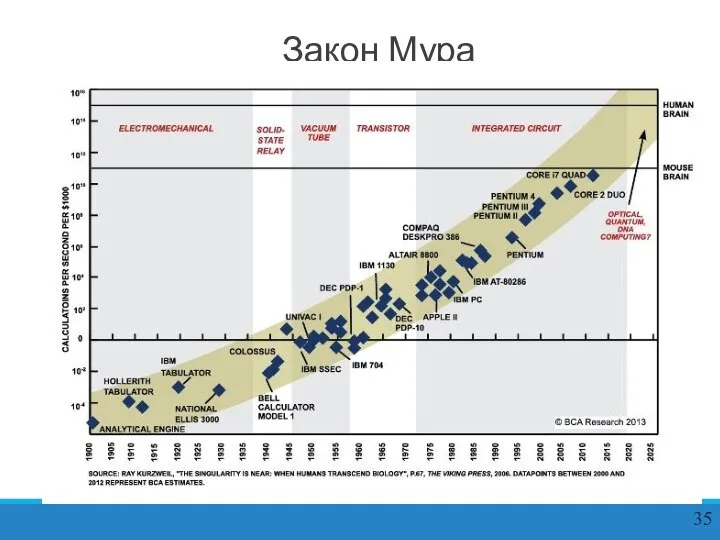
Слайд 35Закон Мура
Закон Мура
Слайд 36Микро- и нано- электроника
В Техническом комитете ISO/ТК 229 под нанотехнологиями подразумевается следующее:
знание и
Микро- и нано- электроника
В Техническом комитете ISO/ТК 229 под нанотехнологиями подразумевается следующее:
знание и

использование свойств объектов и материалов в нанометровом масштабе, которые отличаются от свойств свободных атомов или молекул, а также от объемных свойств вещества, состоящего из этих атомов или молекул, для создания более совершенных материалов, приборов, систем, реализующих эти свойства.
Нанотехнологии "совокупность приёмов и способов получения, обработки или переработки сырья, материалов, характерные размеры, либо точности изготовления которых составляют величины на уровне или ниже 100 нм.
Слайд 37Современные микросхемы
Технологии позволяют изготовить микросхемы, в которых характеристическая величина, минимального элемента составляет
Современные микросхемы
Технологии позволяют изготовить микросхемы, в которых характеристическая величина, минимального элемента составляет
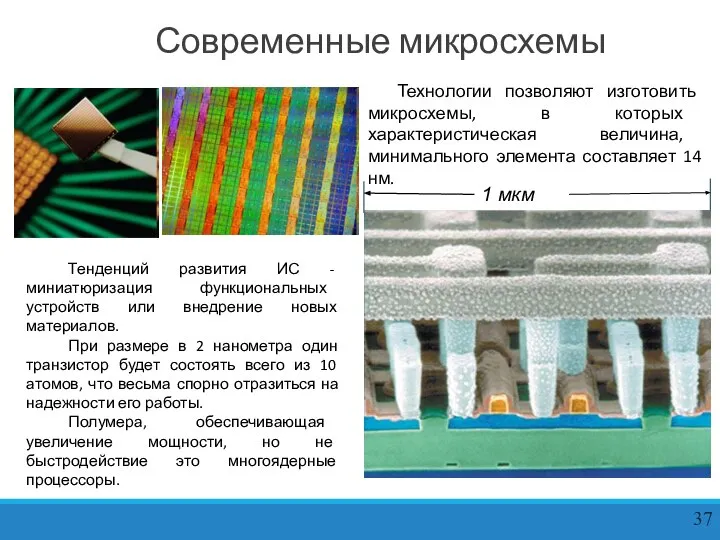
1 мкм
Тенденций развития ИС - миниатюризация функциональных устройств или внедрение новых материалов.
При размере в 2 нанометра один транзистор будет состоять всего из 10 атомов, что весьма спорно отразиться на надежности его работы.
Полумера, обеспечивающая увеличение мощности, но не быстродействие это многоядерные процессоры.
Слайд 38Классификация ИС по степени интеграции
В зависимости от степени интеграции применяются следующие названия
Классификация ИС по степени интеграции
В зависимости от степени интеграции применяются следующие названия

малая интегральная схема (МИС) — до 100 элементов в кристалле,
средняя интегральная схема (СИС) — до 1000 элементов в кристалле,
большая интегральная схема (БИС) — до 10 тыс. элементов в кристалле,
сверхбольшая интегральная схема (СБИС) — более 10 тыс. элементов в кристалле.
Ранее использовались также теперь устаревшие названия: ультрабольшая интегральная схема (УБИС) — от 1-10 млн. до 1 млрд. элементов в кристалле и, иногда, гигабольшая интегральная схема (ГБИС) — более 1 млрд. элементов в кристалле.
В настоящее время, в 2010-х, названия «УБИС» и «ГБИС» практически не используются, и все микросхемы с числом элементов более 10 тыс. относят к классу СБИС.
Слайд 39Топология ИМС
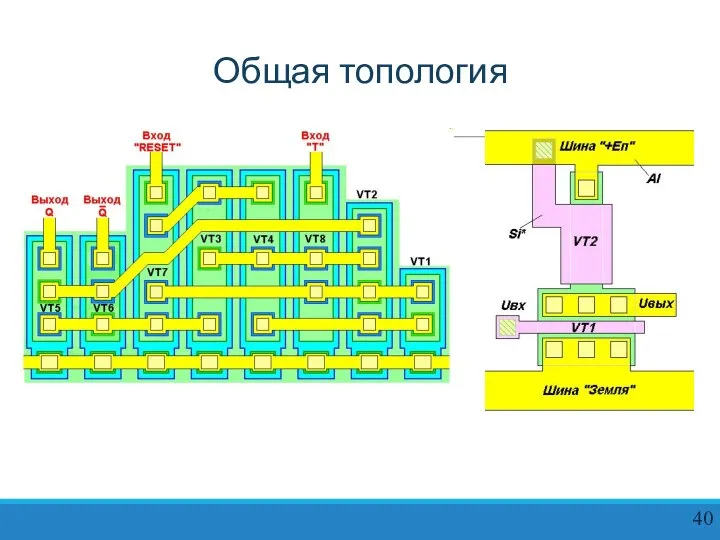
Это чертеж, определяющий форму, размеры и взаимное расположение элементов и соединений
Топология ИМС
Это чертеж, определяющий форму, размеры и взаимное расположение элементов и соединений

Виды топологии:
Общая (совмещенная) – все слои на одном чертеже разным цветом.
Послойная – на каждом чертеже только один слой.
Слайд 40Общая топология
Общая топология
Слайд 41Общая топология БИС и СБИС
Общая топология БИС и СБИС

Слайд 423D-модель кристалла ИМС
3D-модель кристалла ИМС

Слайд 43Структура ИМС
Это последовательность слоев в составе микросхемы по нормали к поверхности кристалла,
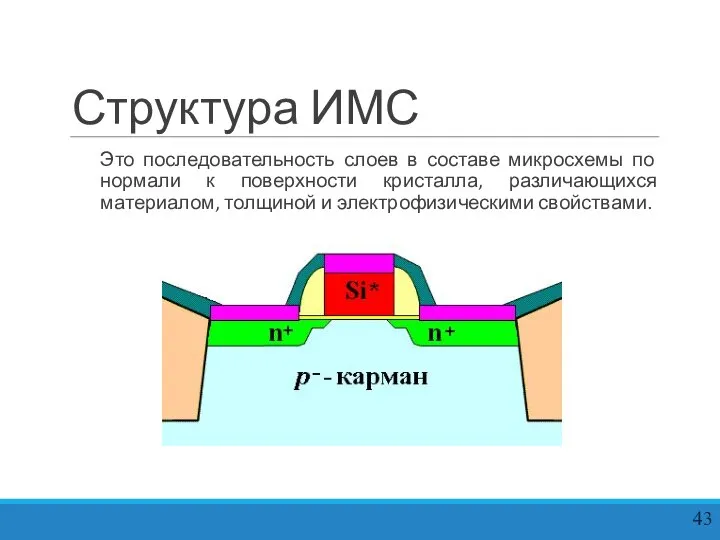
Структура ИМС
Это последовательность слоев в составе микросхемы по нормали к поверхности кристалла,
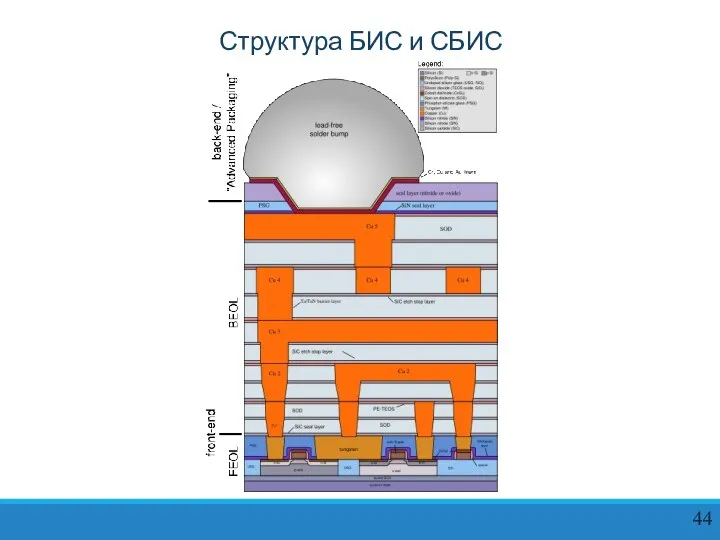
Слайд 44Структура БИС и СБИС
Структура БИС и СБИС
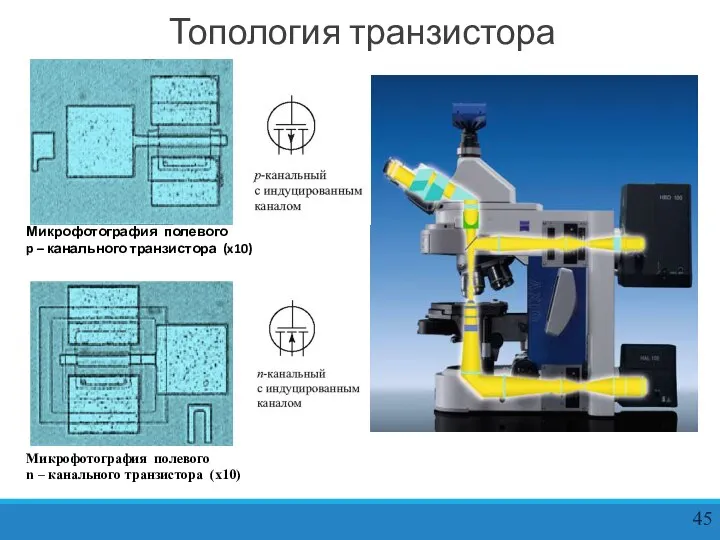
Слайд 45Топология транзистора
Микрофотография полевого
n – канального транзистора (x10)
Микрофотография полевого
p – канального
Топология транзистора
Микрофотография полевого
n – канального транзистора (x10)
Микрофотография полевого
p – канального
Слайд 46Микросхемы будущего
Микросхемы из углеродных нано материалах в разы энергоэффективнее.
Одной из причин
Микросхемы будущего
Микросхемы из углеродных нано материалах в разы энергоэффективнее.
Одной из причин

Другая причина – быстродействие
Структура полевого транзистора, соединенного нанопроводами.
Слайд 47Варианты исполнения
Корпусные ИМС
Бескорпусные ИМС
Полупроводниковый кристалл, предназначенный для монтажа в гибридную микросхему или
Варианты исполнения
Корпусные ИМС
Бескорпусные ИМС
Полупроводниковый кристалл, предназначенный для монтажа в гибридную микросхему или

Слайд 48Корпус ИМС
Это часть конструкции микросхемы, предназначенная для защиты от внешних воздействий и
Корпус ИМС
Это часть конструкции микросхемы, предназначенная для защиты от внешних воздействий и

Слайд 49Шаг выводов корпусов ИМС
Российские
2,5 мм
1,25 мм
Импортные
1/10 дюйма (2,54 мм)
1/20 дюйма (1,28
Шаг выводов корпусов ИМС
Российские
2,5 мм
1,25 мм
Импортные
1/10 дюйма (2,54 мм)
1/20 дюйма (1,28

В корпусах до 16 выводов эта разница не значительна, а при больших размерах идентичные корпуса уже несовместимы.
Корпуса для поверхностного монтажа
0,8 мм
0,65 мм
 Презентация на тему Молния
Презентация на тему Молния  Законы сохранения в механике
Законы сохранения в механике Газовые законы
Газовые законы Электрический ток в жидкостях
Электрический ток в жидкостях КПД нагревателя
КПД нагревателя Биохимическая физика
Биохимическая физика Презентация на тему Электроемкость Конденсаторы
Презентация на тему Электроемкость Конденсаторы  Окружающие нас тела называются физическими телами. Строение вещества. Молекула
Окружающие нас тела называются физическими телами. Строение вещества. Молекула INFINI™ High Intensity Focused RF. Обучение
INFINI™ High Intensity Focused RF. Обучение Источники света. Распространение света
Источники света. Распространение света Электромагнитные колебания
Электромагнитные колебания Работа в электрическом поле
Работа в электрическом поле Получение, использование, история исследования, диапазон, длина волны
Получение, использование, история исследования, диапазон, длина волны Электромагнитные волны. Волновое уравнение электромагнитной волны
Электромагнитные волны. Волновое уравнение электромагнитной волны Магнитное поле. Тема № 6
Магнитное поле. Тема № 6 Виды радиоактивного излучения. (Лекция 3)
Виды радиоактивного излучения. (Лекция 3) Плотность вещества
Плотность вещества Плавание тел
Плавание тел Суд над атомом. Мультимедийный урок
Суд над атомом. Мультимедийный урок Использование простых механизмов
Использование простых механизмов Кинематика цепной передачи
Кинематика цепной передачи Определение проницаемости
Определение проницаемости Тела вращения
Тела вращения Презентация на тему Кристаллические и аморфные тела
Презентация на тему Кристаллические и аморфные тела  Механизм кинематикасының графикалық әдістері
Механизм кинематикасының графикалық әдістері Автомобили III
Автомобили III Второй закон термодинамики
Второй закон термодинамики Тайны мыльных пузырей
Тайны мыльных пузырей