Содержание
- 2. Для решения этой задачи Бор, сохраняя классический подход к описанию поведения электрона в атоме, выдвинул три
- 3. Первый постулат Бора называется постулатом стационарных состояний. Он заключается в следующем: в атоме существуют некоторые стационарные
- 4. Здесь т — масса электрона, υ — его скорость, r — радиус круговой орбиты, = h/2π.
- 5. Третий постулат Бора, или правило частот, устанавливает, что при переходе атома из одного стационарного состояния в
- 6. При En > Em происходит излучение фотона, при En 3. Первый и третий постулаты Бора, квантовомеханическое
- 7. Таким образом, целые числа, которые входят в сериальную формулу (28.5), определяют дискретные, квантованные значения энергии атома
- 8. Абсолютное значение величины Еп в формуле (28.8) является энергией связи электрона в атоме, находящегося в состоянии
- 9. Квантование энергии и вычисление постоянной Ридберга в теории Бора Постулаты, выдвинутые Бором, позволили ему теоретически рассчитать
- 10. Возведем в квадрат обе части соотношения (28.6), заменив в нем υ на ωr: Поделим почленно друг
- 11. Энергия электрона в атоме водорода (или соответствующем ионе) складывается из кинетической энергии К и потенциальной энергии
- 12. Нетрудно заметить, что, кроме использования постулатов Бора, вывод формулы (28.12) носит чисто классический характер. Все описание
- 13. Опыты Франка и Герца Первый и третий постулаты Бора были экспериментально подтверждены в опытах Франка и
- 14. При прохождении электронов через пары ртути происходят соударения электронов с атомами ртути. Столкновения электронов с атомами
- 15. задерживающего поля между сеткой S и анодом А, анодный ток должен практически упасть до нуля. По
- 16. электрон полностью отдаст свою энергию атому. Вся энергия электрона пойдет на переход атома ртути из нормального
- 17. опытах Франка —Герца приведена на рис. 28.6. При φ1 = 4,86 В, 9,72 В и 14,58
- 18. Этот результат полностью согласуется с экспериментом: ртутные пары излучали главным образом именно эту длину волны. Помимо
- 19. Однако, наряду со значительными успехами, в теории Бора сразу же обнаружились существенные недостатки. Основным из них
- 21. Скачать презентацию
Слайд 2Для решения этой задачи Бор, сохраняя классический подход к описанию поведения электрона
Для решения этой задачи Бор, сохраняя классический подход к описанию поведения электрона

Теория Бора развивалась им для атома водорода и так называемых водородоподобных систем, состоящих из ядра с зарядом Ze и одного электрона, движущегося вокруг ядра. Примерами подобных систем являются однократно ионизованный гелий (Не+), двукратно ионизованный литий (Li++) и другие ионы. Такие системы называются также изоэлектронными водороду. Для водородоподобных систем все сериальные формулы, в частности формулы (28.5), вместо R содержат произведение RZ2.
Слайд 3Первый постулат Бора называется постулатом стационарных состояний. Он заключается в следующем: в
Первый постулат Бора называется постулатом стационарных состояний. Он заключается в следующем: в

Второй постулат Бора называется правилом квантования орбит и утверждает, что в стационарном состоянии атома электрон, двигаясь по круговой орбите, должен иметь дискретные, квантованные значения момента импульса:
(28.6)
Слайд 4Здесь т — масса электрона, υ — его скорость, r — радиус
Здесь т — масса электрона, υ — его скорость, r — радиус

2υr = nλ.
Воспользуемся формулой, определяющей длину волны де Бройля. Тогда получим
что совпадает со вторым постулатом Бора (25.6).
Слайд 5Третий постулат Бора, или правило частот, устанавливает, что при переходе атома из
Третий постулат Бора, или правило частот, устанавливает, что при переходе атома из

ΔE =
Eп – Eт = hν
(28.7)
Слайд 6При En > Em происходит излучение фотона, при En Из третьего постулата Бора следует, что атомы поглощают только те спектральные линии (частоты), которые они сами могут испускать. В оптике этот факт еще со времен Кирхгофа называется обращением спектральных линий.
Из третьего постулата Бора следует, что атомы поглощают только те спектральные линии (частоты), которые они сами могут испускать. В оптике этот факт еще со времен Кирхгофа называется обращением спектральных линий.
3. Первый и третий постулаты Бора, квантовомеханическое обоснование которых мы рассмотрим далее, позволили связать между собой три результата, указанные в п. 1. К 1913 г. они были полностью подтверждены экспериментом. Второй постулат Бора был его гениальной догадкой, подтвержденной в дальнейшем экспериментально и теоретически.
Сравним между собой формулы (28.5) и (28.7). Сравнение приводит к очень важному результату. Оказывается, что энергия Eп атома водорода в некотором стационарном состоянии имеет вид
(28.8)
При En > Em происходит излучение фотона, при En Сравним между собой формулы (28.5) и (28.7). Сравнение приводит к очень важному результату. Оказывается, что энергия Eп атома водорода в некотором стационарном состоянии имеет вид (28.8)
3. Первый и третий постулаты Бора, квантовомеханическое обоснование которых мы рассмотрим далее, позволили связать между собой три результата, указанные в п. 1. К 1913 г. они были полностью подтверждены экспериментом. Второй постулат Бора был его гениальной догадкой, подтвержденной в дальнейшем экспериментально и теоретически.
Слайд 7Таким образом, целые числа, которые входят в сериальную формулу (28.5), определяют дискретные,
Таким образом, целые числа, которые входят в сериальную формулу (28.5), определяют дискретные,

n > 1 называются возбужденными.
Знак минус в формуле (28.8) — отрицательные значения энергетических уровней — означает, что электрон испытывает силу притяжения к ядру, он связан с ним кулоновской силой притяжения.
Слайд 8Абсолютное значение величины Еп в формуле (28.8) является энергией связи электрона в
Абсолютное значение величины Еп в формуле (28.8) является энергией связи электрона в

Еп→0. Значение Е∞ =0 соответствует ионизации атома. Стрелками на рис. 28.3 указаны переходы, соответствующие излучению различных серий спектральных линий.
Слайд 9Квантование энергии и вычисление постоянной Ридберга
в теории Бора
Постулаты, выдвинутые Бором, позволили
Квантование энергии и вычисление постоянной Ридберга
в теории Бора
Постулаты, выдвинутые Бором, позволили

(28.9)
или, так как υ = ωm, где ω — угловая скорость электрона,
Слайд 10Возведем в квадрат обе части соотношения (28.6), заменив в нем υ на
Возведем в квадрат обе части соотношения (28.6), заменив в нем υ на

Поделим почленно друг на друга левые и правые части двух последних формул. Тогда получим
(28.10)
Радиусы орбит электрона в атоме водорода (Z = l) прямо пропор-циальны квадратам главного квантового числа. В частности, радиус первой орбиты при п = 1, называемый первым боровским радиусом, равен
Первый боровский радиус принят за единицу длины в атомной физике.
Слайд 11Энергия электрона в атоме водорода (или соответствующем ионе) складывается из кинетической энергии
Энергия электрона в атоме водорода (или соответствующем ионе) складывается из кинетической энергии

(28.11)
Здесь мы использовали формулу (28.9), а также то, что потенциальная энергия притяжения электрона к ядру отрицательна и имеет вид
На рис. 28.4 изображена графически зависимость U(r) для электрона в поле ядра с зарядом Ze. Ядро находится в начале координат. Подставим в (28.11) выражение для r (см. (28.10)). Получим
Рис. 28.4
(28.12)
Слайд 12Нетрудно заметить, что, кроме использования постулатов Бора, вывод формулы (28.12) носит чисто
Нетрудно заметить, что, кроме использования постулатов Бора, вывод формулы (28.12) носит чисто

Сравнивая формулы (28.8) и (28.12) и полагая для водорода Z = 1, получим выражение для постоянной Ридберга:
(28.13)
Итак, для водородоподобного иона энергия в некотором стационарном состоянии имеет вид (ср. с (28.8))
(28.14)
а волновые числа спектральных линий выражаются формулой
(ср. с (28.5))
(28.15)
Слайд 13Опыты Франка и Герца
Первый и третий постулаты Бора были экспериментально подтверждены в
Опыты Франка и Герца
Первый и третий постулаты Бора были экспериментально подтверждены в

с гальванометром G, и сетчатый электрод S. Между катодом и сеткой создавалось электрическое поле, ускоряющее электроны до энергии еφ1 где φ1- разность потенциалов между катодом и сеткой, е - заряд электрона. Между сеткой и анодом создавалось слабое замедляющее поле с разностью потенциалов φа не более 0,5 В.
Рис. 28.5
Слайд 14При прохождении электронов через пары ртути происходят соударения электронов с атомами ртути.
При прохождении электронов через пары ртути происходят соударения электронов с атомами ртути.

Упругие соударения электронов с атомами ртути не могут воспрепятствовать электронам попадать на анод. Ускоряющее электрическое поле между К и S по мере возрастания разности потенциалов φ1 должно вызывать возрастание анодного тока в трубке, и упругие столкновения не могут нарушить этой закономерности. Неупругие столкновения могут явиться причиной практически полного отсутствия анодного тока. В самом деле, если электроны при неупругом столкновении с атомами ртути потеряют свою энергию настолько, что они не смогут преодолеть слабого
Слайд 15задерживающего поля между сеткой S и анодом А, анодный ток должен практически
задерживающего поля между сеткой S и анодом А, анодный ток должен практически

По первому постулату Бора, атом ртути не может принять от электрона любую порцию энергии. Атом может воспринять лишь такую энергию, которой будет достаточно для перехода атома в одно из возбужденных энергетических состояний. Ближайшим к основному, невозбужденному состоянию атома ртути является возбужденное состояние, отстоящее от основного по шкале энергий на 4,86 эВ. До тех пор, пока электроны, ускоряемые полем, не приобретут энергию еφ1 = 4,86 эВ, они испытывают только упругие столкновения с атомами, не теряют своей энергии, достигают анода и анодный ток возрастает. Как только энергия электрона достигнет значения 4,86 эВ, может произойти неупругое соударение электрона с атомом ртути, в результате которого
Слайд 16электрон полностью отдаст свою энергию атому. Вся энергия электрона пойдет на переход
электрон полностью отдаст свою энергию атому. Вся энергия электрона пойдет на переход
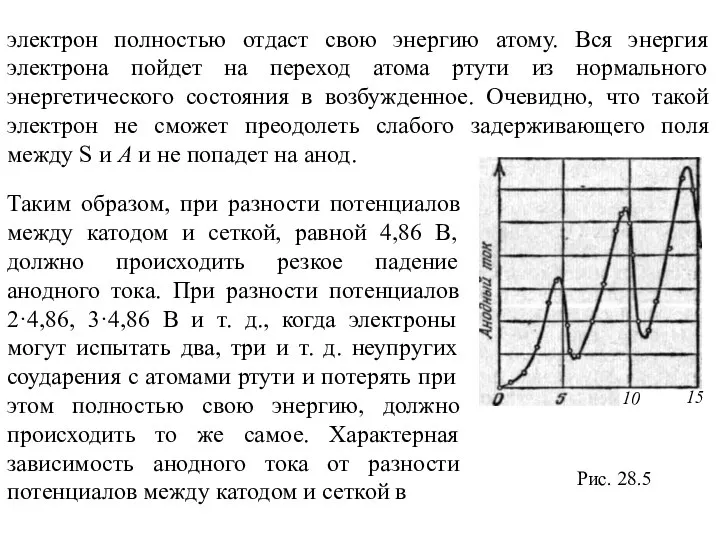
Таким образом, при разности потенциалов между катодом и сеткой, равной 4,86 В, должно происходить резкое падение анодного тока. При разности потенциалов 2·4,86, 3·4,86 В и т. д., когда электроны могут испытать два, три и т. д. неупругих соударения с атомами ртути и потерять при этом полностью свою энергию, должно происходить то же самое. Характерная зависимость анодного тока от разности потенциалов между катодом и сеткой в
Рис. 28.5
10
15
Слайд 17опытах Франка —Герца приведена на рис. 28.6. При φ1 = 4,86 В,
опытах Франка —Герца приведена на рис. 28.6. При φ1 = 4,86 В,

В опытах Франка и Герца получил экспериментальное подтверждение третий постулат Бора (правило частот). Ртутные пары, находящиеся в трубке, с которой производились опыты, оказались источниками ультрафиолетового свечения с длиной волны 253,7 нм. Излучение ртутных паров связано с тем, что атомы ртути, возбужденные электронным ударом, находятся на возбужденном энергетическом уровне весьма непродолжительное время, порядка 10-8 с, и затем возвращаются на основной энергетический уровень. Согласно третьему постулату Бора, в момент перехода атома в нормальное состояние излучается квант энергии в виде фотона с энергией ΔΕ= hv. По известной величине ΔE = 4,86 эВ=4,86·е Дж, где е = 1,6-19 Кл — заряд электрона, можно вычислить длину волны испускаемого света:
Слайд 18Этот результат полностью согласуется с экспериментом: ртутные пары излучали главным образом именно
Этот результат полностью согласуется с экспериментом: ртутные пары излучали главным образом именно

Помимо теоретического истолкования линейчатых спектров водородоподобных систем, теория Бора позволила объяснить физическую природу так называемых характеристических рентгеновских лучей и ряд других явлений, изложение которых выходит за нашего курса. Теория Бора сыграла огромную роль в создании атомной физики. В период ее развития (1913—1925 гг.) были сделаны важные открытия, часть из которых рассмотрена в лекциях. Особенно велика роль теории Бора в развитии атомной, а частично и молекулярной спектроскопии — учения о спектрах атомов и молекул. С помощью теории Бора огромный экспериментальный материал о спектрах атомов и молекул был систематизирован и сведен к полуэмпирическим закономерностям.
Слайд 19Однако, наряду со значительными успехами, в теории Бора сразу же обнаружились существенные
Однако, наряду со значительными успехами, в теории Бора сразу же обнаружились существенные

 Неисправности транспортного средства
Неисправности транспортного средства Сложение двух сил, направленных по одной прямой. Равнодействующая сила
Сложение двух сил, направленных по одной прямой. Равнодействующая сила Расчет цепей с несколькими источниками ЭДС методом наложения
Расчет цепей с несколькими источниками ЭДС методом наложения Mechanická práca
Mechanická práca Влажность. Решение задач. 8 класс
Влажность. Решение задач. 8 класс Строение газообразных, жидких и твёрдых тел
Строение газообразных, жидких и твёрдых тел Мелкая прямоугольная яма
Мелкая прямоугольная яма Электрические явления. Заряд
Электрические явления. Заряд Физические основы лазеров. Газовые лазеры
Физические основы лазеров. Газовые лазеры Аналогия между механическими и электромагнитными колебаниями
Аналогия между механическими и электромагнитными колебаниями Научно-исследовательская работа. Парадоксы физики
Научно-исследовательская работа. Парадоксы физики Презентация на тему Движение тела, брошенного вертикально вверх
Презентация на тему Движение тела, брошенного вертикально вверх  Конденсатор. Энергия заряженного конденсатора
Конденсатор. Энергия заряженного конденсатора Виды передач движения
Виды передач движения Кожухотрубный реактор
Кожухотрубный реактор Досліди Фарадея. Явище електромагнітної індукції. 9кл
Досліди Фарадея. Явище електромагнітної індукції. 9кл Тест по теме Электромагнетизм
Тест по теме Электромагнетизм Lektsia_10_DRTTs_22 (1)
Lektsia_10_DRTTs_22 (1) Влияние соотношения площади поверхности к объему на скорость диффузии
Влияние соотношения площади поверхности к объему на скорость диффузии Одиниці вимірювання маси
Одиниці вимірювання маси Презентация на тему Статика
Презентация на тему Статика  Опыты Резерфорда. Ядерная модель атома
Опыты Резерфорда. Ядерная модель атома График скорости. График координаты. Задачи
График скорости. График координаты. Задачи Последовательное и параллельное соединение проводников
Последовательное и параллельное соединение проводников Компетенция Мехатроника
Компетенция Мехатроника Устройство, принцип работы, диагностика и техническое обслуживание автомобильных генераторов
Устройство, принцип работы, диагностика и техническое обслуживание автомобильных генераторов Волны в океане
Волны в океане Анализ установившихся и переходных режимов в системе электроснабжения 220/110 кВ
Анализ установившихся и переходных режимов в системе электроснабжения 220/110 кВ