Содержание
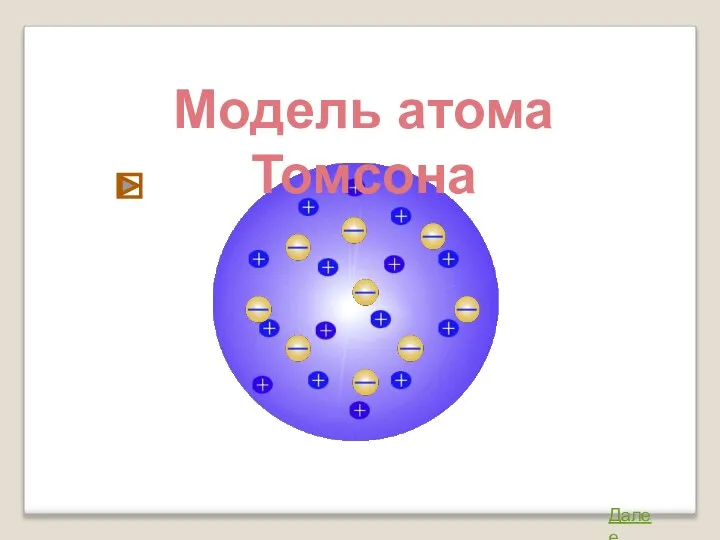
- 2. Модель атома Томсона Джозеф Джон Томсон (1856 – 1940) Атом представляет собой непрерывно заряженный положительным зарядом
- 3. Модель атома Томсона Далее
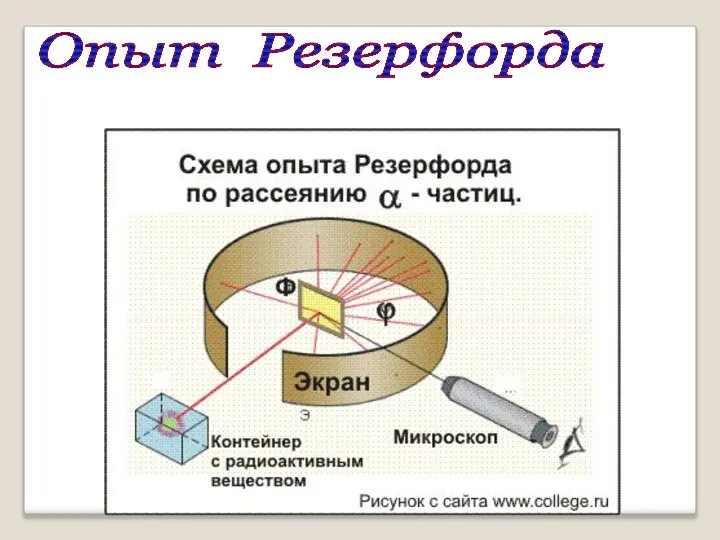
- 4. Модель атома Резерфорда Эрнест Резерфорд (1871 – 1937) Экспериментально исследовал распределение положительного заряда. В 1906 г.
- 5. Опыт Резерфорда
- 6. ? Схема опыта Резерфорда Фольга Радиоактивное вещество Скорость α- частиц - 1/30 скорости света в вакууме
- 7. Недостатки атома Резерфорда Эта модель не согласуется с наблюдаемой стабильностью атомов. По законам классической электродинамики вращающийся
- 8. Планетарная модель атома
- 9. Квантовые постулаты Бора
- 10. Трудности теории Бора КВАНТОВАЯ МЕХАНИКА - наука, позволяющая предсказать поведение огромного числа физических систем – от
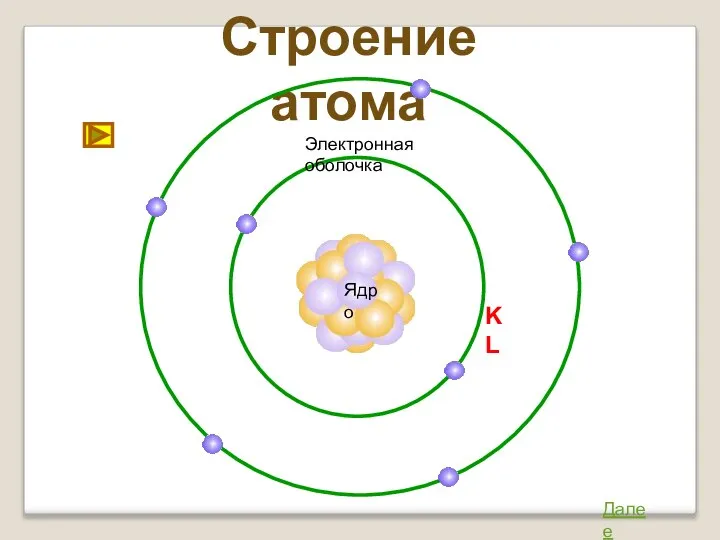
- 11. Строение атома Ядро Далее Электронная оболочка K L
- 12. Энергия связи атомных ядер – та энергия, которая необходима для полного расщепления ядра на отдельные частицы.
- 13. Уменьшение массы при образовании ядра из частиц уменьшается энергия этой системы частиц на значение энергии связи
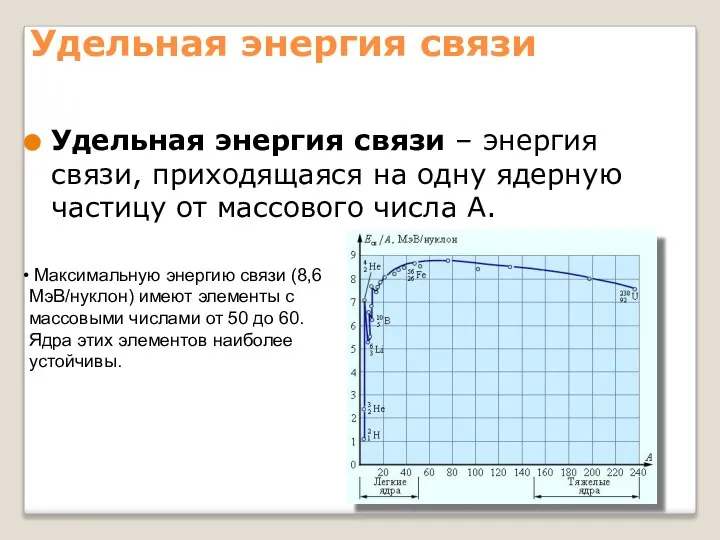
- 14. Удельная энергия связи Удельная энергия связи – энергия связи, приходящаяся на одну ядерную частицу от массового
- 15. Ядерные силы являются короткодействующими. Нуклоны, находящиеся на поверхности ядра, взаимодействуют с меньшим числом соседей, чем нуклоны
- 16. Ядерные силы ( сильное взаимодействие)-силы, действующие между нуклонами в ядре и обеспечивающие существование устойчивых ядер Являются
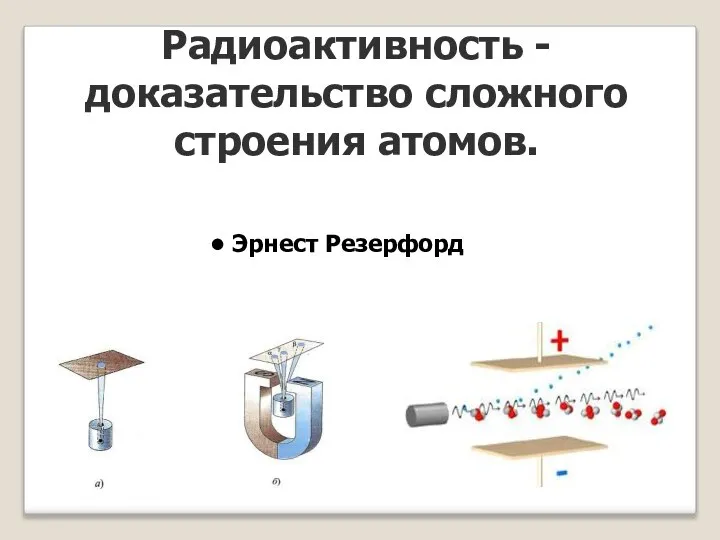
- 17. Радиоактивность - доказательство сложного строения атомов. Эрнест Резерфорд
- 19. Скачать презентацию











 Ядерные силы. Ядерные реакции
Ядерные силы. Ядерные реакции Коробка передач
Коробка передач Experimental studies of modular generator
Experimental studies of modular generator Радиактивность
Радиактивность Холлофайбер – универсальный теплоизоляционный материал нового века
Холлофайбер – универсальный теплоизоляционный материал нового века Лекция 1
Лекция 1 Определение параметров колебательного движения
Определение параметров колебательного движения Измерение физических величин
Измерение физических величин Презентация на тему Расчёт массы тела по его плотности
Презентация на тему Расчёт массы тела по его плотности  Свойства жидкостей
Свойства жидкостей Адронный коллайдер
Адронный коллайдер Динамика вращательного движения
Динамика вращательного движения Шлюзы и фонтаны
Шлюзы и фонтаны Задачи небесной механики
Задачи небесной механики Исследование зависимости угла преломления от угла падения света
Исследование зависимости угла преломления от угла падения света Идеальный газ
Идеальный газ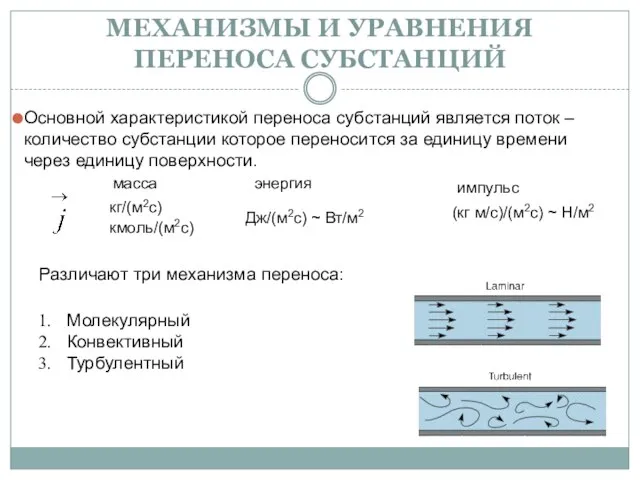 Механизмы и уравнения переноса субстанций
Механизмы и уравнения переноса субстанций Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения Порівняння роботи рухомого складу за різними видами тяги
Порівняння роботи рухомого складу за різними видами тяги Постоянный_электрический_ток
Постоянный_электрический_ток Коэффициент отражения
Коэффициент отражения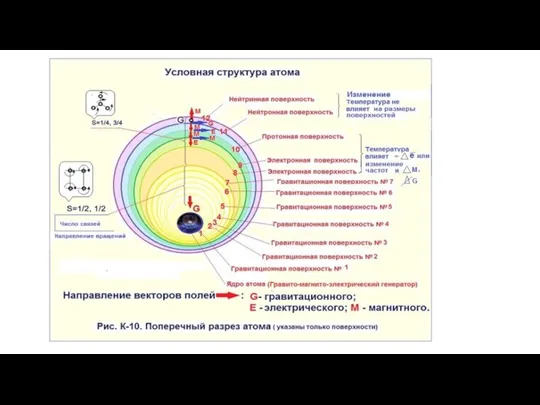 Условная структура атома
Условная структура атома Лампа накаливания. История создания. Современная конструкция
Лампа накаливания. История создания. Современная конструкция Izolace, separace a detekce proteinů část ii
Izolace, separace a detekce proteinů část ii Деление атомного ядра
Деление атомного ядра Эпиграфы
Эпиграфы Механические передачи. Цилиндрические и конические зубчатые передачи. (Лекция 5)
Механические передачи. Цилиндрические и конические зубчатые передачи. (Лекция 5) Аккумулирование энергии
Аккумулирование энергии