Содержание
- 2. Идеальный газ Молекулы представлены как материальные точки 2. Между молекулами отсутствуют силы притяжения и отталкивания
- 3. Модель идеального газа была предложена в 1847 г. Дж. Герапатом Эта модель является основой для МКТ
- 4. R = 8,31 Дж/моль⋅К – универсальная газовая постоянная Уравнение состояния идеального газа Уравнение Менделеева – Клапейрона:
- 5. Три основных константы молекулярной физики R = 8,31 Дж/моль⋅К – универсальная газовая постоянная k = 1,38⋅10-23
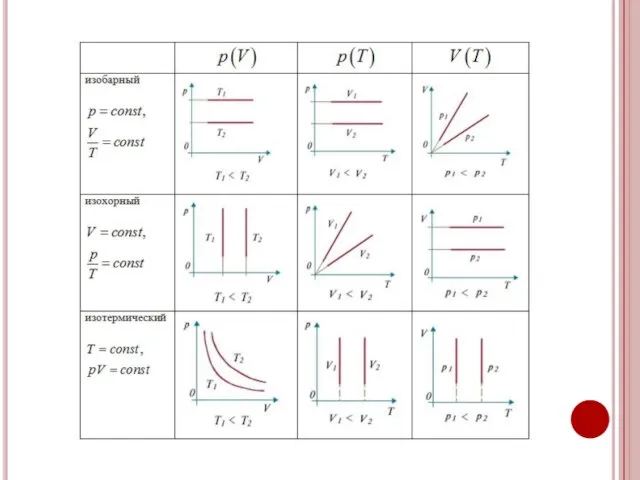
- 6. Изопроцессы в идеальных газах
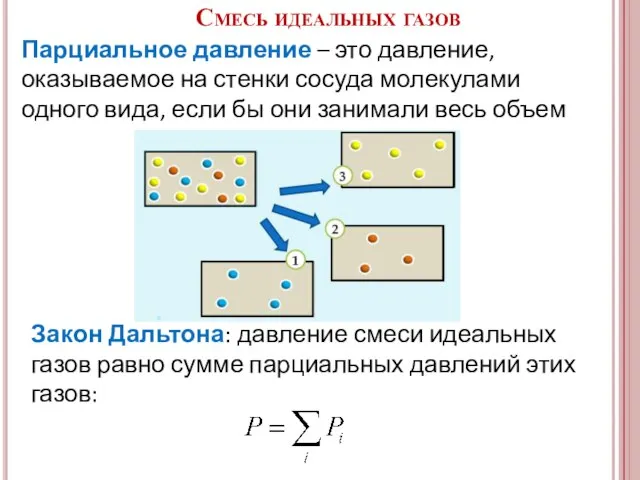
- 8. Парциальное давление – это давление, оказываемое на стенки сосуда молекулами одного вида, если бы они занимали
- 9. – масса одной молекулы – уравнение Клаузиуса – основное уравнение МКТ идеальных газов Давление идеального газа
- 10. T = t 0С + 273,15 1oС = 1 К [К] - средняя кинетическая энергия поступательного
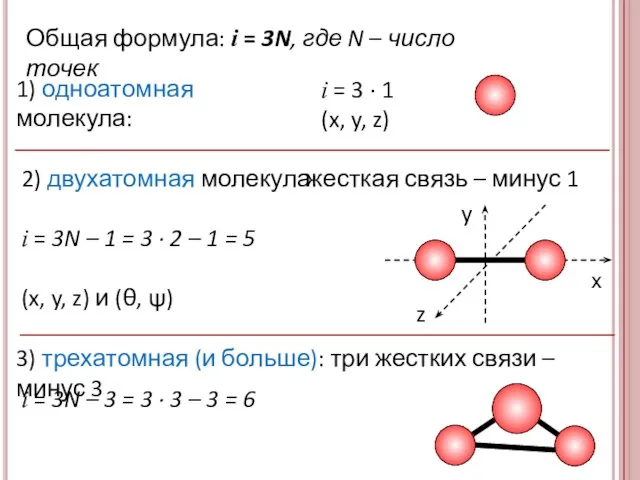
- 11. степени свободы молекулы Степени свободы – число координат, определяющие положение тела в пространстве Материальная точка i
- 12. 1) одноатомная молекула: х y z i = 3 · 1 (x, y, z) i =
- 13. - средняя кинетическая энергия молекулы i - число степеней свободы Средняя кинетическая энергия, приходящаяся при тепловом
- 15. Скачать презентацию






![T = t 0С + 273,15 1oС = 1 К [К] -](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/883724/slide-9.jpg)


 Электрическое сопротивление. Удельное сопротивление
Электрическое сопротивление. Удельное сопротивление Эвольвента. Лекции 9
Эвольвента. Лекции 9 Параметры и виды передающих оптических модулей
Параметры и виды передающих оптических модулей Ультразвуковой контроль (УЗК). Методы и оборудование УЗД
Ультразвуковой контроль (УЗК). Методы и оборудование УЗД Механическое движение
Механическое движение Испарение. Насыщенный пар и его свойства. Влажность воздуха
Испарение. Насыщенный пар и его свойства. Влажность воздуха Теоретическая механика модуль 1. Раздел 2 – кинематика
Теоретическая механика модуль 1. Раздел 2 – кинематика Преобразования сигналов и Вейвлет-преобразование
Преобразования сигналов и Вейвлет-преобразование Ядерные силы. Дефект масс. Энергия связи
Ядерные силы. Дефект масс. Энергия связи Professional english for mechanics
Professional english for mechanics Развитие познавательного интереса к предмету физика
Развитие познавательного интереса к предмету физика Показатели надежности электроснабжения
Показатели надежности электроснабжения Оборудование для переработки каучука
Оборудование для переработки каучука Kinematika_tverdogo_tela_33__33__33
Kinematika_tverdogo_tela_33__33__33 Характеристика волн. Величины, характеризующие волну
Характеристика волн. Величины, характеризующие волну Методика организации и проведения лабораторного практикума по физике в современной школе
Методика организации и проведения лабораторного практикума по физике в современной школе Электрические цепи
Электрические цепи lek2 _кинем
lek2 _кинем Нелинейные СКВИД метаматериалы
Нелинейные СКВИД метаматериалы Строения атомов
Строения атомов Стенд для лабораторных работ Зубчатые передачи
Стенд для лабораторных работ Зубчатые передачи Какие бывают машины
Какие бывают машины Тепловые двигатели
Тепловые двигатели Игра для семиклассников Физика и мы
Игра для семиклассников Физика и мы Буровые машины для открытых горных пород. Лекция 8
Буровые машины для открытых горных пород. Лекция 8 масс-1
масс-1 Высота. Тембр и громкость звука
Высота. Тембр и громкость звука Touareg CR. Замена шаровой несущего рычага на автомобиле с пневмоподвеской
Touareg CR. Замена шаровой несущего рычага на автомобиле с пневмоподвеской