Слайд 3Зависимость скорости химической реакции
от концентрации реагентов

Слайд 5Константа скорости
Не зависит от концентраций реагентов, но зависит от природы реагентов, направления

реакции (природы продуктов), от температуры и катализатора.
Методы определения порядка реакции:
1) Метод подстановки.
Основан на подстановке экспериментальных данных в какое-либо из известных уравнений реакции нулевого, 1го и 2го порядков. Правильность выбора уравнения определяется по тому, как хорошо сохраняется k, вычисленная по уравнению соответствующего порядка. Постоянные значения k в пределах ошибок эксперимента свидетельствуют о правильности выбора уравнения.
Слайд 7Особенности кинетики гетерогенных процессов

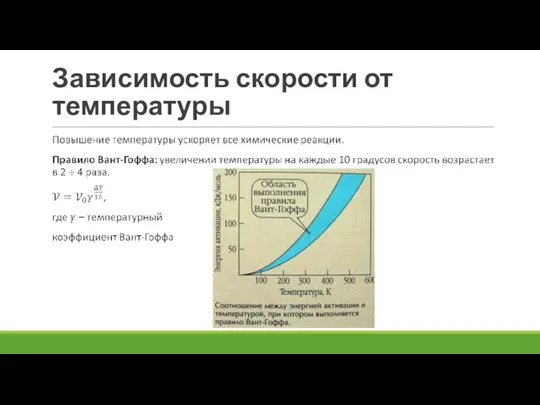
Слайд 8Зависимость скорости от температуры
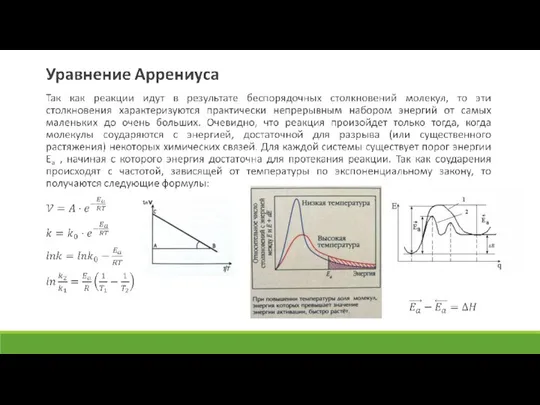
Слайд 10Катализ
Катализатор − вещество, которое многократно участвует в промежуточных стадиях реакции, но выходит

из нее химически неизменным.
Каталитические реакции классифицируются по типу катализаторов и по типу реакций:
1) одностадийный и многостадийный;
2) по агрегатному состоянию: гомогенный и гетерогенный;
3) окислительно-восстановительный;
4) кислотно-основный;
5) ферментативный.
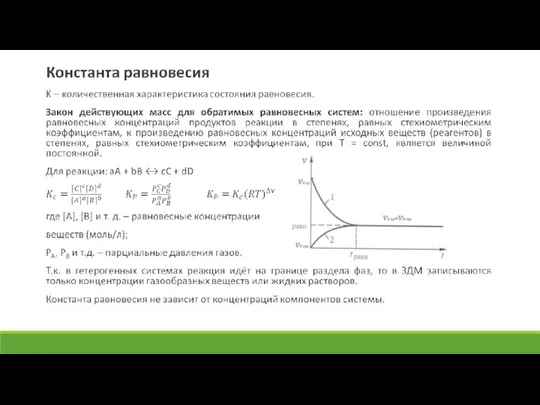
Слайд 12Химическое равновесие
Химические реакции могут быть практически необратимыми и совершенно необратимыми. Необратимости способствуют

такие условия, при которых один из продуктов является малорастворимым и выпадает в осадок, либо образуется в виде газообразного вещества, удаляемого из системы, либо является слабодиссоциирующим в реакционной среде веществом.
Химическим равновесием называют не изменяющееся во времени при постоянном давлении, объеме и температуре (Р,Т=const) состояние системы, содержащей вещества, способные к взаимодействию.
Равновесие бывает:
1) Кажущееся (метастабильное, заторможенное),
2) Истинное (устойчивое, термодинамическое). Является динамическим, т.к. равновесное состояние сохраняется во времени не вследствие отсутствия или прекращения процесса, а вследствие протекания его одновременно в двух противоположных направлениях с одинаковой скоростью.
Слайд 14Смещение равновесия, принцип Ле-Шателье
Если на систему, находящуюся в равновесии, подействовать извне, то

равновесие смещается в том направлении, которое ослабляет это воздействие.
1) Воздействие температуры.
При повышении температуры равновесие смещается в направлении реакции, идущей с поглощением теплоты (т.е. эндотермической, ΔH > 0). При понижении – в сторону экзотермической реакции.
2) Воздействие давления.
Давление смещает равновесие в случае неравенства количества газообразных реагентов и продуктов. При повышении давления равновесие смещается в направлении процесса, идущего с уменьшением объема (уменьшения числа моль газа). При уменьшении внешнего давления – в сторону большего объёма.
3) Изменение концентраций компонентов.
При добавлении в систему какого-либо из компонентов реакции равновесие смещается в направлении реакции, в результате которой это вещество расходуется, т.е. его концентрация уменьшается. При удалении компонента из системы – в направлении того процесса, в результате которого образуется дополнительное количество этого вещества.











 Электрическое сопротивление проводников. Единицы сопротивления. Закон Ома для участка цепи
Электрическое сопротивление проводников. Единицы сопротивления. Закон Ома для участка цепи Топографические и лучевые векторные диаграммы
Топографические и лучевые векторные диаграммы Изменение агрегатных состояний вещества
Изменение агрегатных состояний вещества Измерение мощности и работы тока в электрической лампе. Лабораторная работа
Измерение мощности и работы тока в электрической лампе. Лабораторная работа Электродинамика. Электрическое поле. Магнитное поле
Электродинамика. Электрическое поле. Магнитное поле Путь и перемещение
Путь и перемещение силы
силы Электроосветительные приборы. Лампы накаливания и регулировка освещенности
Электроосветительные приборы. Лампы накаливания и регулировка освещенности Барометр-анероид. Атмосферное давление на различных высотах. Физика 7 класс
Барометр-анероид. Атмосферное давление на различных высотах. Физика 7 класс Электронные фильтры
Электронные фильтры History. Классикалық механиканың негізгін қалаған ғалым
History. Классикалық механиканың негізгін қалаған ғалым Электромагниттік құралдарының жұмыс істеу приниципін талдау
Электромагниттік құралдарының жұмыс істеу приниципін талдау Упругие свойства среды. Лекция 1.13
Упругие свойства среды. Лекция 1.13 Решение задач по теме; Законы сохранения
Решение задач по теме; Законы сохранения Направление индукционного тока
Направление индукционного тока Тангенциальное и нормальное ускорение при движении по криволинейной траектории
Тангенциальное и нормальное ускорение при движении по криволинейной траектории Закон сохранения импульса
Закон сохранения импульса Датчики термоанемометров
Датчики термоанемометров Гибридизация атомных орбиталей
Гибридизация атомных орбиталей Расчет пути и времени движения
Расчет пути и времени движения Определение расстояния до недоступной точки
Определение расстояния до недоступной точки Тепловые явления
Тепловые явления Реактивные самолёты
Реактивные самолёты 840842
840842 Динамика. Экзаменационные задачи 1-14
Динамика. Экзаменационные задачи 1-14 Радиоактивность в жизни современного человека, значения ядерной энергетики
Радиоактивность в жизни современного человека, значения ядерной энергетики Перепад давления
Перепад давления Электромагнитная природа света. Электромагнитные явления
Электромагнитная природа света. Электромагнитные явления