Содержание
- 2. Макроскопические тела- тела состоящие из большого числа молекул Статистический метод – основан на том, что св-ва
- 3. Молекулярно-кинетическая теория Вещество состоит из мельчайших частиц (атомов или молекул) Частицы в-ва находятся в непрерывном хаотическом
- 4. Fпр Fот F Засисимость силы взаимодействия от расстояния r > r0 – силы притяжения r r
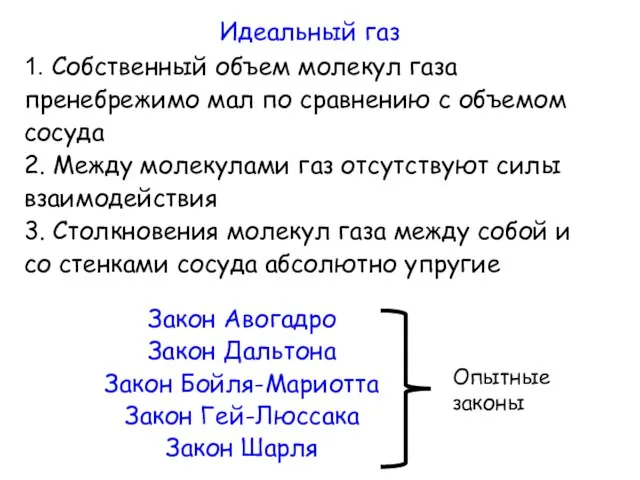
- 5. Идеальный газ 1. Собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда 2. Между
- 6. Закон Авогадро – моли любых газов при одинаковых T и P занимают одинаковый объем При нормальных
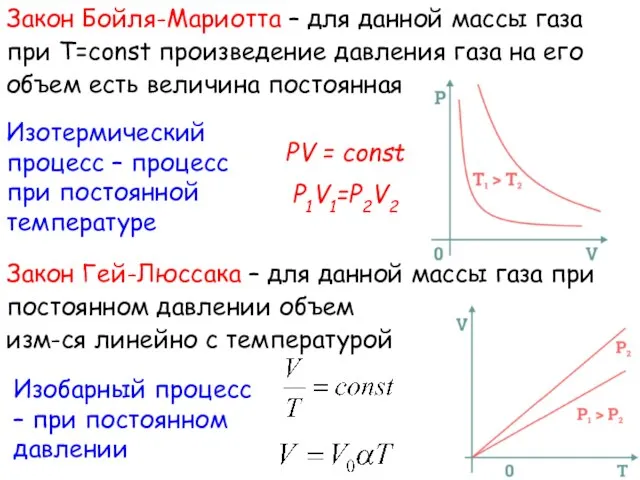
- 7. Закон Бойля-Мариотта – для данной массы газа при Т=const произведение давления газа на его объем есть
- 8. Закон Шарля – давление данной массы при постоянном давлении изм-ся линейно с Т. Процесс изохорный –
- 9. При нормальных условиях Газовая постоянная M – Vm m - V Для произвольного объема V массой
- 10. Постоянная Больцмана k = 1.38•10-23 Дж/К Концентрация – число молекул в единице объема Уравнение Менделеева-Клайперона Давление
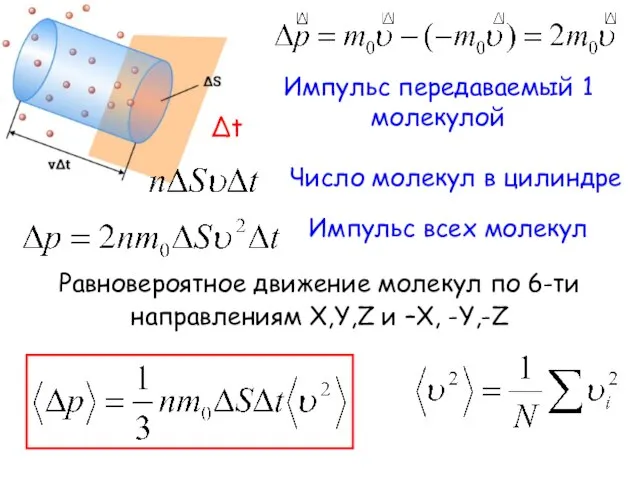
- 11. Импульс передаваемый 1 молекулой Δt Число молекул в цилиндре Импульс всех молекул Равновероятное движение молекул по
- 12. Сила давления на стенку сосуда Делим на площадь Основное уравнение МКТ Среднее зн-ние кинет. энергии поступ.
- 13. Для данного газа средняя квад-ная скорость зависит только от температуры Статистическая хар-ка!!!!! Δυ → В каждом
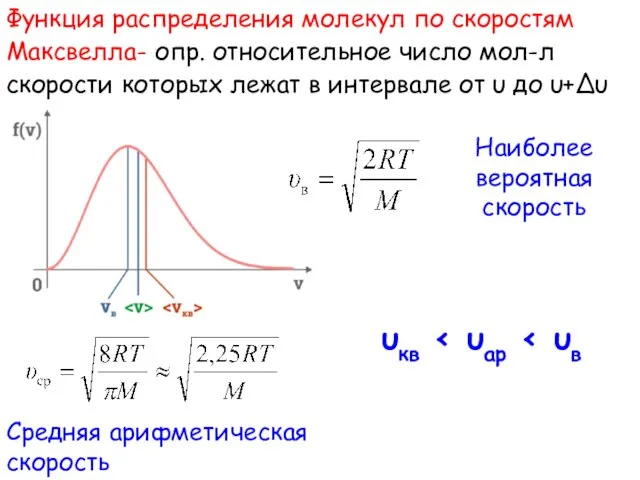
- 14. Функция распределения молекул по скоростям Максвелла- опр. относительное число мол-л скорости которых лежат в интервале от
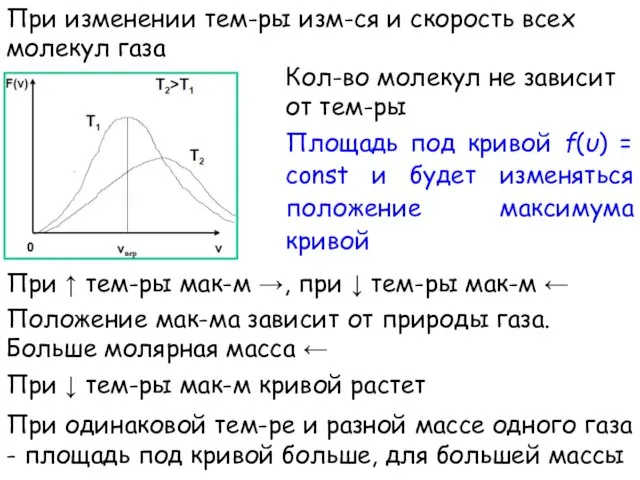
- 15. При изменении тем-ры изм-ся и скорость всех молекул газа Площадь под кривой f(υ) = const и
- 16. P убывает с высотой тем быстрее, чем тяжелее газ Обозначим P1 = P0 и h1=h0 ,
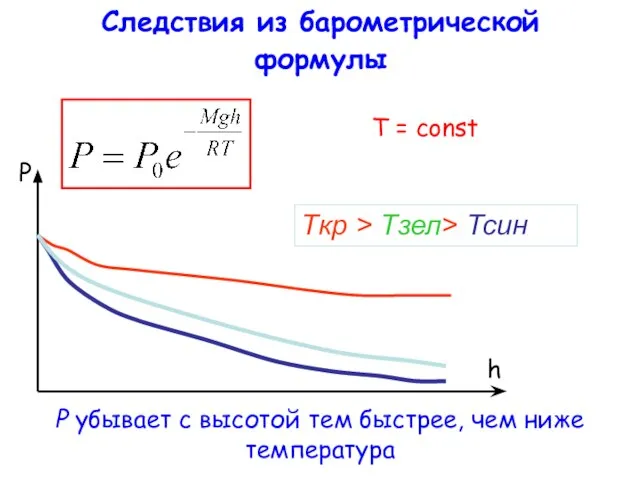
- 17. Следствия из барометрической формулы Tкр > Tзел> Тсин T = const P убывает с высотой тем
- 19. Скачать презентацию










 Выталкивающая сила. Закон Архимеда
Выталкивающая сила. Закон Архимеда Измерение скоростей продольных волн в образцах методом прямого просвечивания
Измерение скоростей продольных волн в образцах методом прямого просвечивания Теория парамагнетизма
Теория парамагнетизма Использование данных лазерного сканирования для мониторинга состояния ВПП аэропорта
Использование данных лазерного сканирования для мониторинга состояния ВПП аэропорта Деятельность и достижения Галилео Галилея в механике
Деятельность и достижения Галилео Галилея в механике Задачи 14, 15. Теплопроводность плоской стенки
Задачи 14, 15. Теплопроводность плоской стенки Матрицы и действия над ними
Матрицы и действия над ними Электромагниты и их применение
Электромагниты и их применение Комплексная механизация лесовосстановительных работ в Огудневском участковом лесничестве
Комплексная механизация лесовосстановительных работ в Огудневском участковом лесничестве Движение и силы
Движение и силы Подъемные механизмы
Подъемные механизмы Объекты оценивания профессиональной компетенции
Объекты оценивания профессиональной компетенции Механические колебания. Колебательные движения
Механические колебания. Колебательные движения Муфты приводов. Виды муфт
Муфты приводов. Виды муфт Презентация по физике "В мире электромагнетизма" -
Презентация по физике "В мире электромагнетизма" -  Конструкторско-технологическое обеспечение машиностроительных производств профиль технология машиностроения
Конструкторско-технологическое обеспечение машиностроительных производств профиль технология машиностроения Колебания. Пример выполнения домашнего задания
Колебания. Пример выполнения домашнего задания Физический брейн-ринг
Физический брейн-ринг Самокат. AM05787. Описание изменений ONR 20200213
Самокат. AM05787. Описание изменений ONR 20200213 Итоговая контрольная работа
Итоговая контрольная работа Автомобильные аккумуляторные батареи
Автомобильные аккумуляторные батареи Теплоносители и их свойства. Цикл Ренкина. Другие циклы ПТУ. (Тема 7)
Теплоносители и их свойства. Цикл Ренкина. Другие циклы ПТУ. (Тема 7) Какие бывают часы
Какие бывают часы Нобелевская премия. Физика и религия. Высшая цель физика
Нобелевская премия. Физика и религия. Высшая цель физика Магнитное поле. Действие магнитного поля на проводник с током
Магнитное поле. Действие магнитного поля на проводник с током Применение электромагнитной индукции
Применение электромагнитной индукции Развитие взглядов на строение вещества
Развитие взглядов на строение вещества Дифракция. Дифракционная решетка
Дифракция. Дифракционная решетка