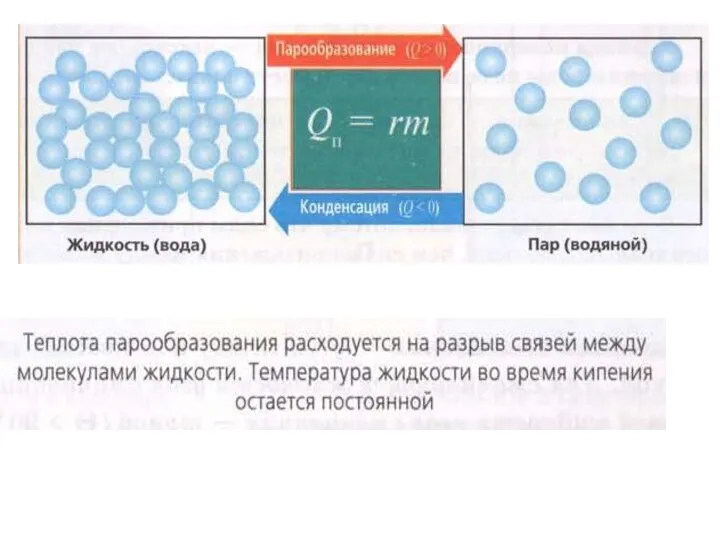
Слайд 3Кипение -
парообразование, происходящее по всему объему жидкости при определенной температуре
Температура кипения зависит

от рода жидкости и внешнего давления
Слайд 4Конденсация -
- явление превращения пара в жидкость
При конденсации пара энергия

выделяется
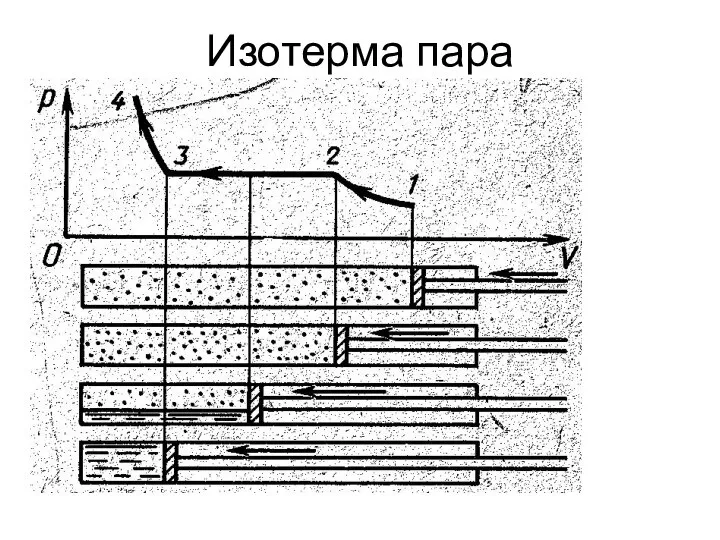
Слайд 6Пар , находящийся в динамическом равновесии со своей жидкостью, называется насыщенным
Если над

жидкостью насыщенный пар, то скорость испарения равна скорости конденсации
Если скорость испарения выше скорости конденсации, то пар называют ненасыщенным
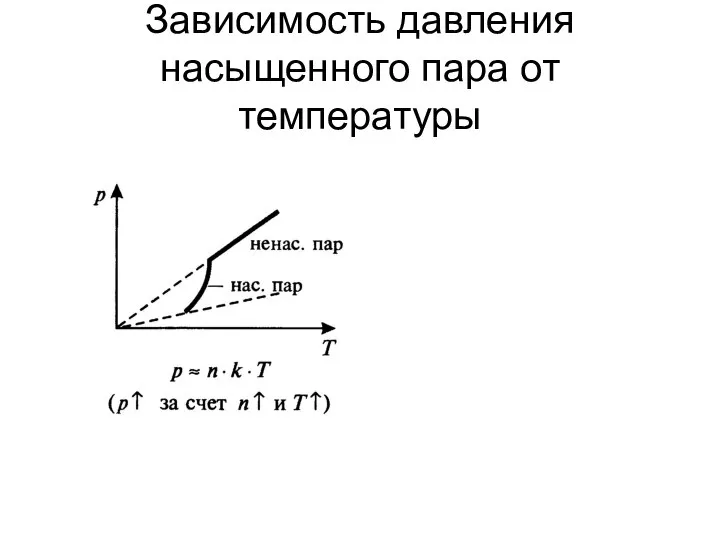
Слайд 7Зависимость давления насыщенного пара от температуры
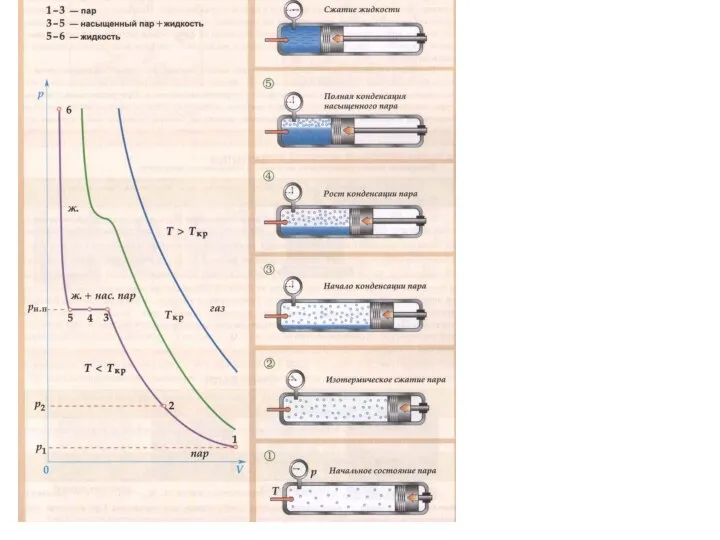
Слайд 8Модель идеального газа не предполагает превращения газа в жидкость при постоянной температуре.

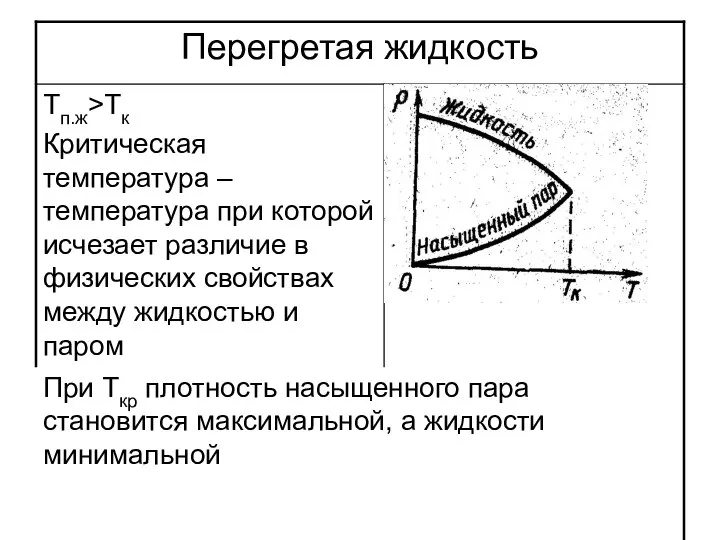
Однако, реальные газы, в которых взаимодействием между молекулами пренебречь нельзя, способны при изменении давления превращаться в жидкость, если их температура ниже некоторой критической Tкр.
Слайд 11Изотермы реального газа. Область I – жидкость, область II – двухфазная система
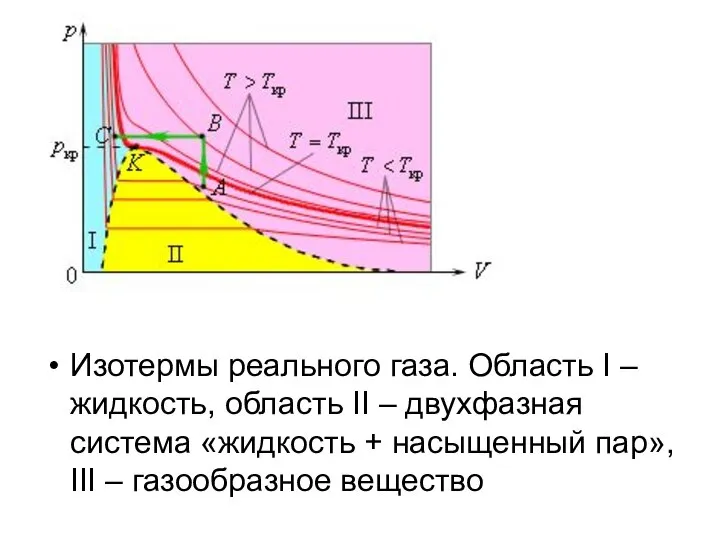
«жидкость + насыщенный пар», III – газообразное вещество
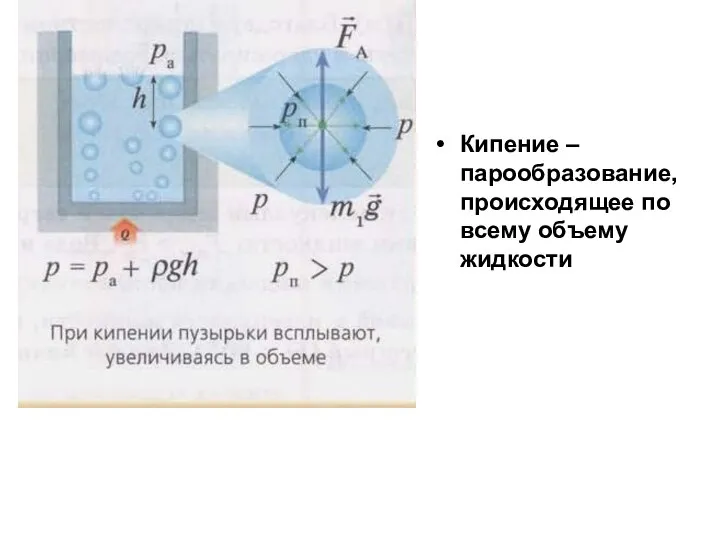
Слайд 13Кипение – парообразование, происходящее по всему объему жидкости
Слайд 14Кипение жидкости начинается при такой температуре, при которой давление ее насыщенных паров
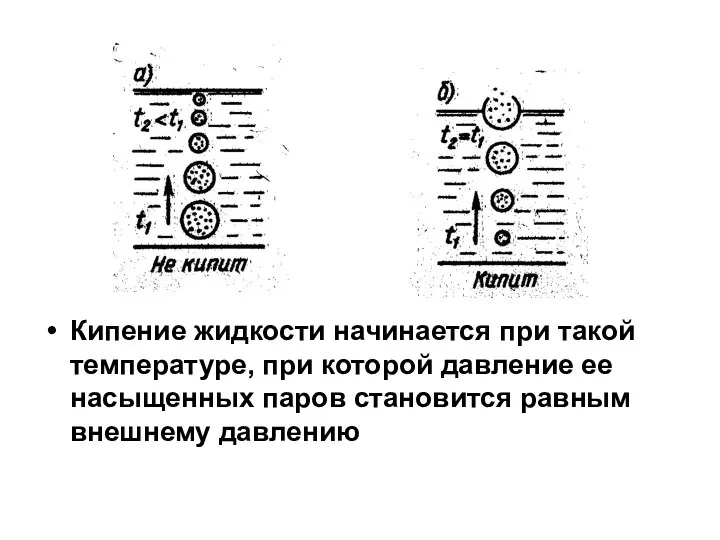
становится равным внешнему давлению
Слайд 16В частности, при нормальном атмосферном давлении вода кипит при температуре 100 °С. Это

значит, что при такой температуре давление насыщенных паров воды равно 1 атм
При подъеме в горы атмосферное давление уменьшается, и поэтому температура кипения воды понижается (приблизительно на 1 °С на каждые 300 метров высоты). На высоте 7 км давление составляет примерно 0,4 атм, и температура кипения понижается до 70 °С.
Слайд 19С ростом температуры уменьшается удельная теплота парообразования L, а при критической она

равна 0
Если температура выше критической, то газ нельзя превратить в жидкость при любом давлении
Газ превращается в жидкость если Т<Ткр и повышается давление
Слайд 20При заданной температуре T термодинамическое равновесие между двумя фазами одного и того
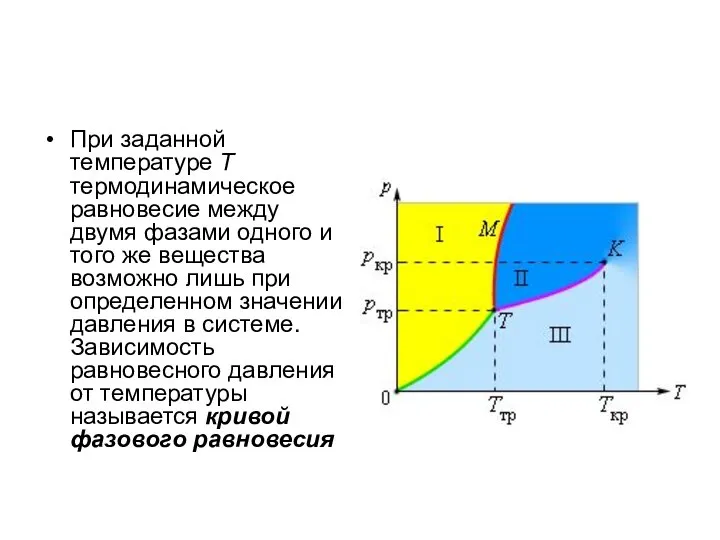
же вещества возможно лишь при определенном значении давления в системе. Зависимость равновесного давления от температуры называется кривой фазового равновесия
Слайд 21Кривая 0T, соответствующая равновесию между твердой и газообразной фазами, называется кривой сублимации.

Кривая TK равновесия между жидкостью и паром называется кривой испарения, она обрывается в критической точке K. Кривая TM равновесия между твердым телом и жидкостью называется кривой плавления.
Кривые равновесия сходятся в точке T, в которой могут сосуществовать в равновесии все три фазы. Эта точка называется тройной точкой.















 Относительность движения
Относительность движения Презентация на тему Влияние радиоактивного излучения на живые организмы
Презентация на тему Влияние радиоактивного излучения на живые организмы  Мощность. Единицы мощности
Мощность. Единицы мощности Силикаты. Физические свойства
Силикаты. Физические свойства Кинематика жидкости
Кинематика жидкости Физика – это наука о природе
Физика – это наука о природе Дви́гатель вну́треннего сгора́ния (ДВС)
Дви́гатель вну́треннего сгора́ния (ДВС) Обзор способов получения диоксида титана
Обзор способов получения диоксида титана Анализ видов и кинематических параметров движений
Анализ видов и кинематических параметров движений Солнечное излучение как совокупность ресурсов
Солнечное излучение как совокупность ресурсов Биологическое действие радиации
Биологическое действие радиации Самолётные ответчики. Самолётный ответчик СО-69
Самолётные ответчики. Самолётный ответчик СО-69 Последовательное соединение проводников. 8 класс
Последовательное соединение проводников. 8 класс Момент силы относительно точки
Момент силы относительно точки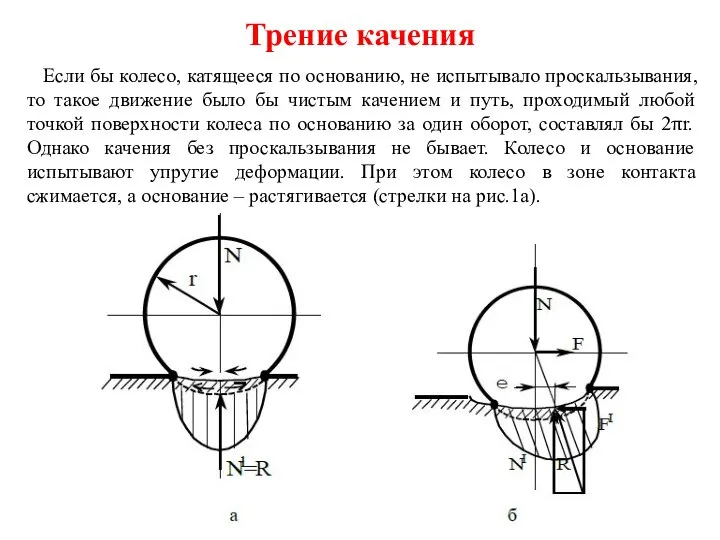 Трение качения
Трение качения Квантовая радиофизика
Квантовая радиофизика ИГЭС2 семестр Колебания лекция 1
ИГЭС2 семестр Колебания лекция 1 Транспортная задача для маршрутизации перевозок
Транспортная задача для маршрутизации перевозок Радиосвязь. Установка опытов Г. Герца. Простейший радиоприемник
Радиосвязь. Установка опытов Г. Герца. Простейший радиоприемник Электрические цепи переменного тока. Практическое занятие №1
Электрические цепи переменного тока. Практическое занятие №1 Матрицы плотности
Матрицы плотности Виды энергии
Виды энергии Электронный нос или что может заменить нос собаки
Электронный нос или что может заменить нос собаки Действие магнитного поля на проводник с током и движущийся заряд
Действие магнитного поля на проводник с током и движущийся заряд Сила Лоренца
Сила Лоренца Звуковые волны
Звуковые волны Звуковые волны
Звуковые волны Источники света. Распространение света. Отражение света
Источники света. Распространение света. Отражение света