Содержание
- 2. Углы падения и отражения светового потока равны между собой. Величина угла преломления связана с величиной угла
- 3. Показатель преломления является характеристической величиной для каждой среды, зависящей в первую очередь от ее состава, но
- 4. Наибольшее влияние на величину показателя преломления любых веществ оказывают примеси. В случае смесей двух и более
- 5. Показатель преломления аддитивная величина. Для смесей газов (при постоянном объеме) аддитивность показателей преломления соблюдается с очень
- 6. Рефрактометрические методы анализа. Показатель преломления является важным характеристическим свойством химических соединений. В справочной литературе накоплено большое
- 7. Концентрацию примеси можно найти по уравнению: где n и no –значения показателей преломления для анализируемого образца
- 8. Из приведенных уравнений следует, что чувствительность рефрактометрического метода зависит от разности показателей преломления основного компонента и
- 9. Если кривые «концентрация примеси - показатель преломления» имеют экстремум или значительную кривизну, то чувствительность рефрактометрического анализа
- 10. Рефрактометрический анализ проводится с применением специально приготавливаемых стандартных образцов, идентичных по качественному составу анализируемому образцу. Требования
- 11. Контроль чистоты веществ по величине показателя преломления, измеренного при определенной длине волны, не всегда обладает достаточной
- 12. Значение D является более характеристическими для веществ, чем n, измеренный при одной длине волны. Их использование
- 13. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА 1. СКОРОСТЬ ХИМИЧЕСКИХ РЕАКЦИЙ, КАК НОСИТЕЛЬ АНАЛИТИЧЕСКОЙ ИНФОРМАЦИИ. КИНЕТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Скорость любой
- 14. ПРОБЛЕМЫ.Как от представленных зависимостей перейти к методам анализа? Большинство реакций в растворах протекают практически мгновенно. Этот
- 15. d[AB]/dt = k ([Ao] - [AB])([Bo] - [AB]) (6) Скорость реакции определяется по приросту конечного продукта
- 16. Целый ряд медленно протекающих реакций, в первую очередь, окислительно-восстановительных, могут катализироваться ионами переходных металлов. В присутствии
- 17. Использованию уравнения (10) для аналитических целей по той же схеме, как и в некаталитических реакциях препятствует
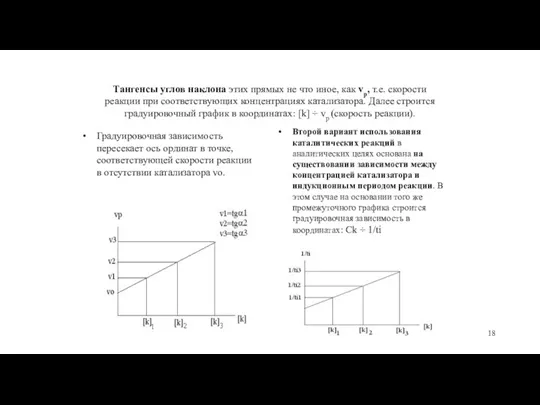
- 18. Тангенсы углов наклона этих прямых не что иное, как vр, т.е. скорости реакции при соответствующих концентрациях
- 19. Главное достоинство кинетического метода, основанного на использовании каталитических реакций – рекордно низкие для относительно простых методов
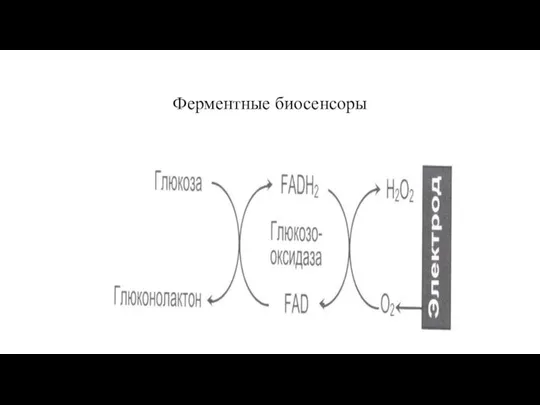
- 20. Ферментные биосенсоры
- 21. Уравнение Михаэлиса-Ментен
- 22. АНАЛИТИЧЕСКАЯ ИНФОРМАЦИЯ, ПОЛУЧАЕМАЯ ИЗ НАБЛЮДЕНИЙ ЗА ПРОЦЕССАМИ ВЫДЕЛЕНИЯ ИЛИ ПОГЛОЩЕНИЯ ТЕПЛА ПРИ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ ВЕЩЕСТВ. ТЕРМИЧЕСКИЕ
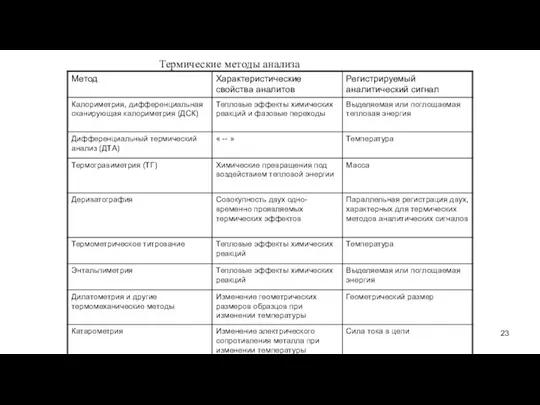
- 23. Термические методы анализа
- 24. Калориметрия. Основные предпосылки. Δ Нр = Σ Δ Нокон. - Σ Δ Нонач., где Δ Нокон.
- 25. Из пропорции: М - ΔНМ х - ΔНр где М - молярная масса, ΔНМ - мольная
- 26. В варианте ДСК аналитический процесс осуществляется в теплопроводящем калориметре с двумя взаимоизолированными ячейками, снабженными средствами независимого
- 27. С помощью независимых нагревателей, функционирующих по заданной температурной программе, поддерживается равенство температур пробы и эталона, т.е.
- 28. В качестве иллюстрации информативности метода на рис.2.2 приведен пример его использования для определения компонентного состава столь
- 29. Из других областей применения ДСК можно отметить контроль чистоты препаратов в фармацевтической промышленности. Определение степени чистоты
- 30. Дифференциальный термический анализ (ДТА) 1- сосуд с анализируемым веществом 2 - сосуд со образцом сравнения, имеющим
- 31. Дифференциальный термический анализ (ДТА) Схема ДТА представлена на рис. 2.4.
- 32. Результаты ДТА представляют в форме зависимостей ΔT от T (Рис.2.5.) К ОС, применяемым в ДТА, предъявляются
- 33. Учитывая отсутствие термических превращений в образце сравнения по условию постановки эксперимента, каждый экстремум на кривой ДТА,
- 34. Термогравиметрия В методе термогравиметрии (ТГ) аналитическим сигналом о химических превращениях, происходящих в анализируемом образце, является его
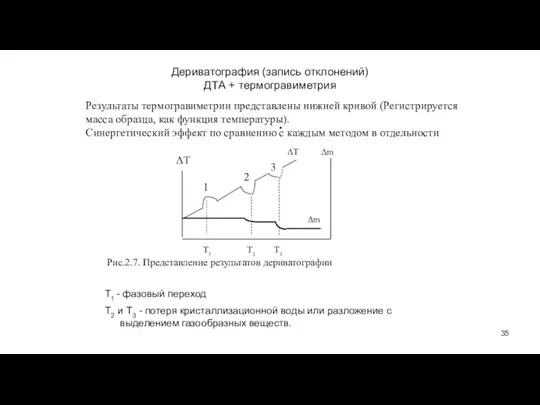
- 35. Дериватография (запись отклонений) ДТА + термогравиметрия ΔT Т1 - фазовый переход Т2 и Т3 - потеря
- 36. Термометрическое титрование : Бюретка с титрантом Эффект изменения энтальпии системы в результате протекания реакции в растворе
- 37. Для регистрации кривых термометрического титрования необходимы крайне чувствительные термодатчики, обеспечивающие регистрацию температуры с точностью до 1.10-4
- 38. Энтальпиметрия. Прямая инжекционная энтальпиметрия Схема эксперимента (рис.2.10): Метод энтальпиметрии по своим физико-химическим принципам близок к методу
- 39. ΔT = T2 - T1 ΔT = CxVx ΔHМ/K, откуда Сx = ΔT.K/Vx.ΔHM, где Cx –молярная
- 40. Дилатометрия Метод, основанный на измерении линейных или объемных размеров образца, как функции температуры: Δ l=α ΔT
- 41. Катарометрия Регистрация изменения состава газовой смеси по результатам измерения силы тока в цепи в специальных ячейках
- 42. АНАЛИТИЧЕСКАЯ ИНФОРМАЦИЯ, ПОЛУЧАЕМАЯ ИЗ НАБЛЮДЕНИЙ ЗА ПРОЦЕССАМИ ВЫДЕЛЕНИЯ ИЛИ ПОГЛОЩЕНИЯ ТЕПЛА ПРИ ХИМИЧЕСКИХ ПРЕВРАЩЕНИЯХ ВЕЩЕСТВ. ТЕРМОХИМИЧЕСКИЕ
- 43. Из пропорции: μ - ΔНμ х - ΔНр где μ - молярная масса, ΔНμ - мольная
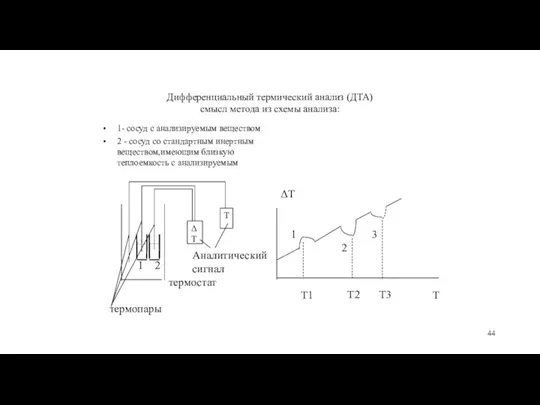
- 44. Дифференциальный термический анализ (ДТА) смысл метода из схемы анализа: 1- сосуд с анализируемым веществом 2 -
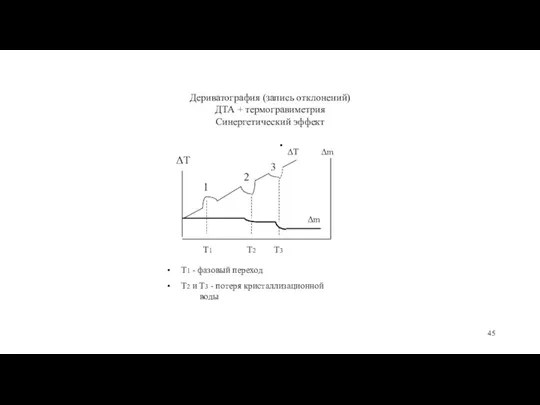
- 45. Дериватография (запись отклонений) ДТА + термогравиметрия Синергетический эффект ΔT Т1 - фазовый переход Т2 и Т3
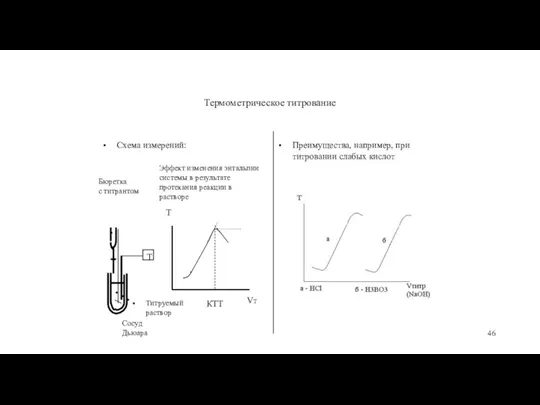
- 46. Термометрическое титрование Схема измерений: Бюретка с титрантом Эффект изменения энтальпии системы в результате протекания реакции в
- 47. Энтальпиметрия. Прямая инжекционная энтальпиметрия Схема эксперимента: в адиабатических условиях в сосуд с анализируемым раствором вводится избыток
- 49. Скачать презентацию













![d[AB]/dt = k ([Ao] - [AB])([Bo] - [AB]) (6) Скорость реакции определяется](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1081757/slide-14.jpg)

























 Паровая турбина. КПД
Паровая турбина. КПД Охранная сигнализация
Охранная сигнализация Принцип Гюйгенса в виде формулы Кирхгофа
Принцип Гюйгенса в виде формулы Кирхгофа Магнитное поле тока. Вектор магнитной индукции
Магнитное поле тока. Вектор магнитной индукции Формирование понятия энергия
Формирование понятия энергия Переменный электрический ток
Переменный электрический ток Свободное падение тел, ускорение свободного падения
Свободное падение тел, ускорение свободного падения Потужність
Потужність Итоговая контрольная работа
Итоговая контрольная работа Презентация на тему Сила трения скольжения
Презентация на тему Сила трения скольжения  Исследование электрического поля с помощью электрической ванны
Исследование электрического поля с помощью электрической ванны Навозоудаление
Навозоудаление Молекулярная физика. Ученые и их открытия
Молекулярная физика. Ученые и их открытия Две дельта - функционные ямы в импульсном представлении
Две дельта - функционные ямы в импульсном представлении Презентация на тему Звуковые волны (9 класс)
Презентация на тему Звуковые волны (9 класс)  Физика в белом халате
Физика в белом халате Состав атомного ядра
Состав атомного ядра Плотность вещества
Плотность вещества Общий курс железных дорог. ОКЖД. Лекция 1
Общий курс железных дорог. ОКЖД. Лекция 1 Электротехника и электроника. Анализ и расчет переходных процессов в электрических цепях
Электротехника и электроника. Анализ и расчет переходных процессов в электрических цепях Магнітні бурі та аномалії
Магнітні бурі та аномалії Тангенс угла диэлектрических потерь, измерение показателя диэлектрических потерь
Тангенс угла диэлектрических потерь, измерение показателя диэлектрических потерь Волновые явления. Занимательная физика. 4 класс
Волновые явления. Занимательная физика. 4 класс Прямолинейное равномерное и прямолинейное равноускоренное движения
Прямолинейное равномерное и прямолинейное равноускоренное движения Оптическая иллюзия
Оптическая иллюзия Тезаурус
Тезаурус Как уменьшить силу трения
Как уменьшить силу трения Линзы
Линзы