Содержание
- 2. Ян Баптист ван Гельмонт 12 января 1580, Брюссель, Брюссель — 30 декабря 1644, Вилворде, Вилворде, Бельгия)
- 3. Дмитрий Иванович Менделеев (27 января (8 февраля) 1834, Тобольск — 20 января (2 февраля) 1907, Санкт-Петербург)
- 4. Бенуа́ Поль Эми́ль Клапейро́н (26 февраля 1799, Париж — 28 января 1864 Париж) — французский физик
- 5. Уравнение Менделеева-Клапейрона . .
- 6. Нормальные условия Давление р=760мм.рт.ст.=1атм=105Па Температура t=00С (Т=273,150К) 1 моль=22,4 л 1мм.рт.ст.=133 Па
- 7. Задача 1. Рассчитайте массу и объем сернистого газа SO2 количеством вещества 0,8 моль.
- 8. Дано: n(SO2)=0,8 моль Найти: m-?,V-? Решение: M(SO2)=32+2*16=64г/моль; m=n*M ; m=0.8 моль*64г/моль = 51,2г V=n*Vm; V= 0.8
- 9. Задача 2. При температуре 170С и давлении 780 мм.рт.ст. масса газа равна 1,56 г занимает объем
- 10. Дано: t = 170C +273 = 2900K P=780 мм.рт.ст.* 133,3 = 1,03* 105Па m = 1,56г
- 11. Задача 3. Какой объем дихлорэтана ClCH2CH2Cl получится при смешивании 5л хлора Cl2 и 5л этилена CH2=CH2
- 12. Дано: V(Cl2) =5л; V(CH2=CH2) =5л р = 105Па; Т=2730К Найти: V (ClCH2CH2Cl)-? Решение: Cl2 + CH2=СН2
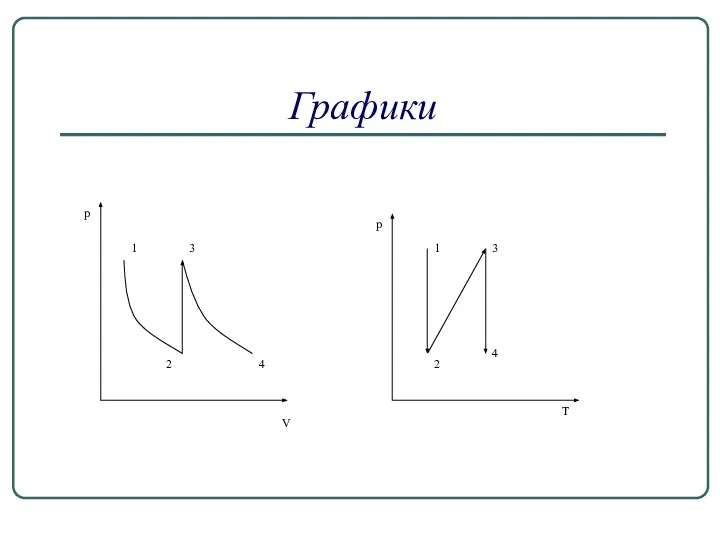
- 13. Задача 4. На рисунке изображены процессы, происходящие с определенной массой идеального газа. Изобразить эти процессы в
- 14. Процесс1-2: T=const, pV=const, при уменьшении p, V увеличивается. Процесс 2-3:V=const, , при увеличении Т, р увеличивается
- 15. Графики
- 16. Домашнее задание
- 18. Скачать презентацию













 Элементы ядерной физики. Лекция16
Элементы ядерной физики. Лекция16 Электрические заряды. Электрические токи
Электрические заряды. Электрические токи Космические скорости
Космические скорости Ферромагнетики, парамагнетики, диамагнетики
Ферромагнетики, парамагнетики, диамагнетики Эффекты квантования чисел в цифровых цепях
Эффекты квантования чисел в цифровых цепях Кинематические характеристики движения
Кинематические характеристики движения Электростатика. Контрольная работа
Электростатика. Контрольная работа Закон сохранения импульса
Закон сохранения импульса Атом. Левкипп. V в. до н.э
Атом. Левкипп. V в. до н.э Перший закон термодинаміки
Перший закон термодинаміки Физические свойства жидкостей
Физические свойства жидкостей Расчёт пути и времени движения. Физика, 7 класс
Расчёт пути и времени движения. Физика, 7 класс Маса. інертність
Маса. інертність 1 начало термодинамики для изопроцессов
1 начало термодинамики для изопроцессов Методы измерения скорости света
Методы измерения скорости света Крышка бензобака
Крышка бензобака Кривошипно-шатунный механизм
Кривошипно-шатунный механизм Презентация на тему Закон всемирного тяготения. Движение планет
Презентация на тему Закон всемирного тяготения. Движение планет  Гёте и Ньютон: спор о цвете
Гёте и Ньютон: спор о цвете Презентация на тему Изопроцессы
Презентация на тему Изопроцессы  Ионизирующие и неионизирующие излучения, их применение в лучевой диагностике и лучевой терапии
Ионизирующие и неионизирующие излучения, их применение в лучевой диагностике и лучевой терапии Презентация на тему Электричество и магнетизм
Презентация на тему Электричество и магнетизм  Вал карданный
Вал карданный Цепи трехфазного тока. Лекция 8-9
Цепи трехфазного тока. Лекция 8-9 Общие сведения о механическом оборудовании. Лекция 1
Общие сведения о механическом оборудовании. Лекция 1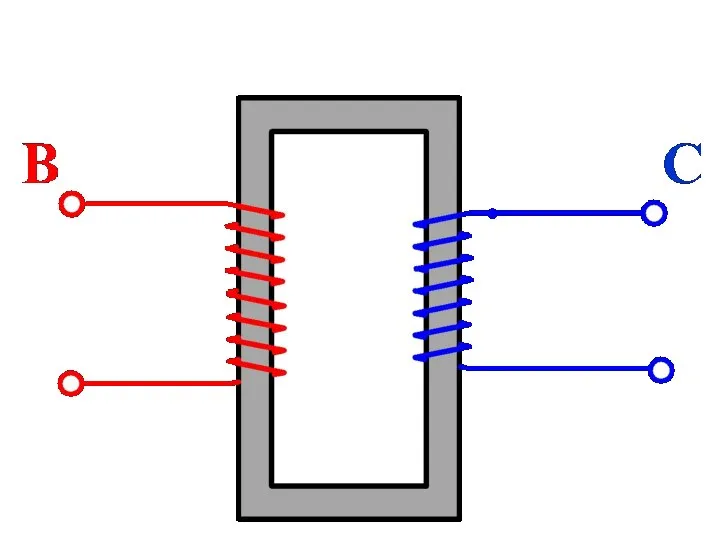 Автотрансформаторы
Автотрансформаторы Рычаг первого рода
Рычаг первого рода Примеры решения задач на цепи с взаимной индукцией. Задачи
Примеры решения задач на цепи с взаимной индукцией. Задачи