Содержание
- 2. Процеси газової корозії багатостадійні і протікають на кордоні розділу фаз метал - газове середовище за такими
- 3. В 1923 р Піллінг і Бедвордс (Pilling and Bedworth) вперше сформулювали умови, або критерій суцільності, що
- 4. Виконання умови суцільності необхідно, але не достатньо для ефективного захисту металу від подальшого окислення. Якщо оксиди
- 5. При утворенні несуцільниої оксидної плівки газоподібний окислювач практично безперешкодно потрапляє до поверхні металу, диффундуючи через пори
- 6. Метал/Сплав оксид h Кисень О-2 Ме+2 В разі, якщо на металі утворюється суцільна оксидная плівка, процес
- 7. При стаціонарної дифузії концентрація дифундують речовини (С) змінюється лінійно по товщині оксидної плівки від концентрації С1
- 8. Після поділу змінних і інтегрування (в момент часу τ = 0 товщина оксидної плівки h =
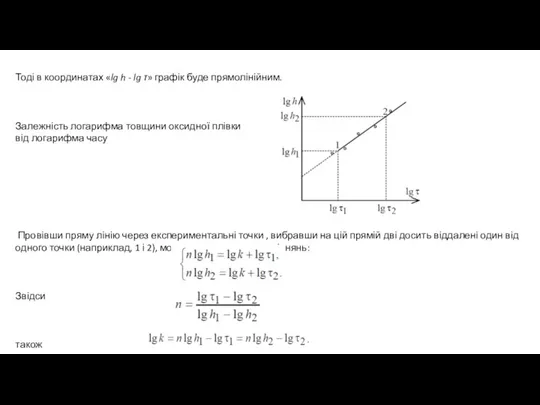
- 9. Тоді в координатах «lg h - lg τ» графік буде прямолінійним. Залежність логарифма товщини оксидної плівки
- 10. Якщо n = 2 - процес корозії йде в дифузійному режимі і швидкість зростання плівки продуктів
- 11. Плівки поділяють на тонкі (до 40 нм), середні (від 40 до 500 нм.) І товсті (понад
- 12. Після досягнення певної товщини плівки на деяких металах починають розтріскуватися, даючи можливість хімічної корозії розвиватися далі.
- 13. а) величина і характер напружень і зовнішніх механічних навантажень; б) міцність і пластичність плівки; в) міцність
- 14. Розтріскування характерно для плівок що мають велику адгезію до металу і порівняно малу міцністю. Цей вид
- 15. Залежність швидкості газової корозії від температури З підвищенням температури швидкість корозії зростає, тому що при цьому
- 16. де Y - показник корозії (Km, Kn і ін.) за τ = 1. Після логарифмування рівняння
- 17. Значення ефективної енергії активації в кожному температурному діапазоні можна визначити, підставивши координати двох точок, що належать
- 18. Печі для дослідження високотемпературної корозії в газових сумішах Зразки після окислення пічь Блок підготовки газів Блок
- 19. Принципова схема Термоваги для дослідження високотемпературної корозії
- 20. Зразок після окислення Термоваги для дослідження високотемпературної корозії Блок підготовки газів пічь Блок контролю температури
- 21. Зразоки після окислення Печі для дослідження високотемпературної корозії в умовах термічних циклів Блок підготовки газів
- 22. Печі для дослідження високотемпературної корозії в водяному парі
- 23. Обладнання для дослідження високотемпературної газової корозії тонких зразків
- 24. Temperaturen bis 1200°C Versuche mit 18O2 - , 15N2 - and D2 - Tracern. Обладнання для
- 25. Обладнання для дослідження електропровідності окисних плівок
- 26. Обладнання для дослідження високотемпературної газової корозії під напруною
- 27. Виготовлення шліфів
- 28. Оптична мікроскопія (Механічна поліровка) Електронна мікроскопія (йонна поліровка)
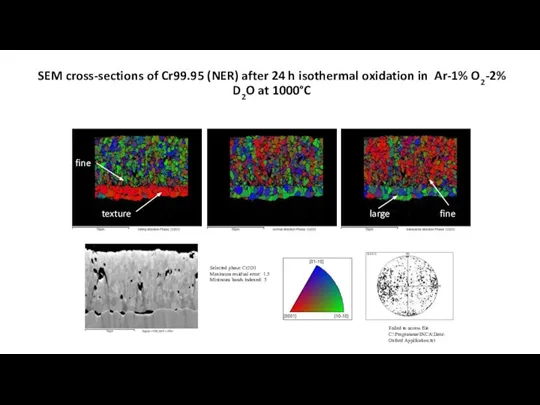
- 29. Електронні мікрофотографії струкрури оксидної плівки
- 30. Selected phase: Cr2O3 Maximum residual error: 1.5 Minimum bands indexed: 5 Failed to access file C:\Programme\INCA\Data\Oxford
- 32. Скачать презентацию


























 Решение задач на тему: Свободное падение
Решение задач на тему: Свободное падение Единицы напряжения
Единицы напряжения Свободное падение
Свободное падение Работа поршня
Работа поршня Технологические характеристики грунтов. Определение трудности процессов разработки горных пород
Технологические характеристики грунтов. Определение трудности процессов разработки горных пород Детали машин. Параметры эвольвентного зубчатого зацепления
Детали машин. Параметры эвольвентного зубчатого зацепления Исследование поверхностного натяжения жидкостей. 10 класс
Исследование поверхностного натяжения жидкостей. 10 класс Радіо. Історія виникнення радіозв'язку
Радіо. Історія виникнення радіозв'язку Текущий ремонт двигателя. Технологический процесс, оборудование и инструмент. Вопрос 19
Текущий ремонт двигателя. Технологический процесс, оборудование и инструмент. Вопрос 19 Машины и оборудование для приготовления, транспортирования бетонов и растворов и уплотнения бетонных смесей. Тема 6
Машины и оборудование для приготовления, транспортирования бетонов и растворов и уплотнения бетонных смесей. Тема 6 Броуновское движение. Диффузия. Силы взаимодействия молекул
Броуновское движение. Диффузия. Силы взаимодействия молекул Сложение двух сил, направленных по одной прямой. Равнодействующая сила
Сложение двух сил, направленных по одной прямой. Равнодействующая сила Физическая викторина
Физическая викторина Разработка комбинированного стенда для диагностики технического состояния тормозов грузовых автомобилей
Разработка комбинированного стенда для диагностики технического состояния тормозов грузовых автомобилей Кинематика движения материальной точки
Кинематика движения материальной точки Квалификационные билеты. Билет № 1
Квалификационные билеты. Билет № 1 Законы Ньютона
Законы Ньютона Double - beta decay of 96zr and double - electron capture of 156dy to excited final states
Double - beta decay of 96zr and double - electron capture of 156dy to excited final states Опыты с водой: сильный газ и остуди пар
Опыты с водой: сильный газ и остуди пар Трансмиссия автомобиля
Трансмиссия автомобиля Ядерные взаимодействия. (Тема 2.1)
Ядерные взаимодействия. (Тема 2.1) Строение атома
Строение атома Робототехника. Научные достижения в робототехнике и ее влияние на нашу жизнь
Робототехника. Научные достижения в робототехнике и ее влияние на нашу жизнь Термодинамика
Термодинамика Внутренняя энергия и способы её изменения
Внутренняя энергия и способы её изменения Обеспечение требуемой точности машины. Тема 4
Обеспечение требуемой точности машины. Тема 4 Лекция 8
Лекция 8 Оптическая иллюзия
Оптическая иллюзия