Содержание
- 2. Ядерная (планетарная) модель атома: атом состоит из положительно заряженного ядра, вокруг которого вращаются электроны (отрицательно –
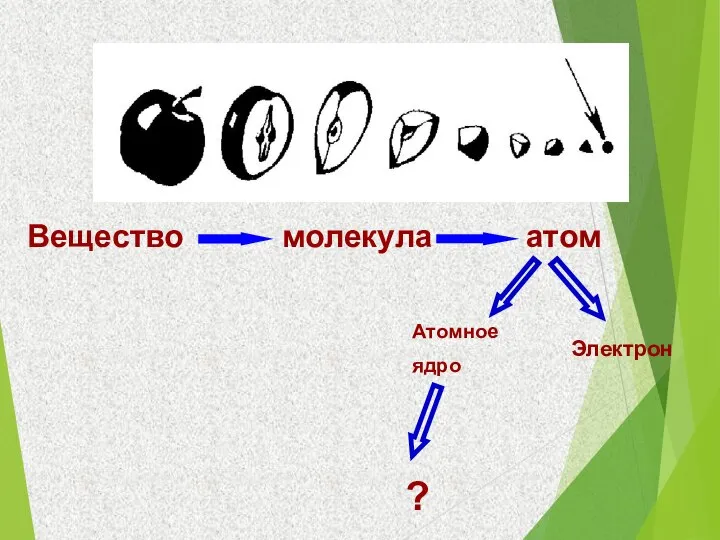
- 3. Вещество Атомное ядро Электрон ? молекула атом
- 4. e – электрон (-) p – протон (+) n – нейтрон ( )
- 5. Нейтрон – элементарная частица не имеющая электрического заряда, обладающая большой проникающей способностью, Открыта в 1932 году
- 6. 1932 год. Немецкий физик Гейзенберг и советский физик Иваненко предложили протонно-нейтронную модель ядра: Ядра всех элементов
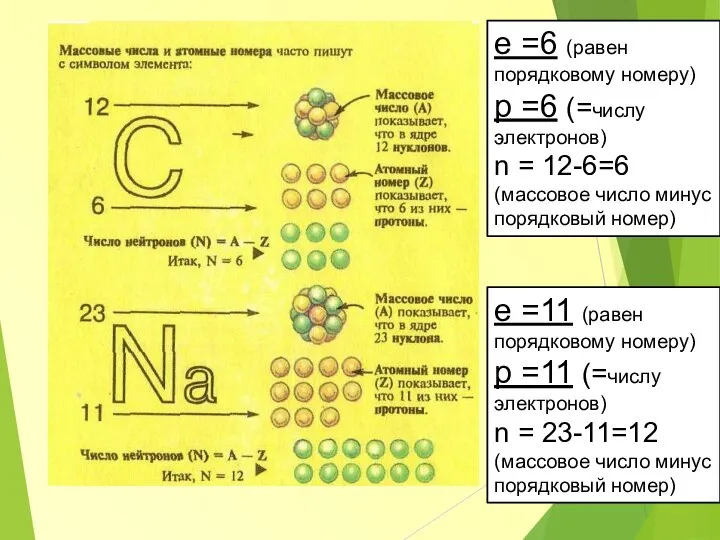
- 7. X – химический элемент из периодической системы Д.И. Менделеева Z – порядковый номер, он соответствует числу
- 8. e =6 (равен порядковому номеру) p =6 (=числу электронов) n = 12-6=6 (массовое число минус порядковый
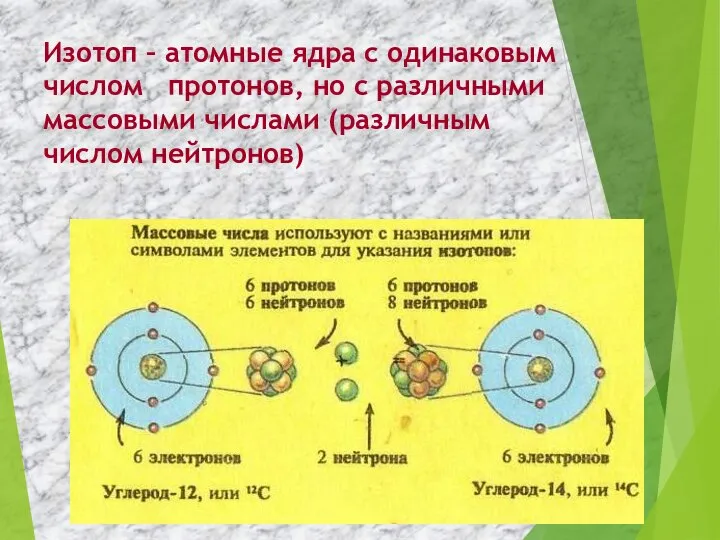
- 9. Изотоп – атомные ядра с одинаковым числом протонов, но с различными массовыми числами (различным числом нейтронов)
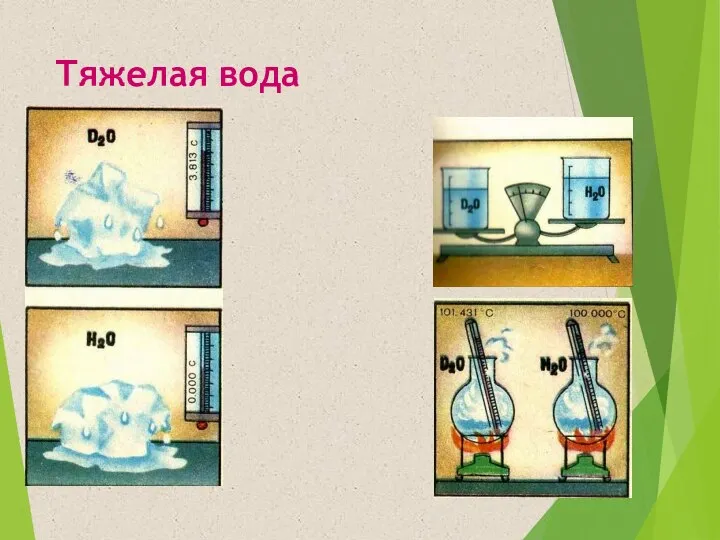
- 10. Тяжелая вода
- 11. e=1 p=1 n=1-1=0 Дейтерий e=1 p=1 n=2-1=1 Тритий - e=1 p=1 n=3-1=2
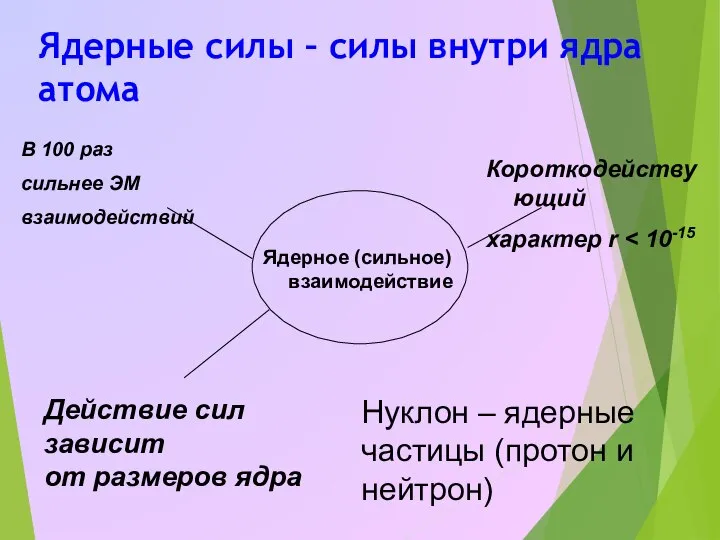
- 12. Ядерные силы – силы внутри ядра атома Ядерное (сильное) взаимодействие В 100 раз сильнее ЭМ взаимодействий
- 14. Скачать презентацию






 Электромагнетизм
Электромагнетизм Что изучает физика
Что изучает физика Презентация на тему Линза. Построение изображения в линзе
Презентация на тему Линза. Построение изображения в линзе  Равномерность хода двигателя. Лекция №5б
Равномерность хода двигателя. Лекция №5б Опыт, позволивший обнаружить сложный состав радио - активного излучения
Опыт, позволивший обнаружить сложный состав радио - активного излучения Действие жидкости на погруженное в нее тело. 7 класс
Действие жидкости на погруженное в нее тело. 7 класс Презентация на тему Давление жидкости
Презентация на тему Давление жидкости  Импульс тела. Закон сохранения импульса
Импульс тела. Закон сохранения импульса Линзы. Что называется линзой?
Линзы. Что называется линзой? Исследование влияния начальной погиби на вибрационные свойства и устойчивость обшивки
Исследование влияния начальной погиби на вибрационные свойства и устойчивость обшивки Синергетика
Синергетика Якорное устройство
Якорное устройство Составные части велосипеда
Составные части велосипеда Автоматизированная обработка результатов измерений. Современные методы повышения диапазона и точности оптических измерений
Автоматизированная обработка результатов измерений. Современные методы повышения диапазона и точности оптических измерений Земной магнетизм
Земной магнетизм Электростатика. Кроссворд
Электростатика. Кроссворд Составные части комплекта виброизмерительной аппаратуры
Составные части комплекта виброизмерительной аппаратуры Астрофизика итоги. 2021г
Астрофизика итоги. 2021г Кинематика на точка в декартови координати
Кинематика на точка в декартови координати Линзы. Оптическая сила линзы. 9 класс
Линзы. Оптическая сила линзы. 9 класс Теоремы статики
Теоремы статики Датчик исследований динамики углекислого газа в лес
Датчик исследований динамики углекислого газа в лес Изучение тепловых явлений. 8 класс
Изучение тепловых явлений. 8 класс Движение системы тел с учётом трения
Движение системы тел с учётом трения Структура и свойства заготовок и деталей. Лекция 3
Структура и свойства заготовок и деталей. Лекция 3 Измерение фокусных расстояний и фокальных отрезков объективов на оптической скамье (ЛР №1)
Измерение фокусных расстояний и фокальных отрезков объективов на оптической скамье (ЛР №1) Презентация на тему Воздействие тепловых двигателей на окружающую среду
Презентация на тему Воздействие тепловых двигателей на окружающую среду  Режимы течения пленки
Режимы течения пленки