Слайд 6Квантовые постулаты Бора
Атомная система может находиться только в особых стационарных (квантовых)

состояниях, каждому из которых соответствует определенная энергия En. В стационарных состояниях атом не излучает.
При переходе из стационарного состояния n в стационарное состояние m излучается (поглощается) квант, энергия которого равна разности энергий стационарных состояний:
Третий постулат Бора предлагает правило нахождения стационарных орбит.
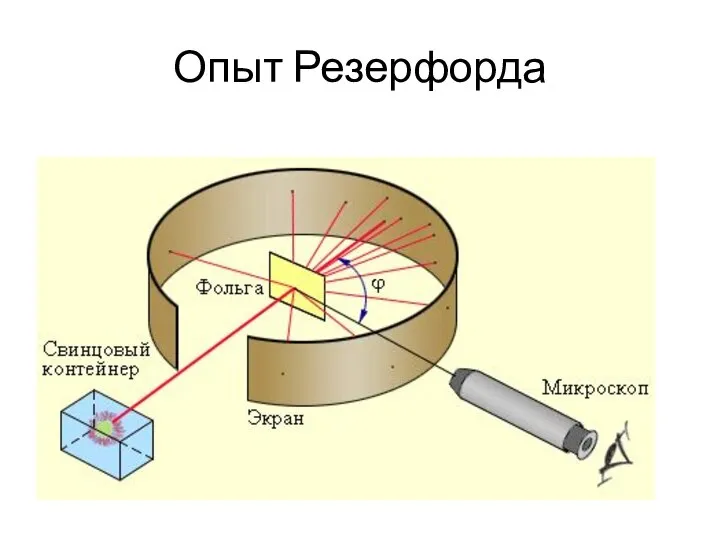
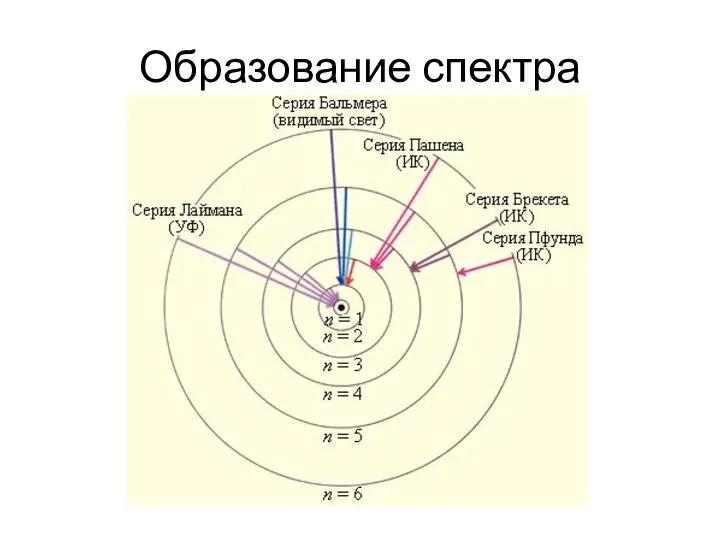
Слайд 8Теория Бора объяснила возникновение линейчатых спектров
Радиусы круговых электронных орбит можно найти по

формуле: rn = r1n2
Для атома водорода энергия основного состояния равна: E1 = –21,7·10–19 Дж = –13,6 эВ
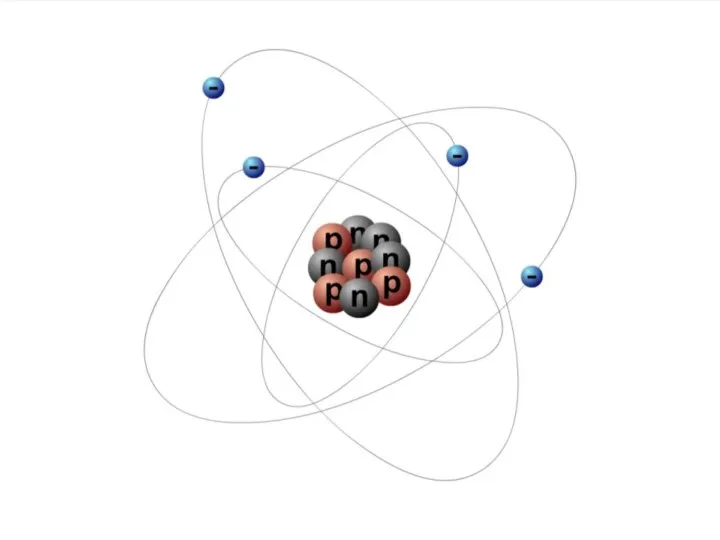
Слайд 9Атом состоит из атомного ядра и электронов
Атомное ядро заряжено положительно.
Его диаметр
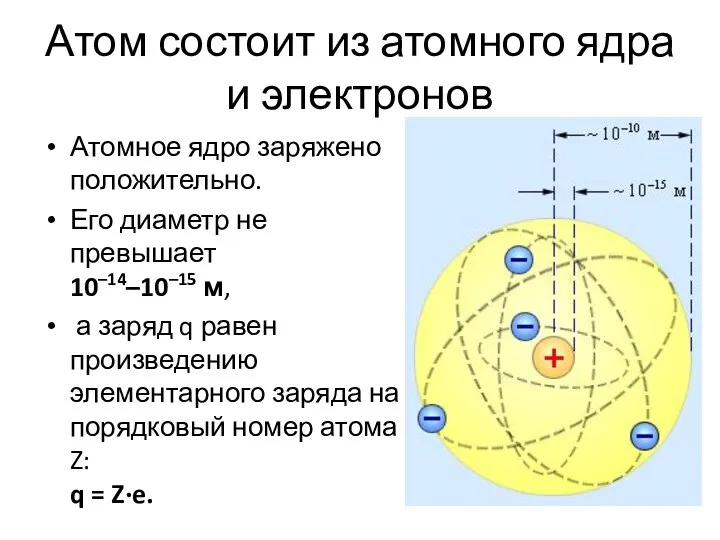
не превышает 10–14–10–15 м,
а заряд q равен произведению элементарного заряда на порядковый номер атома Z: q = Z∙e.
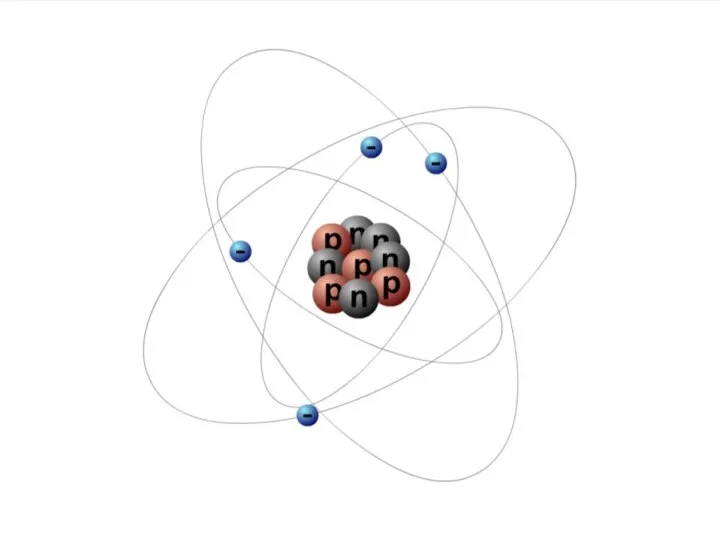
Слайд 10ЧАСТИЦЫ В АТОМЕ
Электрон – это частица, заряд которой отрицателен и равен по

модулю элементарному заряду e = 1,6·10–19 Кл, а масса me = 9,1·10–31 кг.
Протон – это частица, заряд которой положителен и равен по модулю заряду электрона: qp = +1,6·10–19 Кл, а масса mp = 1,6726·10–27 кг.
Нейтрон – это нейтральная частица, масса которой равна mn = 1,6749·10–27 кг.
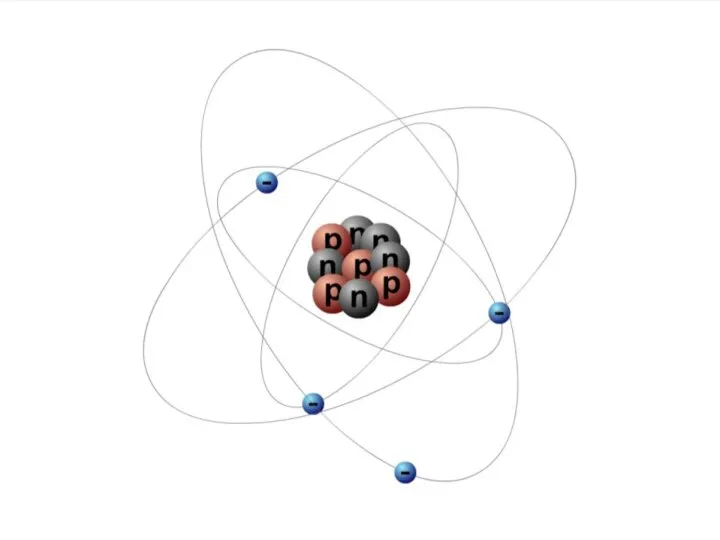
Слайд 11Примеры ядер атомов
Число нейтронов в атоме равно N. Общее число нуклонов в
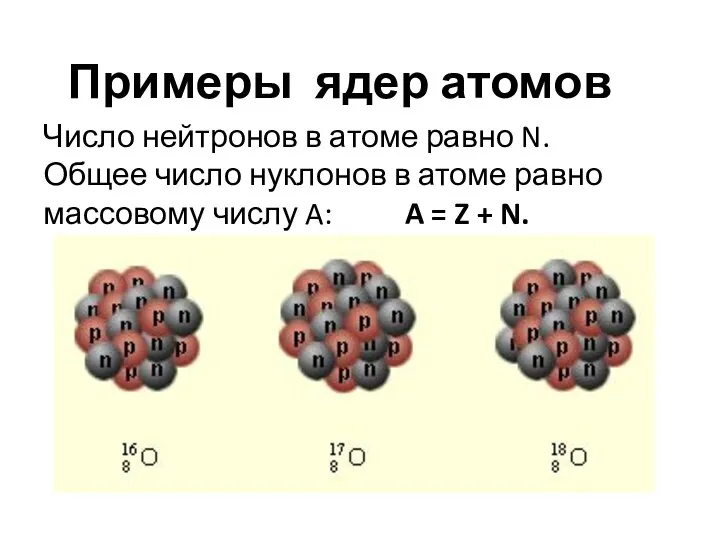
атоме равно массовому числу A: A = Z + N.
Слайд 12Изотопы
– это атомы, ядра которых содержат одинаковое число протонов, но разное число

нейтронов (т.е. атомы одного химического элемента с разным числом нейтронов в ядре).
Слайд 14Атомная единица массы
атомная единица массы (а.е.м.), примерно равная массе одного нуклона: 1 а.е.м. = 1,6605·10–27 кг








 Адиабатическое приближение
Адиабатическое приближение Урсостидгаза
Урсостидгаза Аксиомы статики
Аксиомы статики Дискретность электрического заряда. Ионы и электроны. Строение атома. Раздел 1. АФ1.1
Дискретность электрического заряда. Ионы и электроны. Строение атома. Раздел 1. АФ1.1 Основы МРТ
Основы МРТ Введение в теорию электромагнитного поля. Лекция №7
Введение в теорию электромагнитного поля. Лекция №7 Равноускоренное прямолинейное движение
Равноускоренное прямолинейное движение Биополярные СВЧ-транзисторы
Биополярные СВЧ-транзисторы Исследование процесса образования ядер капель и кристаллов в атмосфере. Лабораторная работа №2
Исследование процесса образования ядер капель и кристаллов в атмосфере. Лабораторная работа №2 Внутренняя энергия. Способы изменения внутренней энергии (тренажер)
Внутренняя энергия. Способы изменения внутренней энергии (тренажер) Тема 3.2
Тема 3.2 Системы ЭУ (судовые турбины)
Системы ЭУ (судовые турбины) Знаем ли мы физику? (конкурс знатоков)
Знаем ли мы физику? (конкурс знатоков) Проводники, диэлектрики и полупроводники
Проводники, диэлектрики и полупроводники Задачи на скорость движения молекул
Задачи на скорость движения молекул Презентация на тему Как стать экологически грамотным потребителем электроэнергии
Презентация на тему Как стать экологически грамотным потребителем электроэнергии  Принципи на механиката. Задачи. 8 клас
Принципи на механиката. Задачи. 8 клас Сравнительная характеристика электрического тока в различных средах
Сравнительная характеристика электрического тока в различных средах Телескоп-рефрактор
Телескоп-рефрактор ИСПАР И КОНДЕН
ИСПАР И КОНДЕН Механічна робота. Потужність
Механічна робота. Потужність Сила Архимеда 7 класс - Презентация_
Сила Архимеда 7 класс - Презентация_ Брейн-ринг по физике
Брейн-ринг по физике Динамика. Сила
Динамика. Сила Явление электромагнитной индукции
Явление электромагнитной индукции ОГЭ-2022 по физике. Задания, требования и изменения в сравнении с ОГЭ-2020
ОГЭ-2022 по физике. Задания, требования и изменения в сравнении с ОГЭ-2020 Получение нанокапель методом сверхзвукового разшерения
Получение нанокапель методом сверхзвукового разшерения Периодические регламентные работы по ремонту ТСКБМ-П
Периодические регламентные работы по ремонту ТСКБМ-П