Содержание
- 2. начала термодинамики Первое начало выражает закон сохранения энергии — всеобщий закон природы. Оно определяет баланс энергии
- 3. Термодинамические параметры Объем V характеризуют пространство, занимаемое термодинамической системой. Он тесно связан с параметрами энергетического взаимодействия.
- 4. Термодинамические параметры
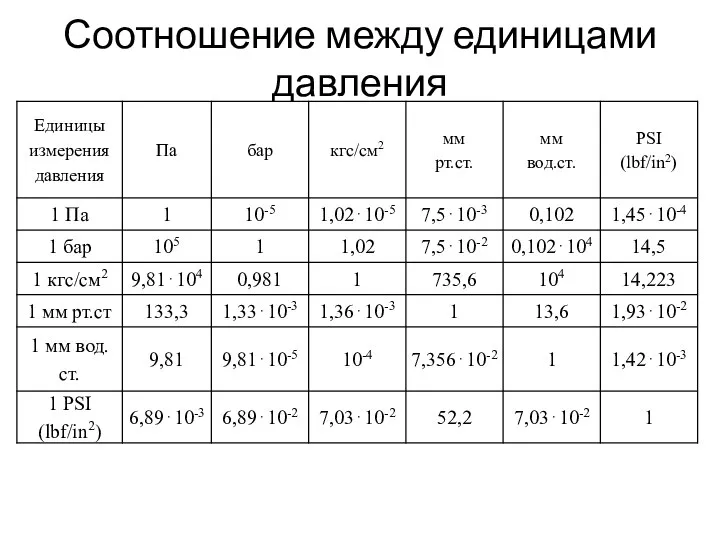
- 5. Соотношение между единицами давления
- 6. термодинамические параметры Температура Т- в термодинамике считают мерой нагретости тела.
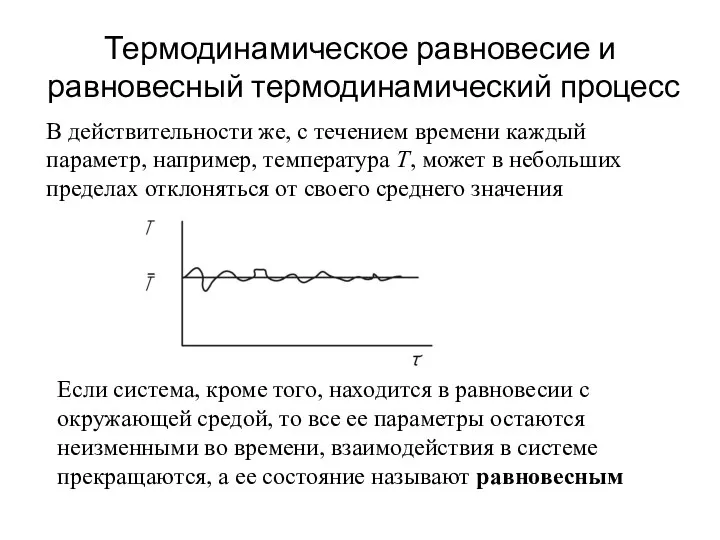
- 7. Термодинамическое равновесие и равновесный термодинамический процесс В действительности же, с течением времени каждый параметр, например, температура
- 8. Термодинамическое равновесие и равновесный термодинамический процесс Все процессы разделяют на равновесные и неравновесные. Равновесным называют процесс,
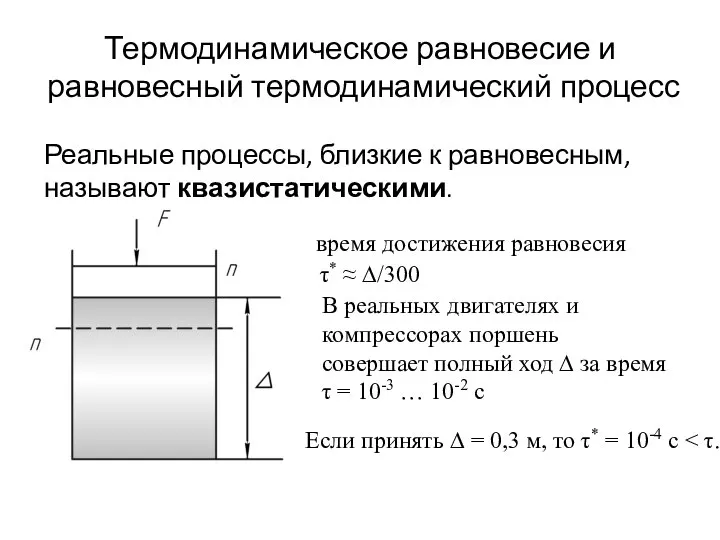
- 9. Термодинамическое равновесие и равновесный термодинамический процесс Реальные процессы, близкие к равновесным, называют квазистатическими. время достижения равновесия
- 10. Термическое уравнение состояния В однородных термодинамических системах любые два термических параметра однозначно определяют третий, а вся
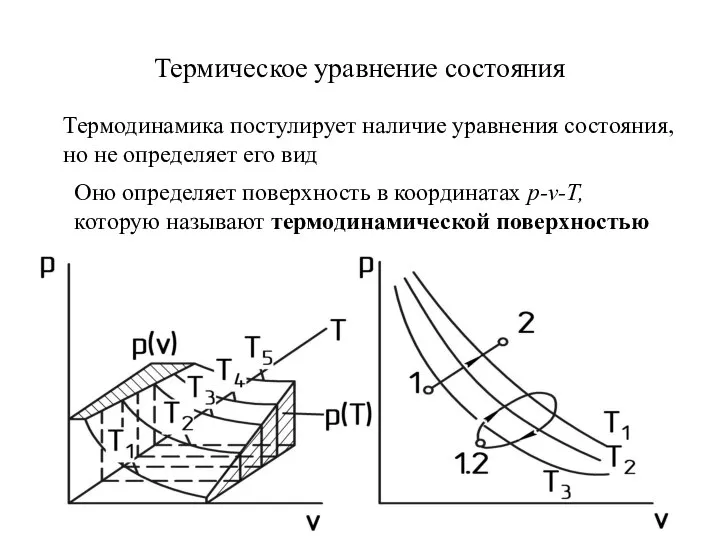
- 11. Термическое уравнение состояния Термодинамика постулирует наличие уравнения состояния, но не определяет его вид Оно определяет поверхность
- 12. Законы для идеального газа Уравнение формально объединяет три закона закон Гей-Люссака закон Бойля- Мариотта закон Шарля
- 13. Смеси идеальных газов Смесь подчиняется уравнению Клапейрона-Менделеева для смеси Величину pmix определяет закон Дальтона Поскольку модель
- 14. Смеси идеальных газов Для каждого компонента можно использовать уравнение Клапейрона-Менделеева Зададим состав смеси массовыми долями компонентов
- 15. Смеси идеальных газов Левые части уравнений одинаковы, поэтому должны быть одинаковы и правые Разделим обе части
- 16. Энергия, работа, теплота Для замкнутых систем, изучаемых термодинамикой, важно выделить энергию термодинамической системы в целом (кинетическую
- 17. Энергия, работа, теплота Существуют два вида взаимодействия термодинамических систем друг с другом или с окружающей средой:
- 18. Энергия, работа, теплота Работа, совершаемая всей системой- L работа, совершаемая единицей массы рабочего тела - удельная
- 19. Энергия, работа, теплота Теплота - Q Удельная теплота — теплота, приходящаяся на единицу массы: Если термодинамическая
- 20. Теплоемкость истинная полная теплоемкость Сх - функция процесса Удельная теплоемкость, т. е. теплоемкость единицы массы, объема-
- 21. Теплоемкость схт - среднее значение (от англ, middle — средний) применим теорему о среднем и получим
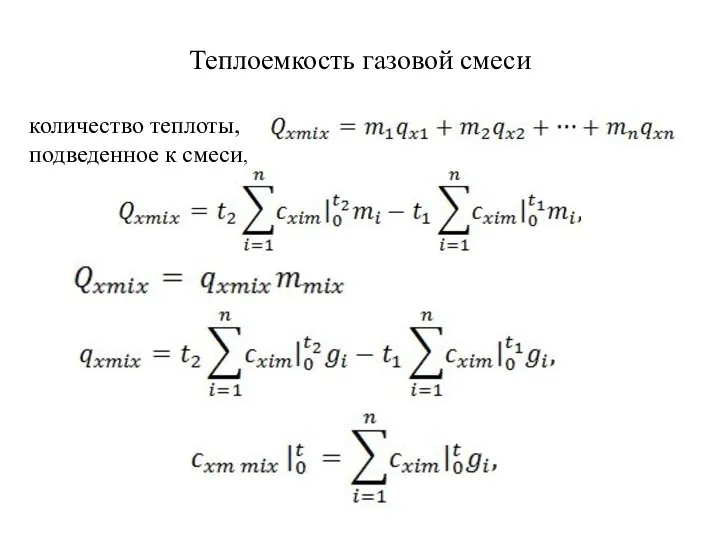
- 22. Теплоемкость газовой смеси количество теплоты, подведенное к смеси,
- 23. ПЕРВОЕ НАЧАЛО ТЕРМОДИНАМИКИ Первым началом термодинамики является закон сохранения энергии для термодинамических систем: «в любых процессах
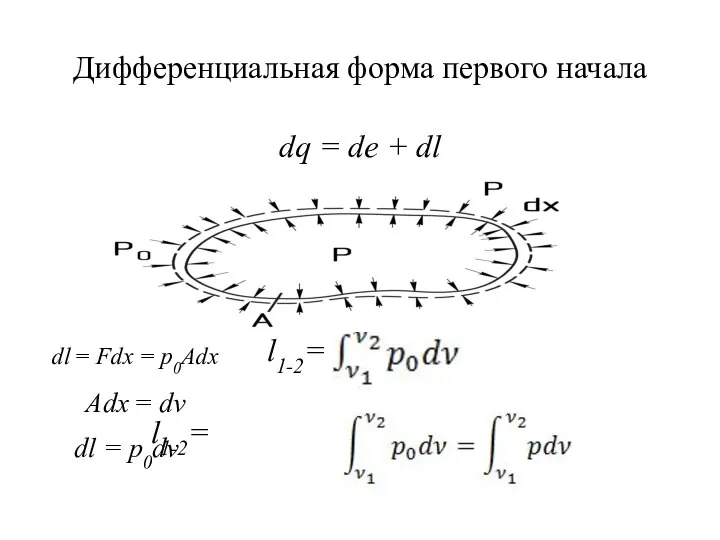
- 24. Дифференциальная форма первого начала dq = de + dl l1-2= l1-2= dl = Fdx = p0Adx
- 25. p-v рабочая диаграмма состояний пл. с1a2d =
- 26. Внутренняя энергия как функция состояния Калорическое уравнение состояния е = е (v,Т) Применительно к внутренней энергии
- 27. Энтальпия и ее свойства тело в форме цилиндра объемом ν = f∆ lo – работа «проталкивания»
- 28. Энтальпия и ее свойства В дифференциальной форме dh=de+d(pv) Энтальпию удобно задавать в виде h=h(p, T) Полный
- 29. Энтальпия и ее свойства Уравнения первого начала В изохорном процессе (ν=const, dν = 0) В изобарном
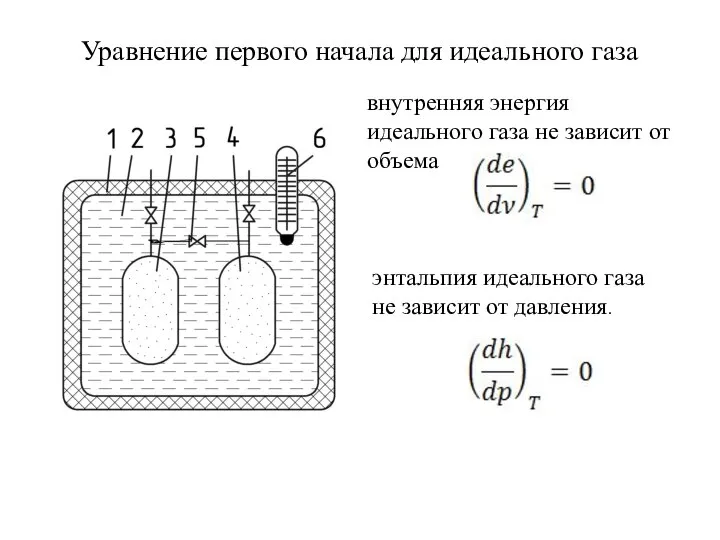
- 30. Уравнение первого начала для идеального газа внутренняя энергия идеального газа не зависит от объема энтальпия идеального
- 31. Калорические уравнения состояния идеального газа полные дифференциалы внутренней энергии и энтальпии для идеальных газов удельная изобарная
- 32. АНАЛИЗ ПРОЦЕССОВ С ИДЕАЛЬНЫМ ГАЗОМ. Изобарный процесс при dp=0 dh =cpdT Связь термических параметров газа в
- 33. Изохорный процесс Работа газа в изохорном процессе равна нулю, поскольку dν=0 Если теплоемкость слабо зависит от
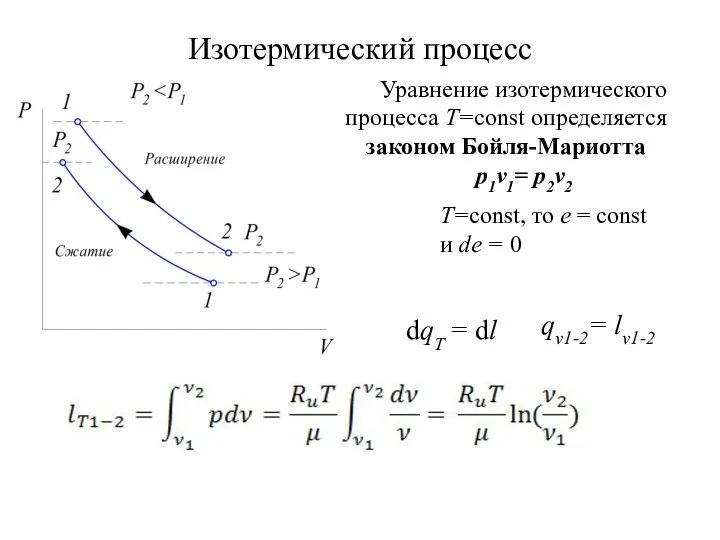
- 34. Изотермический процесс Т=const, то е = const и de = 0 dqT = dl qν1-2= lν1-2
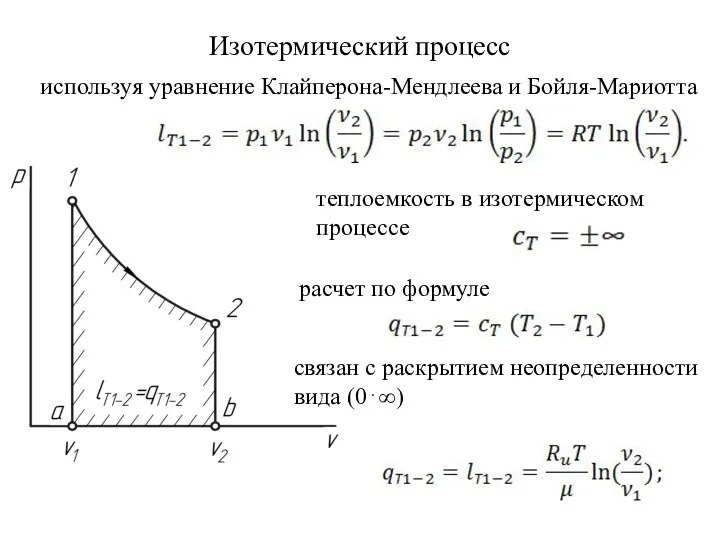
- 35. Изотермический процесс используя уравнение Клайперона-Мендлеева и Бойля-Мариотта теплоемкость в изотермическом процессе расчет по формуле связан с
- 36. Адиабатный процесс Для идеального газа dh = срdT, при dq=0 и q1-2=0 уравнение первого начала принимает
- 37. Адиабатный процесс k= 1,66 для одноатомных газов; k= 1,40 для двухатомных; k = 1,33 для трех-
- 38. Адиабатный процесс уравнение адиабаты Пуассона Подставим в уравнение Аналогично можно найти связь между p и Т:
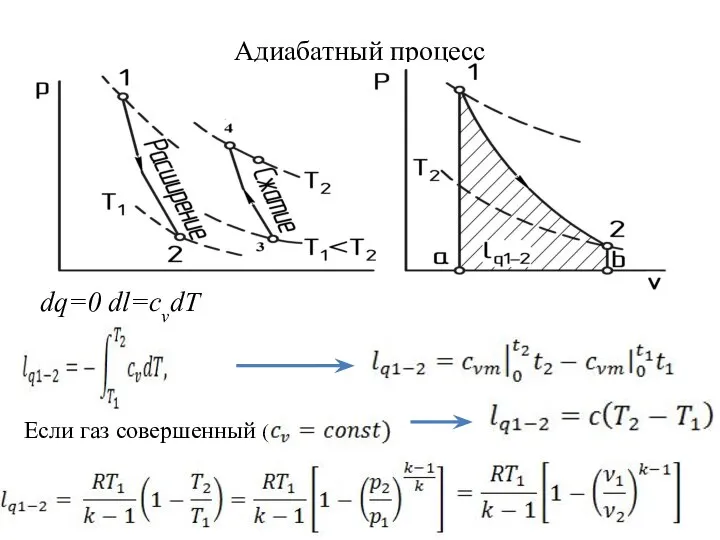
- 39. Адиабатный процесс Если газ совершенный ( dq=0 dl=cvdT
- 40. Политропные процессы Политропные процессы — процессы идеальною газа, идущие при постоянной теплоемкости Кроме того, при cv=const
- 41. Политропные процессы Если в формулы первого начала подставить значение q= откуда следует, что После почленного деления
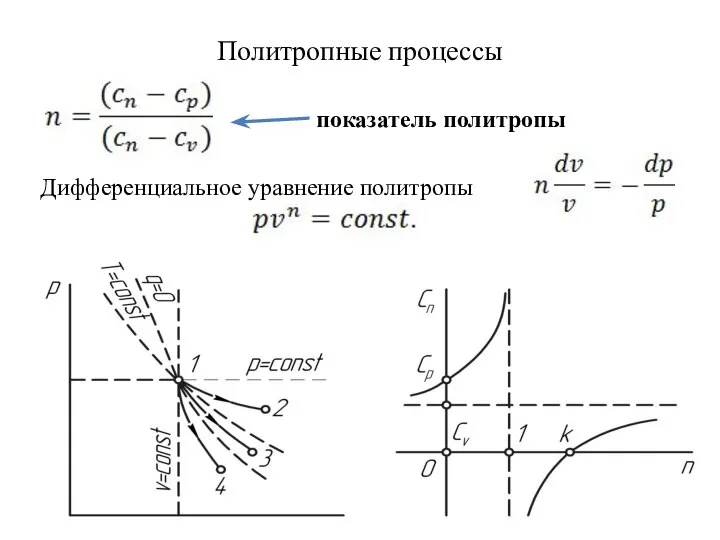
- 42. Политропные процессы Дифференциальное уравнение политропы показатель политропы
- 43. Политропные процессы Процессам: p=const n=0, T=const n=1 v=const n = q =сonst n=k , для процесса
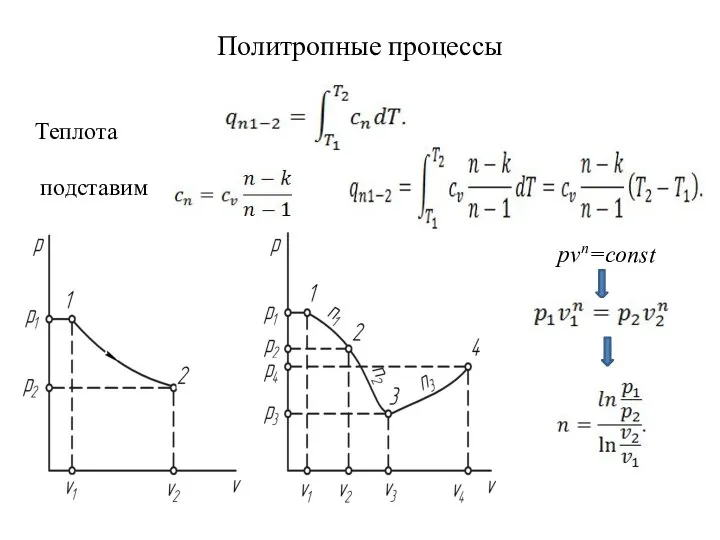
- 44. Политропные процессы Теплота подставим pvn=const
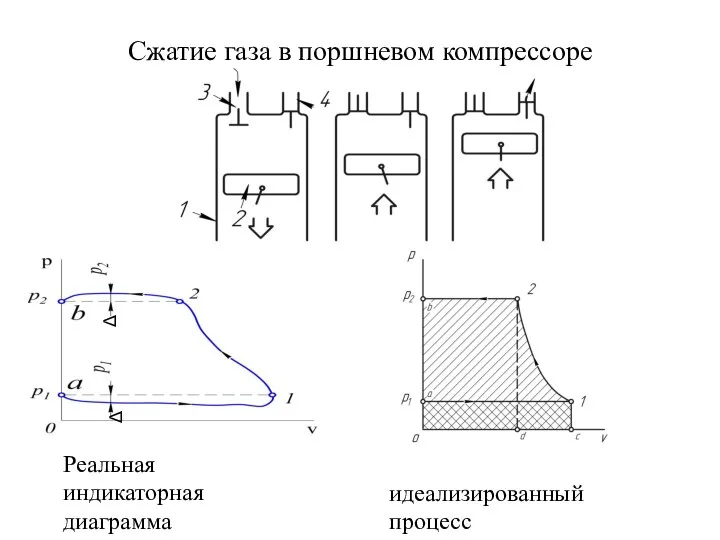
- 45. Сжатие газа в поршневом компрессоре Реальная индикаторная диаграмма идеализированный процесс Δ Δ
- 46. Сжатие газа в поршневом компрессоре Работа изобарного процесса а-1 аналогично выражается и работа процесса 2-b Работа
- 47. Сжатие газа в поршневом компрессоре Возьмем интеграл в правой части равенства по частям: Откуда Функция, которая
- 48. Работа, затраченная на привод компрессора при адиабатном сжатии, при изотермическом сжатии
- 50. Скачать презентацию


































 ТП Р3 Т№5
ТП Р3 Т№5 Масса тела
Масса тела Исследование инерционных и массовых характеристик новой арматурной сетки
Исследование инерционных и массовых характеристик новой арматурной сетки Солнечная генерация
Солнечная генерация Электромагнетизм. Магнитное поле проводника с током
Электромагнетизм. Магнитное поле проводника с током Гидродинамика
Гидродинамика Точность механической обработки и погрешности изготовления деталей
Точность механической обработки и погрешности изготовления деталей Пароходы и лайнеры
Пароходы и лайнеры Классификация средств диагностирования
Классификация средств диагностирования Применение ядерной энергии
Применение ядерной энергии Какие бывают часы
Какие бывают часы Теплофизические свойства твердых тел
Теплофизические свойства твердых тел Физика за чашкой чая. Тепловые явления. Проще простого
Физика за чашкой чая. Тепловые явления. Проще простого Переходные процессы в электроэнергетических системах. Приведение магнитосвязанных цепей к одному уровню напряжения
Переходные процессы в электроэнергетических системах. Приведение магнитосвязанных цепей к одному уровню напряжения Управление потоком поверхностных плазмонполяритонов с помощью внешних полей
Управление потоком поверхностных плазмонполяритонов с помощью внешних полей Давление газа
Давление газа Электрооборудование автомобиля. Система зажигания
Электрооборудование автомобиля. Система зажигания Теоретическая механика
Теоретическая механика Градиент и его свойства
Градиент и его свойства Экспертные советы по теоретической физике
Экспертные советы по теоретической физике Закон полного тока для магнитного поля в веществе
Закон полного тока для магнитного поля в веществе Трансформатор. Холостой и рабочий ход, Подача и потребление электроэнергии
Трансформатор. Холостой и рабочий ход, Подача и потребление электроэнергии Движение в физике. Физико-химические процессы. Радиация, 10 класс
Движение в физике. Физико-химические процессы. Радиация, 10 класс Всемирное тяготение
Всемирное тяготение Шкала электромагнитных волн
Шкала электромагнитных волн Устройство швейной машины Yamata
Устройство швейной машины Yamata Презентация на тему Радиация: проблемы и перспективы
Презентация на тему Радиация: проблемы и перспективы  Способы рассуждений физиков
Способы рассуждений физиков