Слайд 2Выполнил:
Учащийся 10А класса
Гимназии №76
Морозов Никита

Слайд 3Глава 1. Основы МКТ
Глава 2. МКТ идеального газа
Глава 3. Газовые законы и

уравнение состояния идеального газа
Глава 4. Взаимные превращения жидкостей и газов
Глава 5. Твёрдые тела
Глава 6. Основы термодинамики
Слайд 4
Тема 1:
1.1 Основные положения МКТ. 1.2 Броуновское
Размеры молекул. движение.
1.3 Силы взаимодействия
молекул.
Строение газообразных, жидких и твёрдых тел.
Слайд 5Тема 2
2.1 Основное уравнение МКТ.
2.2 Температура и тепловое
равновесие
2.3 Определение температуры.
Энергия

теплового движения
молекул. 2.4 Измерение скоростей молекул газа
Слайд 6
Тема 3
2.1 Уравнение состояния
идеального газа.
2.2 Газовые законы.
Слайд 7Тема 4
4.1 Насыщенный пар
4.2 Давление насыщенного пара
4.3 Влажность воздуха

Слайд 8Тема 5
5.1 Кристаллические и аморфные тела

Слайд 9Тема 6
6.1 Внутренняя энергия
6.2 Работа в термодинамике
6.4 Первый закон
6.3 Количество теплоты.

термодинамики
Уравнение теплового баланса.
Слайд 10Тема 6
6.2 Второй закон
термодинамики 6.3 Принцип действия
тепловых двигателей.
КПД тепловых двигателей.
.

Слайд 11Основы МКТ
Основные положения МКТ
1. Все вещества – жидкие, твердые и газообразные

– образованы из мельчайших частиц – молекул, которые сами состоят из атомов («элементарных молекул»). Молекулы химического вещества могут быть простыми и сложными, т.е. состоять из одного или нескольких атомов.
Слайд 12Основы МКТ
Молекула воды: Молекула сложного
(многоатомного) белка:
Слайд 13Основы МКТ
Основные положения МКТ
Молекулы и атомы представляют собой электрически нейтральные частицы.

При определенных условиях молекулы и атомы могут приобретать дополнительный электрический заряд и превращаться в положительные или отрицательные ионы.
Ионы – заряженные частицы, образованные из атомов, в результате отдачи или принятия электронов.
Слайд 14Основы МКТ
2. Атомы и молекулы находятся в непрерывном хаотическом движении.
3. Частицы взаимодействуют

друг с другом силами, имеющими электрическую природу. Гравитационное взаимодействие между частицами пренебрежимо мало.
Слайд 15Основы МКТ
Размеры молекул.
Молекулы, как и атомы, не имеют чётких границ. Если представить

молекулу в виде шарика, то её радиус имеет значение от 0,1 нм у простейших до 100 нм у сложных молекул, состоящих из нескольких тысяч атомов. Например, оценочный диаметр молекулы водорода составляет 0,2 нм, а диаметр молекулы воды — 0,3 нм.
Слайд 16Основы МКТ
Броуновское движение
Броуновское движение (брауновское движение) — беспорядочное движение микроскопических видимых взвешенных частиц твёрдого вещества в жидкости

или газе , вызываемое тепловым движением частиц жидкости или газа. Было открыто в 1827 году Робертом Броуном (правильнее Брауном).
Броуновское движение – тепловое движение, которое не может прекратиться. С увеличением температуры его интенсивность растёт.
Слайд 18Основы МКТ
Броуновское движение
Причиной броуновского движения является то, что удары молекул жидкости

о частицу не компенсируют друг другом.
Опыт Перрена: Идея опытов Перрена состоит в следующем. Известно, что концентрация молекул газа уменьшается с высотой. Если бы не было теплового движения, то все молекулы упали бы на Землю и атмосфера исчезла бы.
На следующем слайде продолжение опыта:
Слайд 19Основы МКТ
Броуновское движение (Опыт Перрена)
Однако если бы не было притяжения к

Земле, то за счет теплового движения молекулы покидали бы Землю, так как газ способен к неограниченному расширению. В результате действия этих противоположных факторов устанавливается определенное распределение молекул по высоте, о чем сказано выше, т. е. концентрация молекул довольно быстро уменьшается с высотой. Причем, чем больше масса молекул, тем быстрее
с высотой убывает их концентрация.
Слайд 20Основы МКТ
Опыт Перрена
Подсчитывая концентрацию частиц на разных высотах, Перрен нашел, что

эта концентрация убывает с высотой по тому же закону, что и концентрация молекул газа. Отличие в том, что за счет большой массы броуновских частиц убывание происходит очень быстро. Подсчет броуновских частиц на разных высотах позволил Перрену определить постоянную Авогадро совершенно новым методом. Значение этой постоянной совпало с известным. (6,02*10^23)
Слайд 21Основы МКТ
Силы взаимодействия молекул.
Строение газообразных, жидких и твёрдых тел.
Между молекулами

любого вещества действуют силы взаимодействия или молекулярные силы. Эти силы имеют электромагнитную природу. Так как массы молекул очень малы, ничтожно малые силы гравитационного взаимодействия между молекулами можно не рассматривать. Каждая молекула представляет собой сложную систему, состоящую из заряженных частиц: электронов и атомных ядер.
Слайд 22Основы МКТ
Силы взаимодействия молекул
При взаимодействии молекул одновременно действуют как силы притяжения

их разноименных зарядов, так и силы отталкивания одноименных. И те, и другие с увеличением расстояния между молекулами быстро уменьшаются. Однако убывание сил отталкивания должно быть более быстрым, чем сил притяжения, в результате чего силы отталкивания будут преобладать на малых расстояниях между молекулами, а силы притяжения – на более дальних расстояниях.
Слайд 23Основы МКТ
Силы взаимодействия молекул
На рисунке изображена зависимость силы взаимодействия молекул
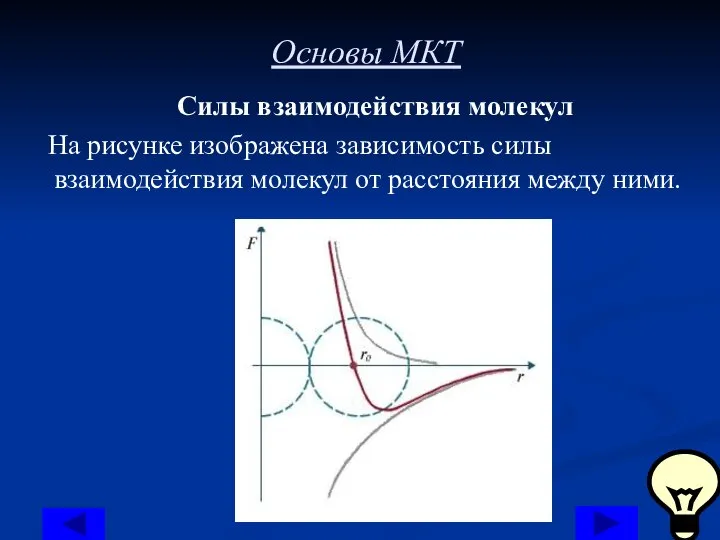
от расстояния между ними.
Слайд 24Основы МКТ
Силы взаимодействия молекул
Как видно из рисунка, на очень больших расстояниях

электромагнитного взаимодействия между молекулами практически нет. При сближении молекул, оставаясь в целом электрически нейтральными, молекулы будут ориентироваться таким образом, что их обращённые друг к другу стороны будут иметь разноимённые заряды. В результате между молекулами будут возникать силы притяжения. При дальнейшем сближении молекул силы притяжения между ними будут возрастать.
Слайд 25Основы МКТ
Силы взаимодействия молекул
Если молекулы сблизятся до такой степени, что их

электронные облака начнут заметно проникать друг в друга, то электроны и ядра различных молекул будут резко отталкиваться с силой, которая очень быстро растет с уменьшением расстояния между молекулами. На таких расстояниях будут преобладать силы отталкивания. Таким образом, на каждую молекулу действует сумма сил притяжения и отталкивания.
Слайд 26Основы МКТ
На больших расстояниях преобладает сила притяжения (на расстоянии 2-3 диаметров

молекулы притяжение максимально), на малых расстояниях сила отталкивания. Существует такое расстояние R между молекулами , на котором силы притяжения становятся равными силам отталкивания. Такое положение молекул называется положением устойчивого равновесия.
Слайд 27Основы МКТ
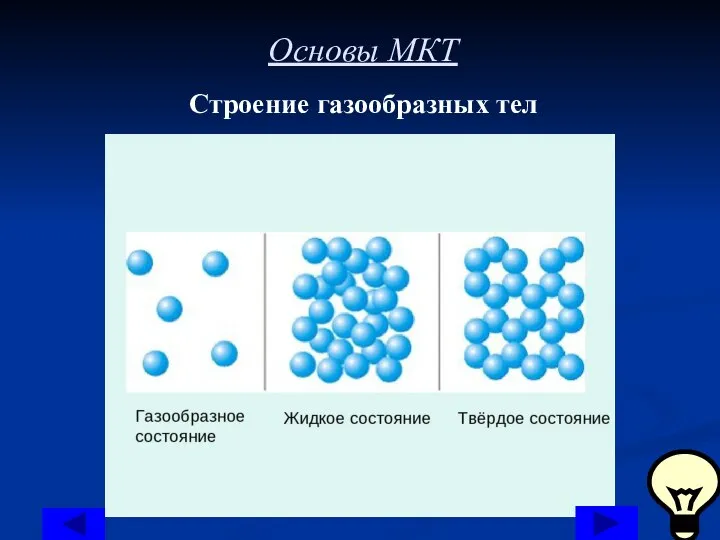
Строение газообразных тел
Слайд 28Основы МКТ
Строение газообразных тел
В газах расстояние между атомами или молекулами в

среднем во много раз больше размеров самих молекул. Например, при атмосферном давлении объем сосуда в десятки тысяч раз превышает объем находящихся в нем молекул.
Слайд 29Основы МКТ
Строение газообразных тел
Газы легко сжимаются, при этом уменьшается среднее расстояние

между молекулами, но форма молекулы не изменяется.
Слайд 30Основы МКТ
Строение газообразных
Молекулы с огромными скоростями - сотни метров в секунду

- движутся в пространстве. Сталкиваясь, они отскакивают друг от друга в разные стороны подобно бильярдным шарам. Слабые силы притяжения молекул газа не способны удержать их друг возле друга. Поэтому газы могут неограниченно расширяться. Они не сохраняют ни формы, ни объема.
Давление газа создают многочисленные удары молекул о стенки сосуда
Слайд 31Основы МКТ
Строение жидкостей
Молекулы жидкости расположены почти вплотную друг к другу (см

на рисунке далее), поэтому молекула жидкости ведет себя иначе, чем молекула газа. В жидкостях существует так называемый ближний порядок, т. е. упорядоченное расположение молекул сохраняется на расстояниях, равных нескольким молекулярным диаметрам. Молекула колеблется около своего положения равновесия, сталкиваясь с соседними молекулами.
Слайд 32Основы МКТ
Строение жидкостей
Лишь время от времени молекула жидкости совершает очередной «прыжок»,

попадая в новое положение равновесия. В этом положении равновесия сила отталкивания равна силе притяжения, т. е. суммарная сила взаимодействия молекулы равна нулю. Время оседлой жизни молекулы воды, т. е. время ее колебаний около одного определенного положения равновесия при комнатной температуре, равно в среднем
10^-11 с, а одного колебания:
от 10^-12 до 10^-13 секунд.
Слайд 33Основы МКТ
Строение жидкостей
Характер молекулярного движения в жидкостях, впервые установленный советским

физиком Я.И.Френкелем, позволяет понять основные свойства жидкостей. Молекулы жидкости находятся непосредственно друг возле друга. При уменьшении объема силы отталкивания становятся очень велики. Этим и объясняется малая сжимаемость жидкостей.
Слайд 34Основы МКТ
Строение жидкости
Как известно, жидкости текучи, т. е. не сохраняют своей

формы. Объяснить это можно так. Внешняя сила заметно не меняет числа перескоков молекул в секунду. Но перескоки молекул из одного оседлого положения в другое происходят преимущественно в направлении действия внешней силы (показано на рисунке). Вот почему жидкость течет и принимает форму сосуда.
Слайд 35Основы МКТ
Строение твёрдых тел
Атомы или молекулы твердых тел, в отличие от

атомов и молекул жидкостей, колеблются около определенных положений равновесия. По этой причине твердые тела сохраняют не только объем, но и форму. Потенциальная энергия взаимодействия молекул твёрдого тела существенно больше их кинетической энергии.
Если соединить центры положений равновесия атомов или ионов твердого тела, то получится правильная пространственная решетка, называемая кристаллической.
Слайд 36Основы МКТ
Строение твёрдых тел
На рисунках изображены кристаллические решетки поваренной соли
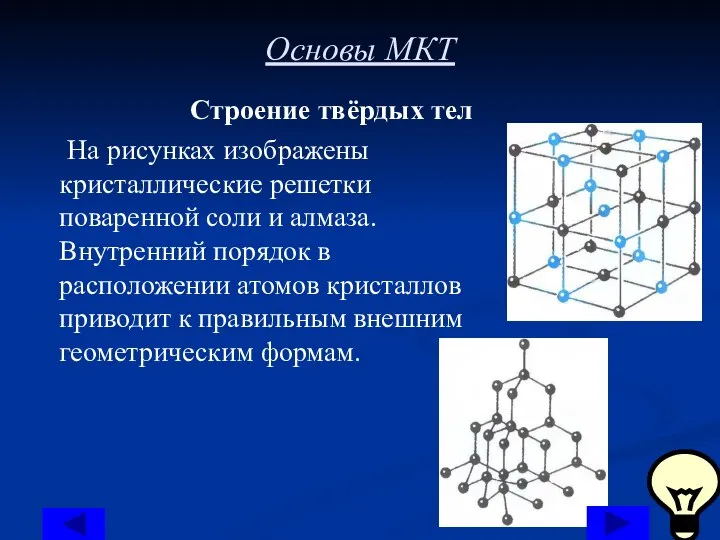
и алмаза. Внутренний порядок в расположении атомов кристаллов приводит к правильным внешним геометрическим формам.
Слайд 37МКТ идеального газа
ИНФОРМАЦИЮ СЮДА!!!

Слайд 38МКТ идеального газа
Основное уравнение МКТ газов
Основное уравнение МКТ можно записать в

другом виде, в котором давление связывается не с массой и скоростью молекулы, а с их комбинацией, то есть со средней кинетической энергией одной молекулы.
Слайд 39МКТ идеального газа
Температура и тепловое равновесие
Температура характеризует степень нагретости тела (холодное,

теплое, горячее). Для ее измерения был создан прибор, называемый термометром. В его устройстве использовано свойство тел изменять объем при нагревании или охлаждении.
Слайд 40МКТ идеального газа
Тепловое равновесие
Для измерения температуры тела человека нужно подержать медицинский

термометр под мышкой 5-8 мин. За это время ртуть в термометре нагревается и уровень ее повышается. По длине столбика ртути можно определить температуру. Термометр никогда не покажет температуру тела сразу же после того, как он соприкоснулся с ним. Необходимо некоторое время для того, чтобы температуры тела и термометра выровнялись и между телами установилось тепловое равновесие, при котором температура перестает изменяться.
Слайд 41МКТ идеального газа
Тепловое равновесие
Тепловое равновесие с течением времени устанавливается между любыми

телами, имеющими различную температуру. Бросьте в стакан с водой кусочек льда и закройте стакан плотной крышкой. Лед начнет плавиться, а вода охлаждаться. Когда лед растает, вода начнет нагреваться: после того как она примет температуру окружающего воздуха, никаких изменений внутри стакана с водой происходить не будет.
Слайд 42МКТ идеального газа
Тепловое равновесие
Тепловым равновесием называют такое состояние тел, при котором

все макроскопические параметры сколь угодно долго остаются неизменными. Это означает, что в системе не меняются объем и давление, не происходит теплообмен, отсутствуют взаимные превращения газов, жидкостей, твердых тел и т. д. В частности, не меняется объем столбика ртути в термометре, т. е. температура системы остается постоянной.
Слайд 43МКТ идеального газа
Определение температуры.
Энергия теплового движения молекул.
Из определения температуры следует, что она не

может быть колличественно измерена непосредственно и судить о ней можно по изменению других физических свойств тел (объема, давления, электрического сопротивления, интенсивности излучения и т.д.).
В зависимости от диапазона измеряемых температур различают две основные группы методов измерения: (см следующий слайд)
Слайд 44МКТ идеального газа
Определение температуры
контактные (собственно термометрия) - жидкостные, манометрические, термоэлектрические термометры, термометры сопротивления

и др.
безконтактные (пирометрия или термометрия излучения), применяемые в основном для измерения очень высоких температур - для измерения криогенных температур используются также газовые, акустические и магнитные термометры.
Слайд 45МКТ идеального газа
Контактные методы измерения температуры
Жидкостныйградусник
(рис. 1) термометр (рис.
ДОДЕЛАТЬ2)

Слайд 46МКТ идеального газа
Контактные методы измерения температуры
Механический термометр Манометрический термометр
(рис. 3) (рис.

4)
Слайд 47МКТ идеального газа
Бесконтактные методы измерения температуры
Инфракрасный пирометр | Оптический пирометр (рис.

5) (рис. 6)
Слайд 48МКТ идеального газа
Определение температуры
Кроме того, в системах, не требующих высокой точности измерений, в

определенном диапазоне температур широко используются полупроводниковые датчики температуры на диодах, транзисторах и специальных интегральных микросхемах.
Температура связана с субъективными ощущениями «тепла» и «холода», связанными с тем, отдаёт ли живая ткань тепло или получает его.
Абсолютная температурная шкала — шкала температур, в которой за начало отсчёта принят абсолютный нуль. Температура здесь обозначается буквой T и измеряется в кельвинах (К).
Слайд 49МКТ идеального газа
Определение температуры
Для перевода температуры из градусы Цельсия в Кельвины

необходимо прибавить 273 к результату измерений:
Абсолютный нуль – температура, при которой прекращается тепловое движение молекул.
Давление газа прямо пропорционально концентрации его молекул и абсолютной температуре Т.
Закон Авогадро – в равных объёмах газов при одинаковых температурах и давлениях содержится одинаковое число молекул.
Слайд 50МКТ идеального газа
Определение температуры

Слайд 51МКТ идеального газа
Энергия теплового движения молекул
При тепловом равновесии, если давление и

объём газа массой m постоянны, то средняя кинетическая энергия молекул газа должна иметь строго определённое значение, как и температура.
Формула для вычисления кинетической энергии молекул газа состоит из следующего:
Слайд 52МКТ идеального газа
Энергия теплового движения молекул
Если кинетическая энергия действительно одинакова для

всех газов в состоянии теплового равновесия, то и значение давления р должно быть тоже одинаково для всех газов при постоянном значении отношения объёма к числу молекул.
k = 1,38 • 10^-23 Дж/К - постоянная Больцмана.
Теперь выведем ещё одну зависимость температуры от средней кинетической энергии молекул. Из основного уравнения молекулярно-кинетической теории и уравнения для определения абсолютной температуры:
Слайд 53МКТ идеального газа
Энергия теплового движения молекул
Здесь видно, что левые части уравнений равны,

значит и правые равны тоже:
Слайд 54МКТ идеального газа
Энергия теплового движения молекул
Средняя кинетическая энергия хаотического поступательного движения

молекул газа пропорциональна абсолютной температуре.
Абсолютная температура есть мера средней кинетической энергии движения молекул.
Из выведенных формул мы можем получить выражение, которое показывает зависимость давления газа от концентрации молекул и температуры: (см следующий слайд).
Слайд 55МКТ идеального газа
Энергия теплового движения молекул
Из этой зависимости вытекает, что при одинаковых
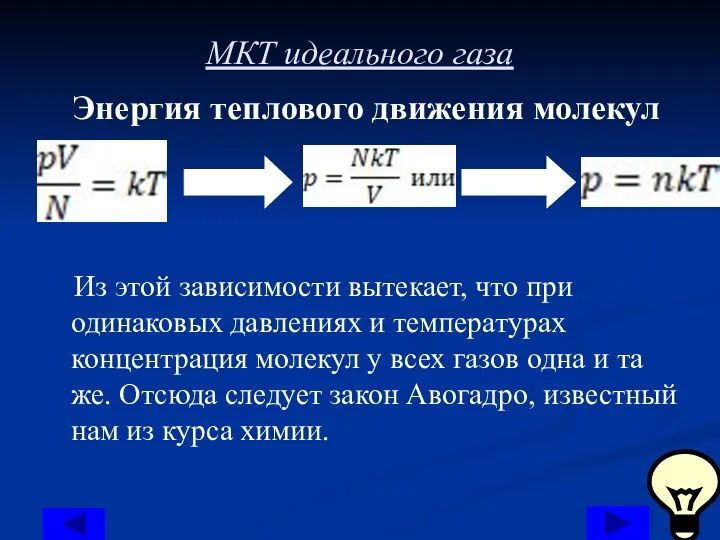
давлениях и температурах концентрация молекул у всех газов одна и та же. Отсюда следует закон Авогадро, известный нам из курса химии.
Слайд 56МКТ идеального газа
Измерение скоростей молекул газа
Уравнение даёт возможность найти

средний квадрат скорости движения молекулы. Подставив в это уравнение ,получим
выражение для среднего значения квадрата скорости:
Средней квадратичной скоростью называется величина:
Слайд 57МКТ идеального газа
Измерение скоростей молекул газа
Опыт Штерна
Прибор Штерна состоит из двух

цилиндров А и В, обладающих общей осью, жёстко связанных друг с другом (см. рис.). Цилиндры могут вращаться с постоянной угловой скоростью. Вдоль оси малого цилиндра натянута тонкая платиновая проволочка С, покрытая слоем серебра.
Слайд 58МКТ идеального газа
Измерение скоростей молекул газа
Опыт Штерна
По проволочке пропускают электрический ток.

В стенке этого цилиндра имеется узкая щель О. Воздух из цилиндров откачан. Цилиндр В находится при комнатной температуре. Вначале прибор неподвижен. При прохождении тока по нити она нагревается и при температуре 1200 °С атомы серебра испаряются. Внутренний цилиндр заполняется газом из атомов серебра. Некоторые атомы пролетают через щель О и, достигнув внутренней поверхности цилиндра В, осаждаются на ней. В результате прямо против щели образуется узкая полоска D серебра (рис. 9.7, б).
Слайд 59МКТ идеального газа
Измерение скоростей молекул газа
Опыт Штерна
Рисунок 9.7 (Б):
Затем цилиндры

приводят во вращение с большим числом оборотов n в секунду (до 1500 1/c).
Слайд 60МКТ идеального газа
Измерение скоростей молекул газа
Опыт Штерна
Теперь за время t, необходимое

атому для прохождения пути, равного разности радиусов цилиндров RB - RА, цилиндры повернутся на некоторый угол φ. В результате атомы, движущиеся с постоянной скоростью, попадают на внутреннюю поверхность большого цилиндра не прямо против щели О (рис. 9.7, в), а на некотором расстоянии s от конца радиуса, проходящего через середину щели (рис. 9.7, г): ведь атомы движутся прямолинейно. Рисунки изображены на следующем слайде.
Слайд 61МКТ идеального газа
Измерение скоростей идеального газа
Опыт Штерна
Если через «υB» обозначить модуль скорости вращения

точек поверхности внешнего цилиндра, то:
S = υBt = 2 πnRBt.
Слайд 62МКТ идеального газа
Измерение скоростей молекул газа
Опыт Штерна
Модули скоростей, определённые из опыта,

совпадают с теоретическим значением средней квадратичной скорости. Это служит экспериментальным доказательством справедливости формулы:
Следовательно и формулы , согласно которой средняя кинетическая энергия молекулы прямо пропорциональна абсолютной температуре.
Слайд 63Уравнение состояния идеального газа. Газовые законы.
Уравнение состояния идеального газа
Основным уравнением, описывающим поведение

идеального газа, является уравнение Менделеева-Клапейрона (уравнение состояния идеального газа):
Где P-давление газа; V-объём газа; m- масса газа;
M-молярная масса; Т- температура (Кельвин);
R- универсальная газовая постоянная (8,31 Дж/моль*К).
Слайд 64Уравнение состояния идеального газа. Газовые законы.
Уравнение Менделеева-Клапейрона можно написать в различных

формах. Например, в форме Больцмана:
p=nkT, где n=N/V - концентрация газа;
Важно знать, что R=kNa
Напоминаю, что все приведенные уравнения справедливы только для идеального газа (для реальных газов, близких к идеальным). В остальных случаях наблюдаются отклонения от газовых законов, вызванные взаимодействием молекул и конечностью их суммарного объема.
Слайд 65Уравнение состояния идеального газа. Газовые законы.
Газовые законы
Закон Бойля-Мариотта (изотермический процесс);
Закон Гей-Люссака (изобарный

процесс);
Закон Шарля (изохорный процесс);
Слайд 66Уравнение состояния идеального газа. Газовые законы.
Создатели газовых законов
Бойль-Мариот (рис. 1) Гей –

Люссак (рис. 2)
Слайд 67Создатели газовых законов
Жак Александр Сезар Шарль (рис. 3)

Слайд 68Уравнение состояния идеального газа. Газовые законы.
Закон Бойля-Мариотта (изотермический процесс)
Изотермическим процессом называют

изменение состояния газа, при котором его температура остаётся постоянной.
Для неизменной массы газа при постоянной температуре произведение давления газа на объем есть величина постоянная: pV = const
Этот же закон можно переписать в другом виде (для двух состояний идеального газа): p1V1=p2V2
Слайд 69Уравнение состояния идеального газа. Газовые законы.
Закон Бойля-Мариотта (изотермический процесс)
Предыдущее уравнение следует из:
Очевидно,

что при неизменной массе газа и при постоянной температуре правая часть уравнения остается постоянной величиной.
Графики зависимости параметров газа при постоянной температуре называются изотермами.
Слайд 70Уравнение состояния идеального газа. Газовые законы.
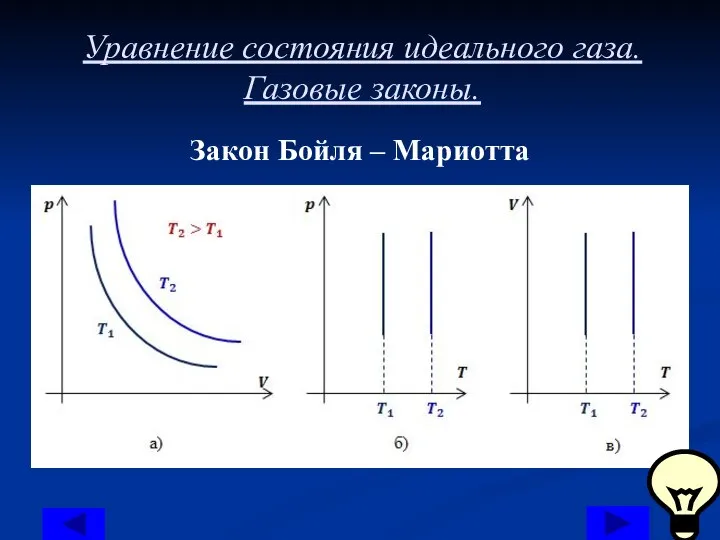
Закон Бойля – Мариотта
Обозначив константу буквой k1

, запишем функциональную зависимость давления от объема при изотермическом процессе: p=k1/V.
Видно, что давление газа обратно пропорционально его объему. Графиком обратной пропорциональности, а, следовательно, и графиком изотермы в координатах является гипербола (рис.1, а). На рис.1 б) и в) представлены изотермы в координатах и соответственно.
Слайд 71Уравнение состояния идеального газа. Газовые законы.
Закон Бойля – Мариотта
Слайд 72Уравнение состояния идеального газа. Газовые законы.
Закон Гей-Люссака (изобарный процесс)
Изобарным процессом называют

изменение состояния газа, при котором его давление остаётся постоянным.
Для неизменной массы газа при постоянном давлении отношение объема газа к температуре есть величина постоянная: V/T=const.
Этот закон также следует из уравнения Менделеева – Клапейрона:
Слайд 73Уравнение состояния идеального газа. Газовые законы.
Закон Гей – Люссака
Графики зависимости параметров

газа при постоянном давлении называются изобарами.
Рассмотрим два изобарных процесса с давлениями p1 и p2(p2>p1) . В координатах (p;T) и (p;V) изобары будут иметь вид прямых линий, перпендикулярных оси p (показано на рисунке далее).
Определим вид графика в координатах (V;T) .Обозначив константу буквой k2 , запишем функциональную зависимость объема от температуры при изобарном процессе:
Слайд 74Уравнение состояния идеального газа. Газовые законы.
Закон Гей – Люссака
V=k2T
Видно, что

при постоянном давлении объем газа прямо пропорционален его температуре. Графиком прямой пропорциональности, а, следовательно, и графиком изобары в координатах (V;T) является прямая, проходящая через начало координат (рис. «В») В реальности при достаточно низких температурах все газы превращаются в жидкости, к которым газовые законы уже неприменимы. Поэтому вблизи начала координат изобары (на рис «В») показаны пунктиром.
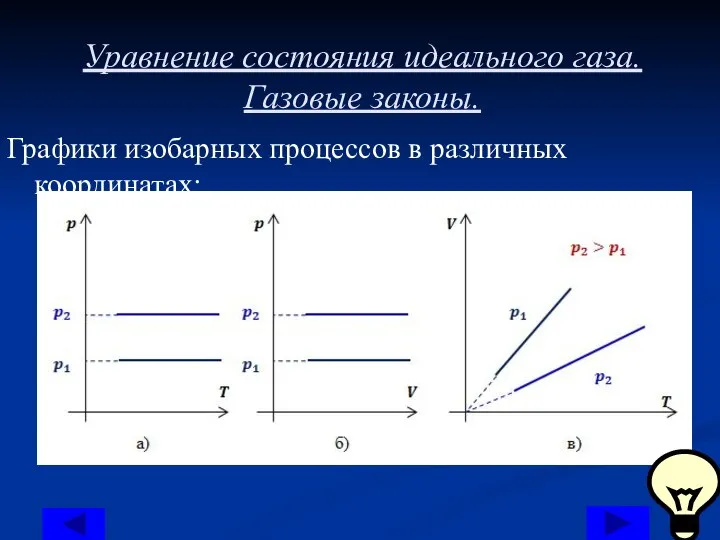
Слайд 75Уравнение состояния идеального газа. Газовые законы.
Графики изобарных процессов в различных координатах:
Слайд 76Уравнение состояния идеального газа. Газовые законы.
Закон Шарля (изохорный процесс)
Изохорным процессом называют

изменение состояния газа, при котором его объем остаётся постоянным.
Для неизменной массы газа при постоянном объеме отношение давления газа к его температуре есть величина постоянная: p/T=const.
Для двух состояний газа этот закон запишется в виде: p1/T1=p2/T2
Слайд 77Уравнение состояния идеального газа. Газовые законы.
Закон Шарля
Этот закон также можно получить

из уравнения Менделеева – Клапейрона:
Графики зависимости параметров газа при постоянном давлении называются изохорами.
Рассмотрим два изохорных процесса с объемами V1 и V2. В координатах (V;T) и (p;V) графиками изохор будут прямые, перпендикулярные оси V
(рис «А» и «Б»).
Слайд 78Уравнение состояния идеального газа. Газовые законы.
Закон Шарля
Для определения вида графика

изохорного процесса в координатах (p;T) обозначим константу в законе Шарля буквой k3, получим: p=k3T.
Таким образом, функциональная зависимость давления от температуры при постоянном объеме является прямой пропорциональностью, графиком такой зависимости является прямая, проходящая через начало координат (рис «В»).
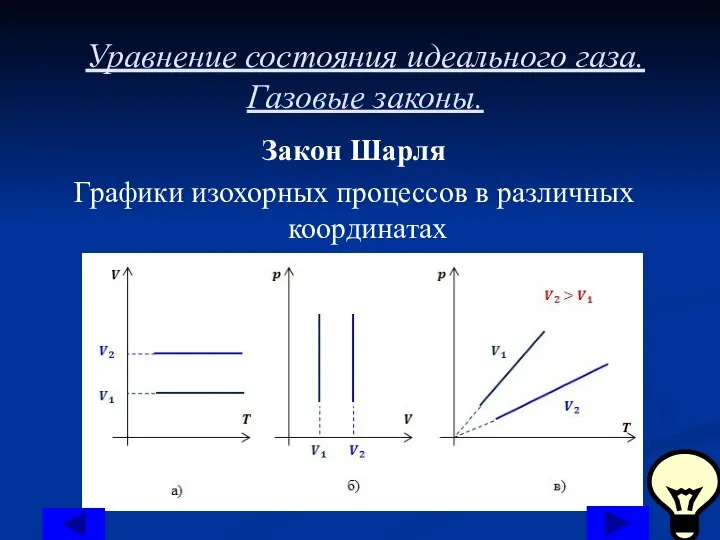
Слайд 79Уравнение состояния идеального газа. Газовые законы.
Закон Шарля
Графики изохорных процессов в различных координатах
Слайд 80Взаимные превращения жидкостей и газов
Насыщенный пар
Испарение:
Испарение - процесс превращения жидкости

в пар.
При испарении жидкость покидают более быстрые молекулы, поэтому средняя кинетическая энергия молекул жидкости уменьшается.
Процесс испарения происходит со свободной поверхности жидкости. Если лишить жидкость возможности испаряться, то охлаждение её будет происходить гораздо медленнее.
Слайд 81Взаимные превращения жидкостей и газов
Насыщенный пар
Плотно закрытый флакон с духами может стоять

очень долго, и количество духов в нём не изменится. Если же флакон оставить открытым, то через достаточно продолжительное время вы увидите, что жидкости в нём нет. Жидкость, в которой растворены ароматические вещества, испарилась. Гораздо быстрее испаряется (высыхает) лужа на асфальте, особенно если высока температура воздуха и дует ветер.
Слайд 82Взаимные превращения жидкостей и газов
Насыщенный пар
Процесс испарения:

Слайд 83Взаимные превращения жидкостей и газов
Насыщенный пар
Испарение капли:

Слайд 84Взаимные превращения жидкостей и газов
Насыщенный пар
Смочив руку какой-нибудь быстро испаряющейся жидкостью (например,

бензином или ацетоном), вы тут же почувствуете сильное охлаждение смоченного места. Охлаждение этого места усилится, если на руку подуть.
Слайд 85Взаимные превращения жидкостей и газов
Насыщенный пар
Конденсация:
Конденсация - процесс превращения пара

в жидкость.
При этом процессе число молекул, возвращающихся в жидкость за определённый промежуток времени, больше числа молекул, покидающих её.
Слайд 86Взаимные превращения жидкостей и газов
Насыщенный пар
Процесс конденсации:

Слайд 87Взаимные превращения жидкостей и газов
Насыщенный пар
Процесс конденсации:

Слайд 88Взаимные превращения жидкостей и газов
Насыщенный пар
Пар, находящийся в динамическом равновесии со своей

жидкостью, называют насыщенным паром.
В первый момент, после того как жидкость нальют в сосуд и закроют его, жидкость будет испаряться и плотность пара над ней будет увеличиваться. Однако одновременно с этим будет расти и число молекул, возвращающихся в жидкость. Чем больше плотность пара, тем большее число его молекул возвращается в жидкость. В результате в закрытом сосуде при постоянной температуре установится динамическое (подвижное) равновесие между жидкостью и паром.
Слайд 89Взаимные превращения жидкостей и газов
Насыщенный пар
Динамическое равновесие — это состояние, при котором число

молекул, покидающих поверхность жидкости за некоторый промежуток времени, будет равно в среднем числу молекул пара, возвратившихся за то же время в жидкость.
Для воды при комнатной температуре это число приблизительно равно 10^22 молекул за время, равное 1 с (на 1 см2 площади поверхности).

































































































 Теория пластин
Теория пластин Работа и мощность электрического тока
Работа и мощность электрического тока Скорость движения
Скорость движения Узгоджувальні пристрої. Лекція 2
Узгоджувальні пристрої. Лекція 2 Второе начало термодинамики. Принцип действия тепловой машины и ее КПД. Лекция 6
Второе начало термодинамики. Принцип действия тепловой машины и ее КПД. Лекция 6 Электрический ток
Электрический ток Энергетические установки в космосе
Энергетические установки в космосе Квантовая радиофизика
Квантовая радиофизика Презентация на тему Внутренняя энергия. Количество теплоты
Презентация на тему Внутренняя энергия. Количество теплоты  Система пуска двигателя
Система пуска двигателя Силы. Действие силы
Силы. Действие силы Презентация на тему Приливы, отливы, их использование 9 класс
Презентация на тему Приливы, отливы, их использование 9 класс  Допуски и посадки
Допуски и посадки Освещение. Свет и тень
Освещение. Свет и тень Электрическое сопротивление
Электрическое сопротивление Применение первого начала термодинамики к изопроцессам
Применение первого начала термодинамики к изопроцессам Дви́гатель вну́треннего сгора́ния (ДВС)
Дви́гатель вну́треннего сгора́ния (ДВС) Энергия топлива. Удельная теплота сгорания
Энергия топлива. Удельная теплота сгорания Цифровые измерительные приборы. Мультиметр
Цифровые измерительные приборы. Мультиметр Цепи переменного тока с последовательным соединением элементов
Цепи переменного тока с последовательным соединением элементов Основные Законы Природы
Основные Законы Природы Живой свет свечи
Живой свет свечи Преломление света. Физический смысл показателя преломления. Электромагнитные явления
Преломление света. Физический смысл показателя преломления. Электромагнитные явления Лед и соль!
Лед и соль! Дробилка безрешетная
Дробилка безрешетная Презентация на тему Перемещение при прямолинейном равноускоренном движении (9 класс)
Презентация на тему Перемещение при прямолинейном равноускоренном движении (9 класс)  Уравнение движения
Уравнение движения Изобретения, подсказанные природой
Изобретения, подсказанные природой