Содержание
- 2. S = Σnі Sі (Т) – RΣnі ln сі S = Σnі Sі (Т) – RΣnі
- 3. F = Σnі Fі (Т) + RТ Σnі ln сі F = Σnі Fі' (Т, p)
- 4. Зависимость химического потенциала компонента от концентрации
- 5. μі = g(Т) + RT ln cі μі = g′(Т) + RT ln pі μі =
- 6. μі =μі(Т) + RT ln fі Σnі dμі = RT Σnі dln fі = 0 Σnі
- 7. Идеальные, предельно разбавленные и неидеальные растворы
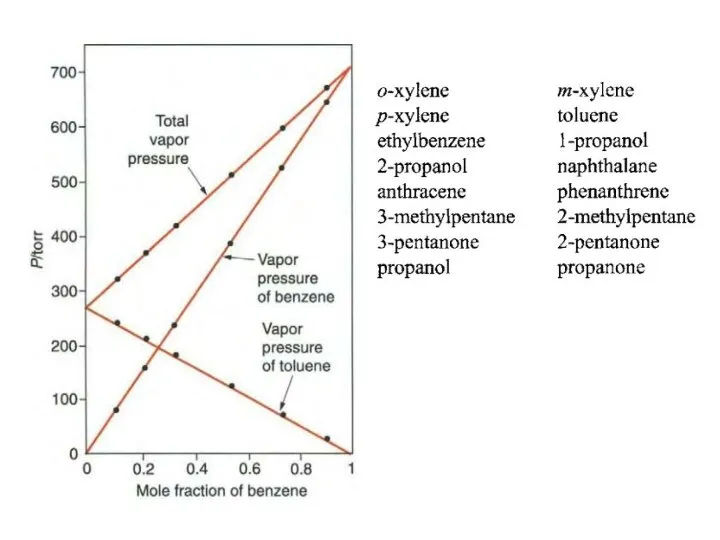
- 8. Равновесие жидкий раствор – насыщенный пар закон Рауля рі = pi°xi
- 9. х2 ≡ х = х Для бинарного раствора:
- 11. Σхі dln fі = 0; (1 – х) dln f1 + xdlnf2= 0 lnf2 = lnx
- 12. Phil. Trans. R. Soc. London, January 1, 1803, 93 P.29-42;
- 14. Скачать презентацию










 Пузырьковая камера
Пузырьковая камера Вещества и явления в окружающем мире
Вещества и явления в окружающем мире Колебания математического и пружинного маятников
Колебания математического и пружинного маятников Паровая машина Ползунова
Паровая машина Ползунова Дополнительное оборудование
Дополнительное оборудование Автономные инверторы
Автономные инверторы T1klsAl4UwZclqq9KGDB6w
T1klsAl4UwZclqq9KGDB6w Сравнение эксплуатационных характеристик lada vestaи и lada xray
Сравнение эксплуатационных характеристик lada vestaи и lada xray Гальванические источники
Гальванические источники Сравнение сил. 7класс
Сравнение сил. 7класс Модели молекул простого и сложного вещества
Модели молекул простого и сложного вещества Гидродинамика. Движение жидкости
Гидродинамика. Движение жидкости Особенности гидродинамики потока во входном участке активной зоны реактора PWR с тепловыделяющими сборками ТВС-Квадрат
Особенности гидродинамики потока во входном участке активной зоны реактора PWR с тепловыделяющими сборками ТВС-Квадрат Работа, мощность и энергия
Работа, мощность и энергия Недомолвки в теории и недостатки в практике регистрации частичных разрядов
Недомолвки в теории и недостатки в практике регистрации частичных разрядов Полупроводниковые лазеры, их особенности
Полупроводниковые лазеры, их особенности Космология Ньютона. Часть 2. Физика космоса
Космология Ньютона. Часть 2. Физика космоса Напряжения в эллиптической оболочке, соединенной с цилиндром
Напряжения в эллиптической оболочке, соединенной с цилиндром Сцепление ГАЗ 53-12. Урок №70
Сцепление ГАЗ 53-12. Урок №70 Презентация на тему: основы термодинамики
Презентация на тему: основы термодинамики Автомобили III
Автомобили III Виды ионизирующего излучения и основные понятия дозиметрии
Виды ионизирующего излучения и основные понятия дозиметрии Сингулярность. Сингулярные конфигурации
Сингулярность. Сингулярные конфигурации Давление газа
Давление газа Дирижаблестроение. Тема № 1
Дирижаблестроение. Тема № 1 Криволинейное движение. Движение тела по окружности
Криволинейное движение. Движение тела по окружности Внутренняя энергия
Внутренняя энергия Колесный бульдозер
Колесный бульдозер