Слайд 2Повторение
Число электронов в атоме элемента = числу протонов = заряду ядра атома

= порядковому номеру элемента.
Электроны в атомах располагаются слоями; число слоёв (энергетических уровней) = номеру периода, в котором находится элемент.
Слайд 3Повторение
Число электронов в наружном слое атомов элементов = номеру группы, в котором

находится элемент. (Для элементов главных подгрупп)
Электроны движутся вокруг ядра с огромной скоростью по орбиталям. Часть пространства, где наиболее вероятно нахождение электрона, называют электронным облаком.
Слайд 4Распределение электронов по уровням
N=2n2 формула для вычисления количества электронов на энергетических уровнях.
1Й

уровень - 2 электрона.
2Й уровень - 8 электронов.
3Й уровень - 18 электронов.
4Й уровень - 32 электрона.
Слайд 5Распределение электронов по уровням
1 уровень:
2ē

Слайд 6Распределение электронов по уровням
1 уровень: 2ē
2 уровень:8ē

Слайд 7Распределение электронов по уровням
1 уровень-2
2 уровень-8
3 уровень-18

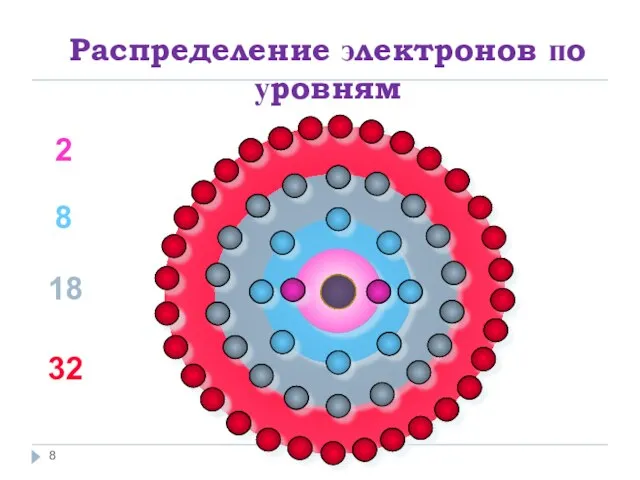
Слайд 8Распределение электронов по уровням
2
8
18
32
Слайд 9s- электронное облако
Форма s-электронного облака - шар. На нем 1-2 электрона.

Слайд 10p- электронное облако
Форма p-электронного облака - объёмная восьмёрка. На нем от 1

до 6 электронов.
Слайд 11d- электронное облако
Форма d-электронных облаков - две объемные восьмёрки. На нем от

1 до 10 электронов.
Слайд 12f- электронное облако
Форма f-электронных облаков сложная и в школьных учебниках не приводится.

На них от 1 до 14 электронов.
Слайд 13Атом водорода
Электрон этого атома при вращении образует сферическое облако.
+1 Н )1 это

схема строения атома. Здесь на первом месте - заряд ядра, на втором месте - химическое обозначение, далее - одна орбиталь и электроны на ней.
1s1 это электронная формула атома.
Слайд 14Атом гелия
+2 Не )2 это схема строения атома.
1s2 это электронная формула атома.
Здесь

два s-электрона. Облака их одинаковой формы и при совмещении образуют общее двухэлектронное облако.
Про такие электроны говорят, что они спарены.
Слайд 15Атом лития
+3 Li )2)1 это схема строения атома.
1s2 2s1 это электронная формула.

Элемент располагается во втором периоде, имеет два электронных слоя.
Слайд 16Атом бериллия
+4 Be )2 )2 это схема строения атома.
1s2 2s2 это электронная

формула.
В этом атоме имеется два спаренных s-электрона во внутреннем слое и два спаренных s-электрона в наружном.
Слайд 17Атом углерода
+6 С ) 2 ) 4 схема строения атома.
1s2 2s 2

2p2 электронная формула.
В обычном состоянии атом углерода двухвалентен.
1s2 2s 1 2p3
В возбужденном состоянии (получил дополнительное количество энергии) атом углерода четырёхвалентен.
Слайд 18Атом хлора
+17 Cl )2 )8 )7 схема строения атома.
1s2 2s2 2p6 3s2

3p5 это электронная формула.
Атом располагается в III периоде, и имеет три энергетических уровня.
Атом располагается в VII группе, главной подгруппе - на внешнем энергетическом уровне 7 электронов.
Слайд 19Заключение
Существуют s, p, d, f электроны.
Электроны располагаются вокруг ядра слоями (уровнями).

Электроны распределяются по уровням 2, 8, 18, 32.


















 Подвеска
Подвеска T1klsAl4UwZclqq9KGDB6w
T1klsAl4UwZclqq9KGDB6w Червячные передачи
Червячные передачи Выдающиеся физики
Выдающиеся физики Связь с подводными лодками
Связь с подводными лодками Методы регистрации элементарных частиц
Методы регистрации элементарных частиц Подстанция переменного тока Промузел 110/35/6 кВ
Подстанция переменного тока Промузел 110/35/6 кВ Решение задач по теме Длина волны. Скорость распространения волн
Решение задач по теме Длина волны. Скорость распространения волн АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ С РЕАКТОРАМИ НА БЫСТРЫХ НЕЙТРОНАХ
АТОМНЫЕ ЭЛЕКТРОСТАНЦИИ С РЕАКТОРАМИ НА БЫСТРЫХ НЕЙТРОНАХ Физический океан
Физический океан Равноускоренное движение. Ускорение
Равноускоренное движение. Ускорение Движение жидкостей и газов. Закон Бернулли
Движение жидкостей и газов. Закон Бернулли Демонстрационный вариант контрольных измерительных материалов для проведения в 2014 году государственной аттестации по физике
Демонстрационный вариант контрольных измерительных материалов для проведения в 2014 году государственной аттестации по физике Расчет размерных цепей
Расчет размерных цепей Презентация на тему Релятивистская динамика
Презентация на тему Релятивистская динамика  Организация технического обслуживания и диагностики с разработкой шиномонтажного стенда
Организация технического обслуживания и диагностики с разработкой шиномонтажного стенда Магнитное поле кругового тока
Магнитное поле кругового тока Песочные часы. Изменение массы песочных часов
Песочные часы. Изменение массы песочных часов Коррекция систем
Коррекция систем Электричество и магнетизм. Лекция № 3
Электричество и магнетизм. Лекция № 3 Импульс тела . Закон сохранения импульса
Импульс тела . Закон сохранения импульса Решение задач по физике
Решение задач по физике Презентация на тему Путь. Перемещение. Координаты движущегося тела
Презентация на тему Путь. Перемещение. Координаты движущегося тела  Лекция 2 (Классификация САУ)
Лекция 2 (Классификация САУ) Викторина по физике (9 класс)
Викторина по физике (9 класс) Итоговая контрольная работа
Итоговая контрольная работа Оптика и квантовая физика для студентов 2 курса ФТФ и ГГФ
Оптика и квантовая физика для студентов 2 курса ФТФ и ГГФ Вязко-упругие свойства суспензий наночастиц
Вязко-упругие свойства суспензий наночастиц