Слайд 8Циклические процессы
Термодинамический процесс называется циклическим, если после его выполнения термодинамическая система возвращается

в исходное состояние. Эти процессы составляют принципиальную основу действия тепловых машин. В общих чертах их работу можно описать следующим образом. Есть некий источник тепловой энергии, условно называемый нагревателем. В большинстве случаев этим источником является химическая реакция сгорания топлива. За счет этой энергии совершается механическая работа – допустим перемещение поршня идеальным газом. По ее окончании машину необходимо вернуть в исходное состояние. Для этого используется некоторая внешняя сила, которая, например, сжимает газ, совершая при этом работу. При этом часть тепла, полученная от нагревателя и не израсходованная на работу, передается холодильнику. В большинстве случаев холодильником служит окружающая среда.
Слайд 11Циклические процессы
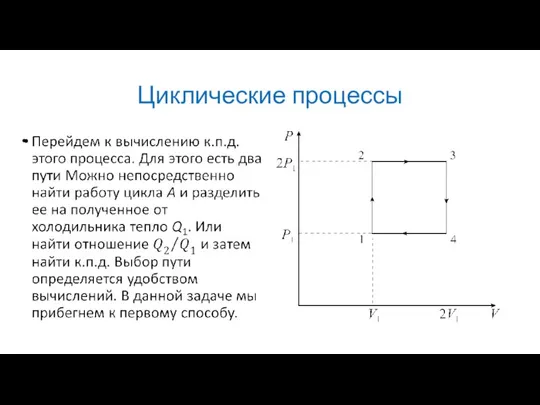
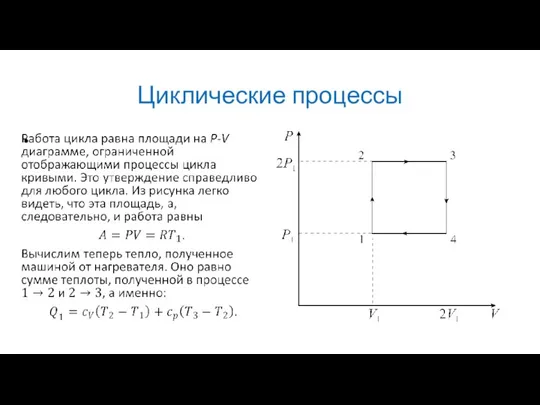
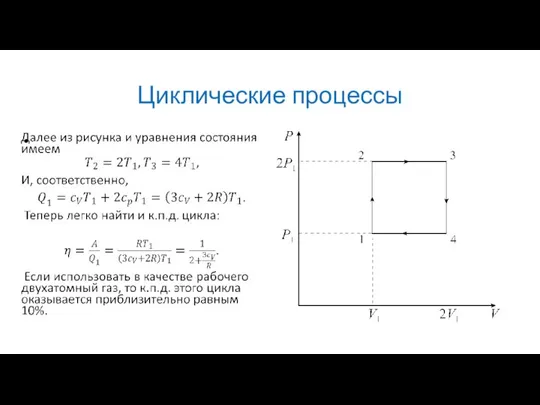
В качестве примера рассмотрим простейший цикл состоящий из двух изобар и
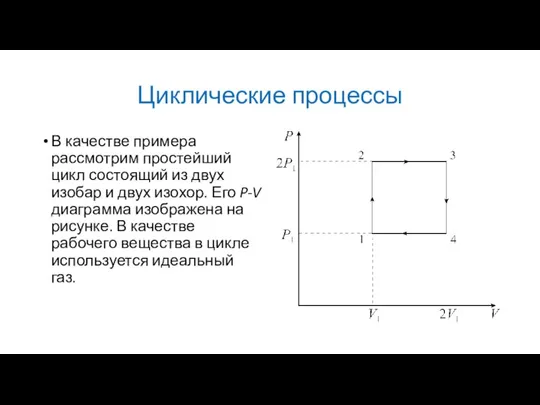
двух изохор. Его P-V диаграмма изображена на рисунке. В качестве рабочего вещества в цикле используется идеальный газ.
Слайд 16Двигатель внутреннего сгорания
Рассмотрим термодинамический цикл работы реальной тепловой машины – двигателя внутреннего

сгорания. Его изобрел в 1876 году немецкий инженер Николаус Отто, а Готлиб Даймлер и Карл Бенц применили его в автомобилестроении. С тех пор он не претерпел принципиальных изменений.
Слайд 17Двигатель внутреннего сгорания
Рабочий цилиндр двигателя имеет в своем составе поршень, соединенный с

коленчатым валом, преобразующим поступательное движение поршня во вращательное, которое в конце концов через трансмиссию передается колесам. В верхней части двигателя находятся два клапана: впускной – он служит для впуска в цилиндр смеси бензина и воздуха, и выпускной – для выпуска отработанных газов. Там же расположена свеча зажигания (на схеме не изображена).
Слайд 18Двигатель внутреннего сгорания
Порядок работы двигателя следующий: В начале работы поршень находится в

верхнем положении и начинает двигаться вниз (процесс 5-4). В это время впускной клапан открыт и в цилиндр с помощью атмосферного давления поступает бензиново-воздушная смесь. Давление в цилиндре в это время равно атмосферному и это процесс отображается на P-V диаграмме прямой горизонтальной линией. Следующий процесс –сжатие, процесс 4-1. Поршень, толкаемый коленчатым валом, идет вверх сжимая горючую смесь, оба клапана закрыты. Поскольку движения поршня происходят быстро, теплообмен газа со стенками мал, процесс можно считать адиабатическим. Когда поршень достигает верхнего положения, в свече зажигания инициируется высоковольтный электрический разряд, поджигающий рабочую смесь. Бензиново-воздушная смесь сгорает очень быстро, объем за это время практически не меняется, и мы вправе представлять этот процесс изохорическим нагревом 1-2.
Слайд 19Двигатель внутреннего сгорания
Следующий процесс – рабочий ход поршня (2-3). При закрытых клапанах

газ расширяется, толкая поршень, который через коленчатый вал и трансмиссию вращает колеса и перемещает остальные три цилиндра четырехтактного двигателя. Затем открывается выпускной клапан, и при постоянном объеме давление в цилиндре падает до атмосферного. Этот процесс (3-4) мы аппроксимируем изотермическим охлаждением. В процессе (4-5) поршень идет вверх при открытом выпускном клапане, выталкивая отработанные газы в выхлопную трубу.
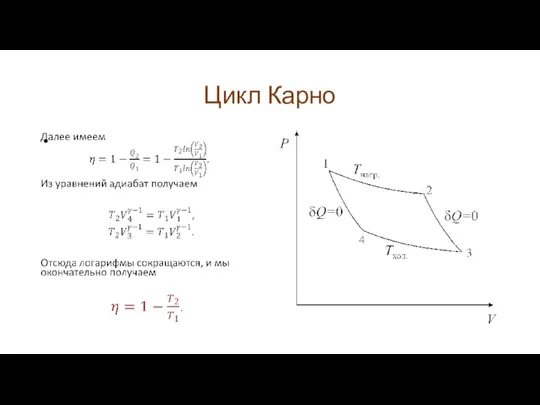
Слайд 23Цикл Карно
Рассмотрим теперь машину Карно, работающую по замкнутому циклу, который носит название

цикла Карно. Не будет преувеличением сказать, что цикл Карно и следующие из него выводы являются краеугольным камнем термодинамики и крайне важны для ее понимания.
Слайд 24Цикл Карно
Рабочим веществом в машине Карно является идеальный газ. Все процессы цикла

являются квазистатическими. В процессе 1-2 газ, изотермически расширяясь, совершает работу. Для поддержания температуры постоянной к нему подводят тепло от нагревателя. Процесс 2-3 – адиабатический, газ совершает работу за счет внутренней энергии, тепло не подводится. В процессе 3-4 мы изотермически сжимаем газ, отдавая тепло холодильнику. Затем (процесс 4-1) мы с помощью адиабатического процесса возвращаем газ в исходное состояние.
Слайд 27Цикл Карно
Таким образом, к.п.д. цикла Карно зависит только от температур холодильника и

нагревателя. В дальнейшем мы покажем, что не существует двигателя, работающего между температурами T1 и T2 и имеющего к.п.д больший, чем у машины Карно. Подчеркнем еще раз: к.п.д. машины Карно – максимально возможный для данного отношения температур холодильника и нагревателя.
Слайд 28Холодильная машина, тепловой насос

Слайд 29Холодильная машина, тепловой насос

Слайд 30Холодильная машина, тепловой насос

Слайд 31Холодильная машина, тепловой насос
В тепловом насосе за счет произведенной работы также происходит

перенос тепла от источника с низкой температурой к резервуару с более высокой температурой. От холодильной машины тепловой насос отличается тем, что целью его работы служит не охлаждение тела путем отнятия теплоты, а нагревание полезного пространства (обычно помещения). При этом охлаждается какой-нибудь значительный по массе объект (например, грунт возле дома или близлежащий водоем). Типичное отношение произведенного тепла к затраченной энергии (т.е. коэффициент ε) для используемых на практике тепловых насосов лежит обычно в диапазоне от 2,5 до 5. Это означает, что, например, на 1 кВт затраченной (электрической) энергии тепловой насос производит от 2,5 до 5 кВт тепловой энергии.
Слайд 32Второе начало термодинамики
Второе начало термодинамики, также, как и первое, является обобщением экспериментальных

данных и наблюдений за термодинамическими процессами. Первым над этими вопросами задумался Сади Карно. Ясную и четкую формулировку второго начала дали в 1850 – 1851 гг. независимо друг от друга немецкий физик Р. Клаузиус и шотландский физик В. Томсон.
Слайд 33Второе начало термодинамики
Формулировка Томсона:
«Невозможен круговой процесс, единственным результатом которого было бы производство

работы за счет охлаждения теплового резервуара».
В формулировке существенно указание, что процесс должен быть круговым. В самом деле, например, газ, изотермически расширяясь, способен производить работу за счет внутренней энергии, но двигателя на основе этого процесса не создать.
Слайд 34Второе начало термодинамики
Формулировка Клаузиуса:
«Теплота не может самопроизвольно переходить от тела менее

нагретого к телу более нагретому».
В этой формулировке имеет значение слово «самопроизвольно», т.е. без совершения работы. В противном случае, как мы только что видели на примере холодильной машины, переход тепла к более нагретому телу возможен.
Слайд 35Эквивалентность формулировок второго начала термодинамики

Слайд 36Эквивалентность формулировок второго начала термодинамики

Слайд 37Эквивалентность формулировок второго начала термодинамики
Из формулировки Клаузиуса следует формулировка Томсона.
Пусть возможен

круговой процесс, единственным результатом которого было бы производство работы за счет охлаждения теплового резервуара. Если с помощью этой проводить обратный цикл холодильной машины, то получится, что в результате теплота перейдет от менее нагретого тела к более нагретому. Других изменений не происходит. Но это есть нарушение формулировки Клаузиуса.
Таким образом, обе формулировки второго начала термодинамики эквивалентны.
Слайд 38Эквивалентность формулировок второго начала термодинамики
Существуют и другие формулировки второго начала. Одной из

них является принцип Карно, который гласит, что к.п.д. машины, работающей по обратимому циклу Карно, не зависит от природы рабочего вещества и устройства машины, а определяются только температурами нагревателя и холодильника. При этом к.п.д. необратимой машины, имеющей те же самые тепловые резервуары, меньше к.п.д. обратимого цикла Карно. Доказательство этого положения строится на рассуждениях, аналогичным предыдущим рассуждениям об эквивалентности двух формулировок второго начала, и мы их здесь опускаем.
Слайд 46Энтропия
Рассмотрим это на примере необратимое расширения газа. Пусть в цилиндре в одной

его половине объёмом V1 находится идеальный газ при температуре T1, во второй половине, отделенной тонкой, хрупкой перегородкой вакуум. Перегородка мгновенно ломается, и газ занимает весь объём. Это процесс называется процессом Гей-Люсака
Слайд 49Термодинамические потенциалы
Используя функцию состояния – энтропию – мы можем ввести еще четыре

функции состояния. Их называют термодинамическими потенциалами, и они по существу представляют собой формальный аппарат термодинамики, с помощью которого удобно исследовать реальные термодинамические системы. С механической потенциальной энергией их объединяет то свойство, что термодинамические потенциалы замкнутой системы стремятся к минимуму. Иными словами, система устойчива при минимуме термодинамического потенциала.
Слайд 52Свободная энергия и Потенциал Гиббса

Слайд 55Применение соотношений Максвелла

Слайд 56Химический потенциал
Естественные переменные термодинамических потенциалов делятся на экстенсивные (V, S) и интенсивные

(T, P). Экстенсивные переменные меняются, при делении системы на части, а значит, зависят и от количества частиц. Интенсивные переменные от количества частиц не зависят.
Замечательным свойством потенциала Гиббса является то, что его естественными переменными являются интенсивные давление и температура.






















































 Перший закон термодинаміки
Перший закон термодинаміки Основные понятия и задачи кинематики (продолжение)
Основные понятия и задачи кинематики (продолжение) Средства связи: принцип действия, виды, назначение
Средства связи: принцип действия, виды, назначение Работа с lego mindstorms ev3. Задание № 1: движение вперед и назад
Работа с lego mindstorms ev3. Задание № 1: движение вперед и назад Плотность. Плотность мрамора
Плотность. Плотность мрамора Сущность фотометрических методов
Сущность фотометрических методов ИК-спектроскопия (часть 1)
ИК-спектроскопия (часть 1) 1.Силы, действующие в жикости. Режимы движения
1.Силы, действующие в жикости. Режимы движения Перспективный бортовой водородный стандарт частоты космического применения
Перспективный бортовой водородный стандарт частоты космического применения Решение задач на одновременное движение всех видов
Решение задач на одновременное движение всех видов Операторы
Операторы 11кл. Электромагн индукция (3)
11кл. Электромагн индукция (3) Механика. Твердые тела. Явления переноса
Механика. Твердые тела. Явления переноса Полупроводниковые лазеры, их особенности
Полупроводниковые лазеры, их особенности Двигатели для радиоуправляемых автомоделей
Двигатели для радиоуправляемых автомоделей Микромир элементарных частиц
Микромир элементарных частиц Аварийные источники электрической энергии. Аккумуляторы. RAT
Аварийные источники электрической энергии. Аккумуляторы. RAT Свободное падение тел. Движение точки по окружности
Свободное падение тел. Движение точки по окружности 4
4 Коэффициент полезного действия (КПД) тепловых двигателей
Коэффициент полезного действия (КПД) тепловых двигателей Магнитное поле
Магнитное поле Исследование эксплуатационных характеристик энергетической установки с ДВС 2Ч 8,5х11 при работе в газодизельном цикле
Исследование эксплуатационных характеристик энергетической установки с ДВС 2Ч 8,5х11 при работе в газодизельном цикле В поисках нейтрино или Частица-Призрак
В поисках нейтрино или Частица-Призрак Поле тяготения
Поле тяготения Машинная игла. 5 класс. III четверть
Машинная игла. 5 класс. III четверть Колебательный контур. Превращение энергии при электромагнитных колебаниях
Колебательный контур. Превращение энергии при электромагнитных колебаниях Тепловые явления
Тепловые явления Реактивное движение
Реактивное движение