Содержание
- 2. Термодинамика – теория тепловых явлений, в которой не учитывается молекулярное строение тел. Выводы термодинамики опираются на
- 3. Если термодинамическая система была подвержена внешнему воздействию, то в конечном итоге она перейдет в другое равновесное
- 4. Если процесс протекает достаточно медленно (в пределе бесконечно медленно), то система в каждый момент времени оказывается
- 5. С точки зрения молекулярно-кинетической теории внутренняя энергия вещества = кинетическая энергия всех атомов и молекул +
- 6. ВЫВОД: внутренняя энергия U тела определяется макроскопическими параметрами, характеризующими состояние тела.
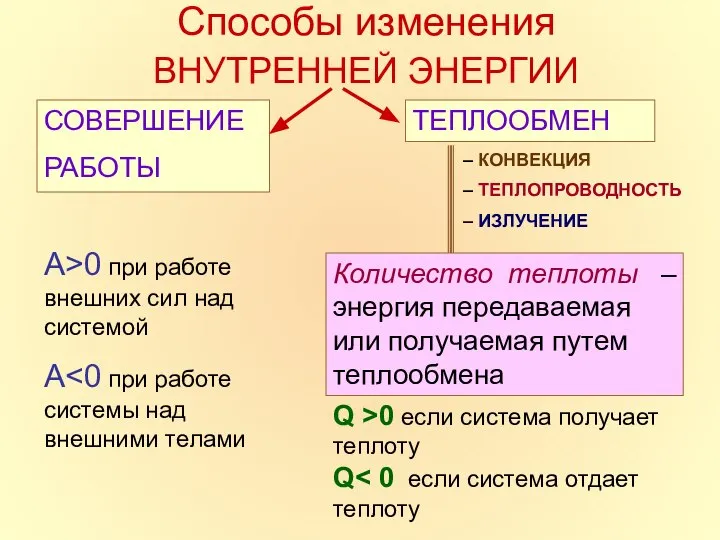
- 7. Способы изменения ВНУТРЕННЕЙ ЭНЕРГИИ СОВЕРШЕНИЕ РАБОТЫ ТЕПЛООБМЕН – КОНВЕКЦИЯ – ТЕПЛОПРОВОДНОСТЬ – ИЗЛУЧЕНИЕ Количество теплоты –
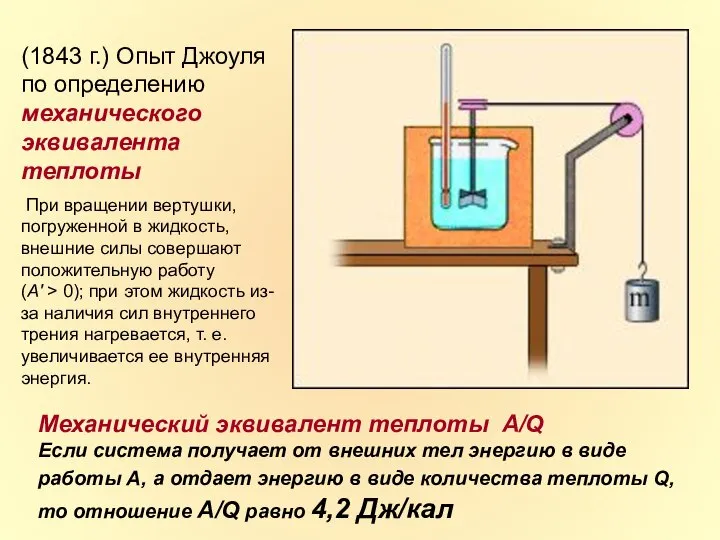
- 8. (1843 г.) Опыт Джоуля по определению механического эквивалента теплоты При вращении вертушки, погруженной в жидкость, внешние
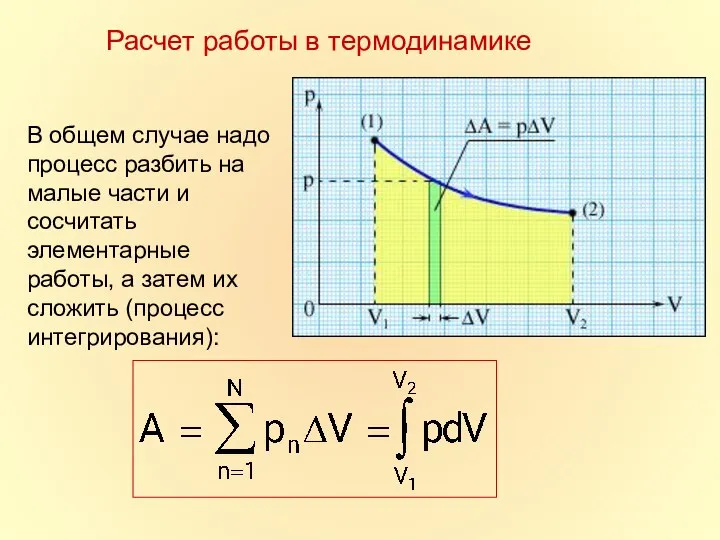
- 9. Расчет работы в термодинамике
- 10. В общем случае надо процесс разбить на малые части и сосчитать элементарные работы, а затем их
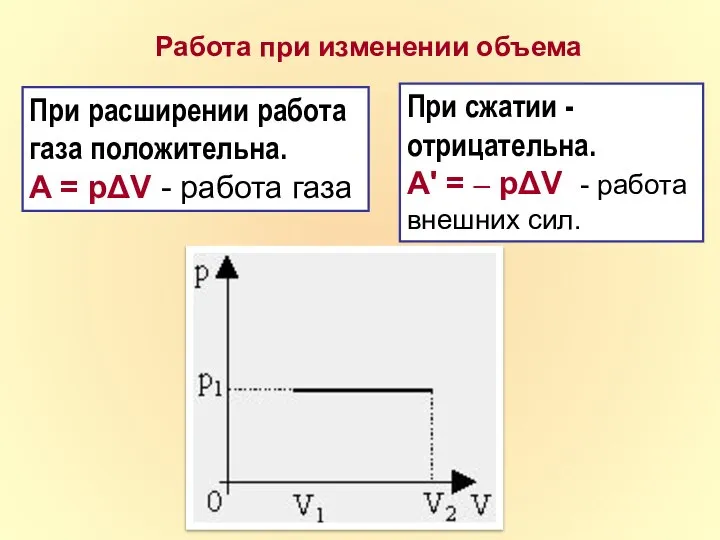
- 11. Работа при изменении объема При расширении работа газа положительна. A = pΔV - работа газа При
- 12. Используя уравнение Менделеева-Клапейрона, получим:
- 13. в изотермическом процессе .
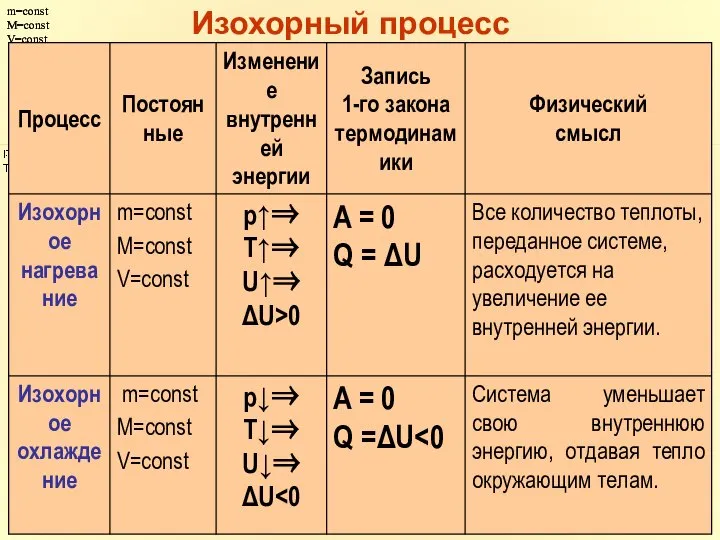
- 14. В изохорном процессе объем не меняется, следовательно, в изохорном процессе работа не совершается!
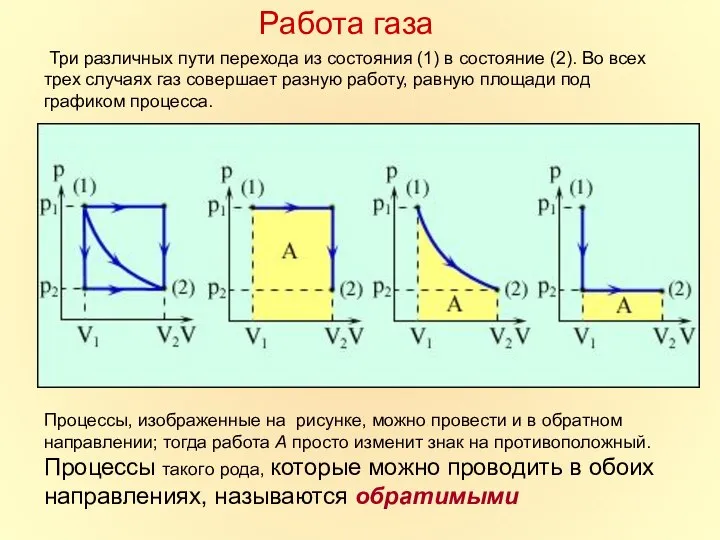
- 15. Три различных пути перехода из состояния (1) в состояние (2). Во всех трех случаях газ совершает
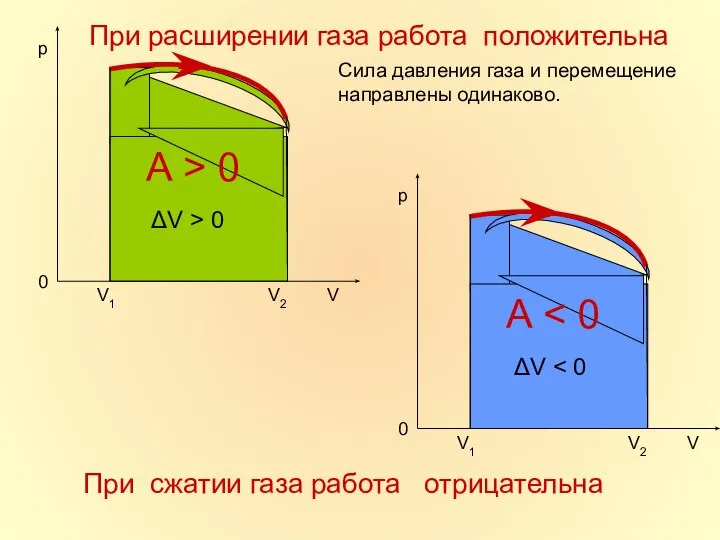
- 16. При расширении газа работа положительна Сила давления газа и перемещение направлены одинаково. При сжатии газа работа
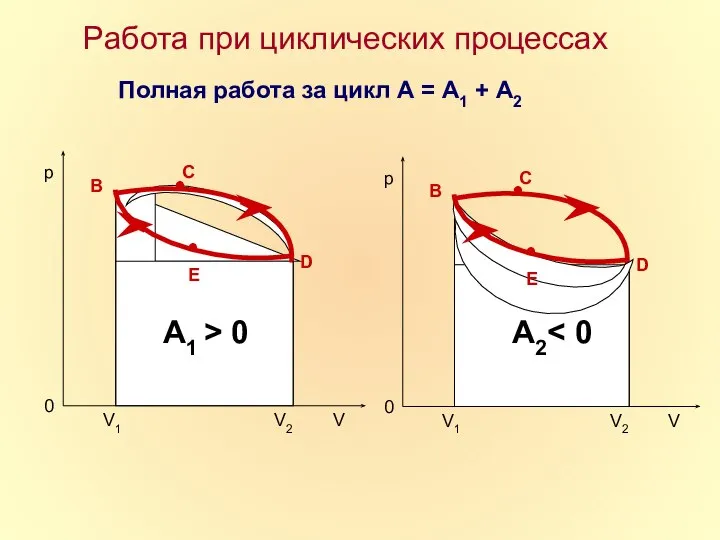
- 17. Работа при циклических процессах Полная работа за цикл А = А1 + А2
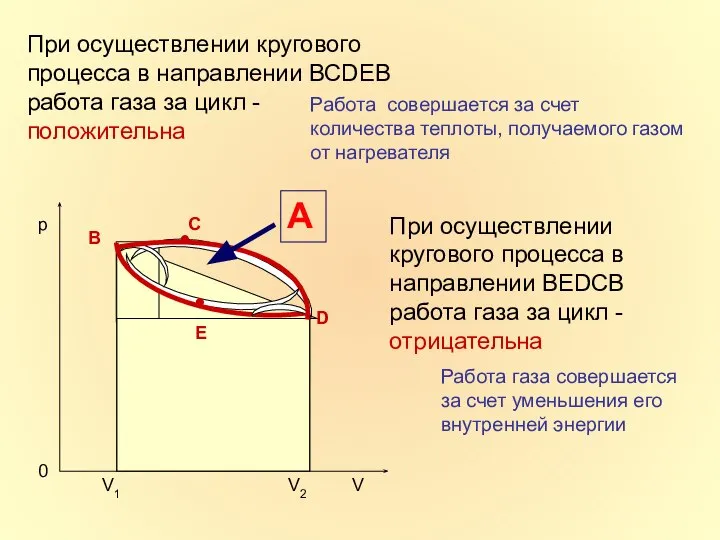
- 18. При осуществлении кругового процесса в направлении ВСDЕВ работа газа за цикл - положительна А При осуществлении
- 19. Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Изменение ΔU внутренней
- 20. Другая форма записи соотношение, выражающего первый закон термодинамики: Количество теплоты, полученное системой, идет на изменение ее
- 21. Первый закон термодинамики является обобщением опытных фактов. Согласно этому закону, энергия не может быть создана или
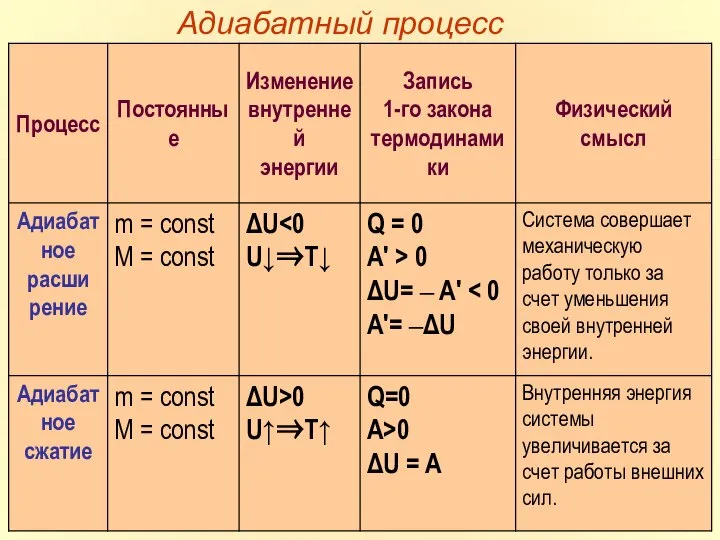
- 22. АДИАБАТНЫЙ ПРОЦЕСС
- 23. Наряду с изохорным, изобарным и изотермическим процессами в термодинамике часто рассматриваются процессы, протекающие в отсутствие теплообмена
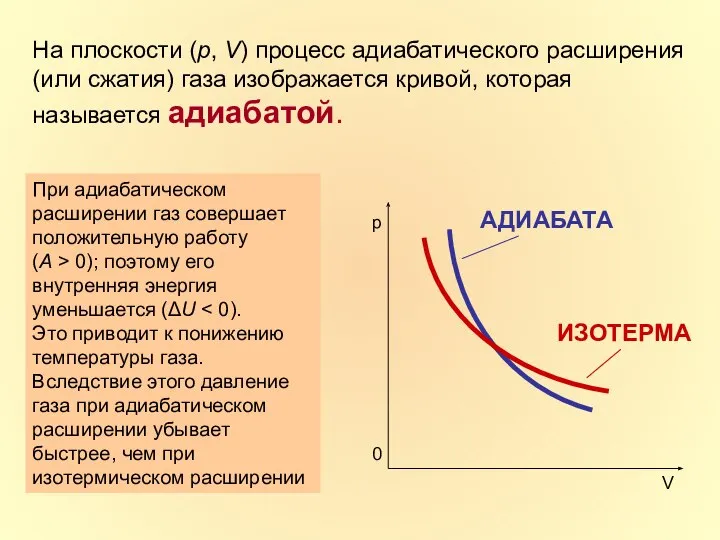
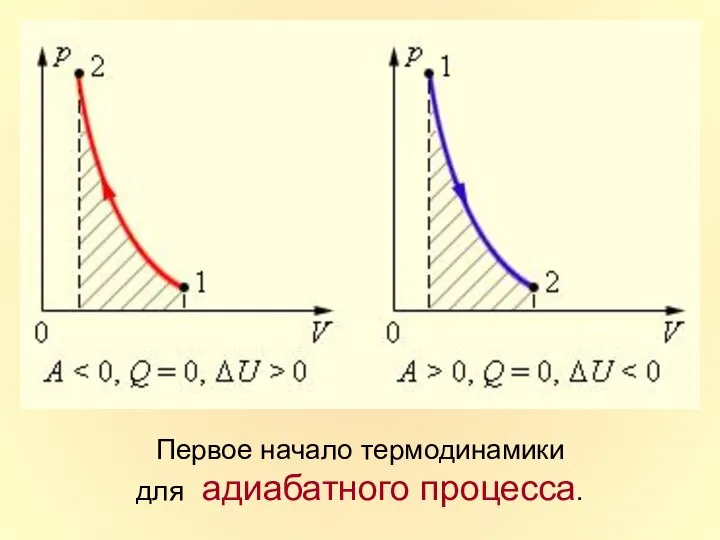
- 24. На плоскости (p, V) процесс адиабатического расширения (или сжатия) газа изображается кривой, которая называется адиабатой. При
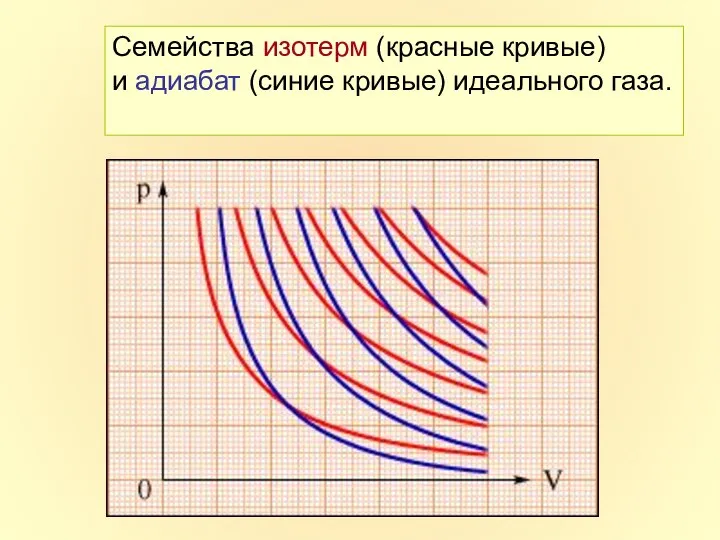
- 25. Семейства изотерм (красные кривые) и адиабат (синие кривые) идеального газа.
- 26. Опыт "воздушное огниво". Возьмем толстостенный стеклянный цилиндр с поршнем. На дно цилиндра насыплем измельченной "серы" от
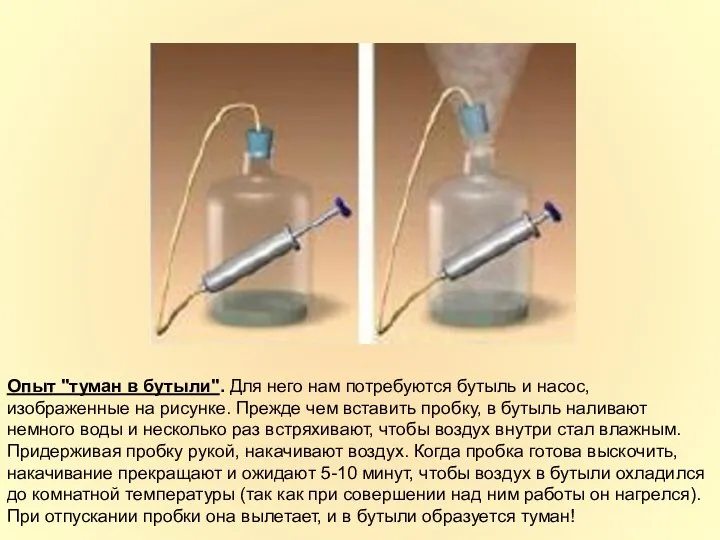
- 27. Опыт "туман в бутыли". Для него нам потребуются бутыль и насос, изображенные на рисунке. Прежде чем
- 28. ПРИМЕНЕНИЕ ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ К РАЗЛИЧНЫМ ПРОЦЕССАМ
- 29. ı закон термодинамики Q = ΔU + A Изобарный процесс A = p ΔV Изотермический процесс
- 30. Изотермический процесс
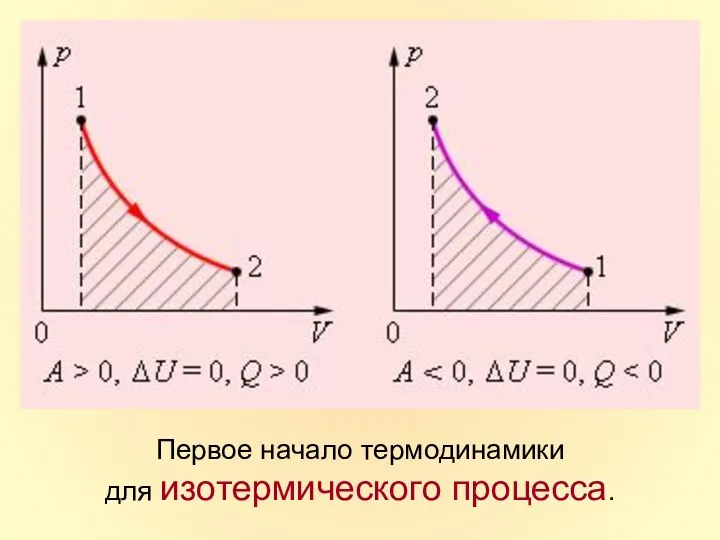
- 31. Первое начало термодинамики для изотермического процесса.
- 32. m=const M=const V=const m=const M=const V=const Изохорный процесс
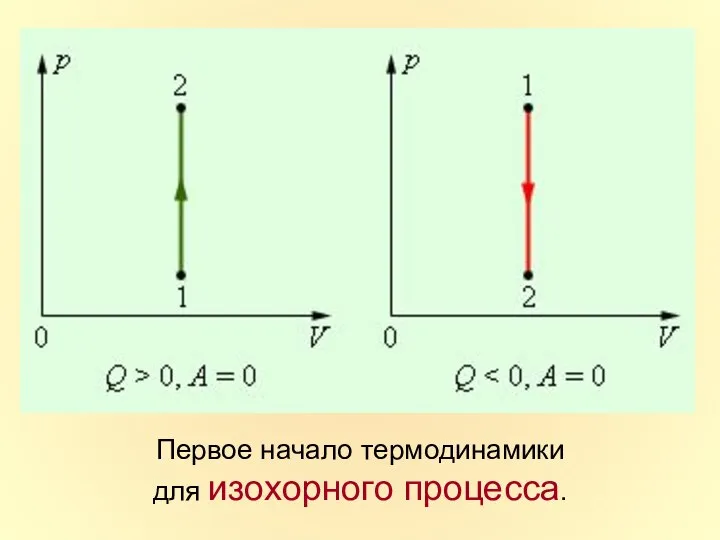
- 33. Первое начало термодинамики для изохорного процесса.
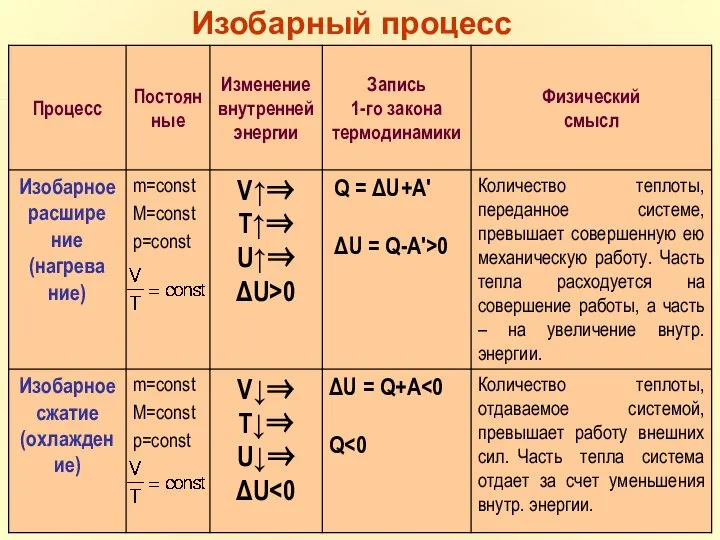
- 34. m=const M=const p=const Изобарный процесс
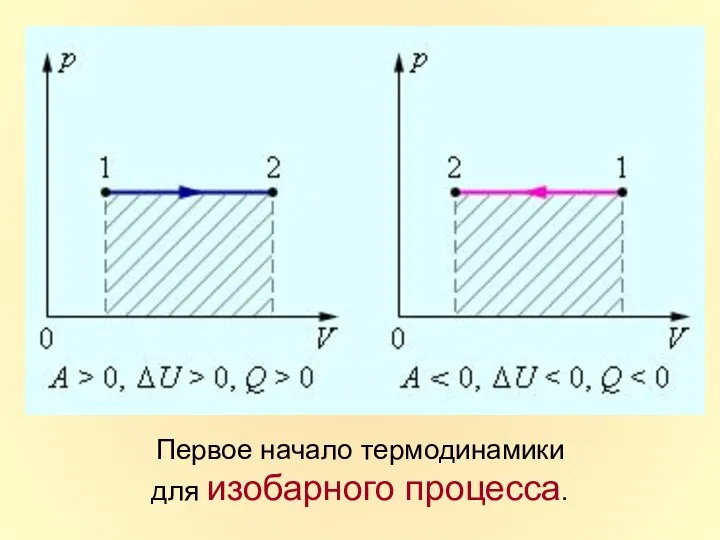
- 35. Первое начало термодинамики для изобарного процесса.
- 36. Адиабатный процесс
- 37. Первое начало термодинамики для адиабатного процесса.
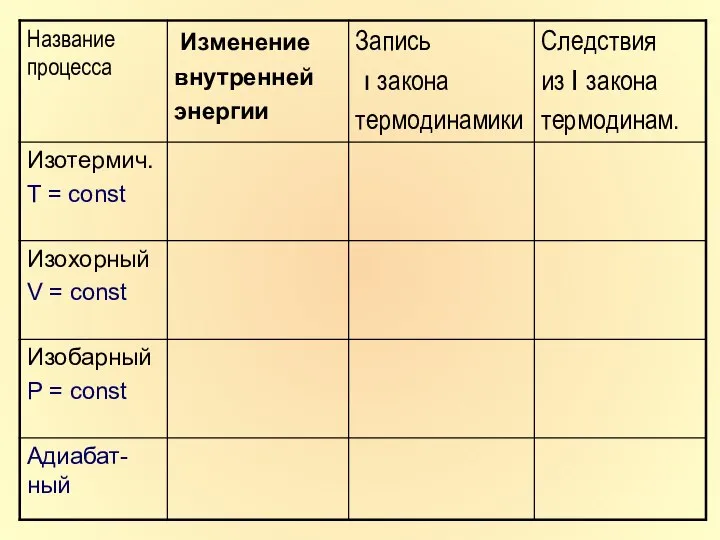
- 38. Домашннее задание. 1. Составить конспект. 2. Учебник стр.125-134. 3. Заполнить таблицу( следующий слайд)
- 41. Скачать презентацию



















 Уравнения материального баланса. Уравнение Бернулли, уравнение неразрывности
Уравнения материального баланса. Уравнение Бернулли, уравнение неразрывности Действие электрического тока. Сила тока, измерение силы тока
Действие электрического тока. Сила тока, измерение силы тока Уравнение Бернулли. Лекция №4
Уравнение Бернулли. Лекция №4 Уравновешивание (поршневые компрессоры). Лекция №8
Уравновешивание (поршневые компрессоры). Лекция №8 Сиракузы. III век до нашей эры
Сиракузы. III век до нашей эры Механические явления
Механические явления Инфракрасное излучение
Инфракрасное излучение Свойства полупроводниковых диодов
Свойства полупроводниковых диодов Lektsia_8_Kolebania_ZS
Lektsia_8_Kolebania_ZS Презентация на тему Применение конденсаторов
Презентация на тему Применение конденсаторов  Механический ткацкий станок
Механический ткацкий станок Перемещение. Проекции перемещения
Перемещение. Проекции перемещения Аристотель, его вклад в развитие механики
Аристотель, его вклад в развитие механики Свободное падение тел
Свободное падение тел Влажность воздуха. Насыщенный и ненасыщенный пар
Влажность воздуха. Насыщенный и ненасыщенный пар Лабораторная работа измерение сопротивления проводника при помощи амперметра и вольтметра
Лабораторная работа измерение сопротивления проводника при помощи амперметра и вольтметра Изменение внутренней энергии. Теплопередача
Изменение внутренней энергии. Теплопередача Шпоночное соединение
Шпоночное соединение Плотность вещества
Плотность вещества Распределения вероятности. Нормальное распределение. Вероятностная энтропия. Лекция 07(10)
Распределения вероятности. Нормальное распределение. Вероятностная энтропия. Лекция 07(10) Презентация на тему: Физика в современном театре
Презентация на тему: Физика в современном театре Оптика. Интерференция света
Оптика. Интерференция света Решение задач с использованием понятия массовая доля
Решение задач с использованием понятия массовая доля Простые механизмы. Рычаг
Простые механизмы. Рычаг Силовое действие магнитного поля
Силовое действие магнитного поля Наноматериалы для промышленности
Наноматериалы для промышленности Научное открытие России: Гравитационные волны
Научное открытие России: Гравитационные волны Презентация на тему Звуковой резонанс
Презентация на тему Звуковой резонанс