Содержание
- 2. СОЗДАТЕЛИ АТОМНОЙ ТЕОРИИ Эрнест Резерфорд Амедео Авогадро Дмитрий Менделеев Джон Дальтон ЦЕЛЬ МКТ: объяснить свойства макроскопических
- 3. Макроскопические тела – большие тела, состоящие из множества частиц (молекул). Микроскопические тела – состоят из одной
- 4. Микропараметры вещества - это физические величины, характеризующие каждую частицу вещества в отдельности (размеры молекул, масса молекулы,
- 5. Основные положения МКТ • Все тела состоят из малых частиц, между которыми есть промежутки. • Частицы
- 6. ПЕРВОЕ ПОЛОЖЕНИЕ Все тела состоят из малых частиц, между которыми есть промежутки. Все вещества – жидкие,
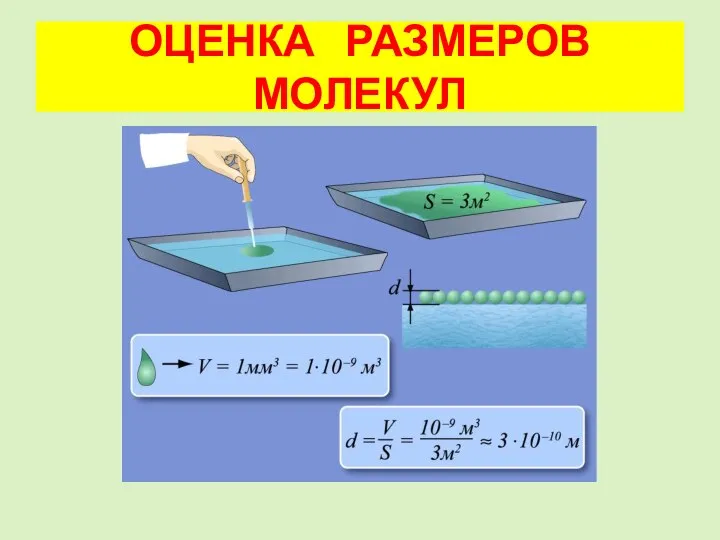
- 7. ОЦЕНКА РАЗМЕРОВ МОЛЕКУЛ
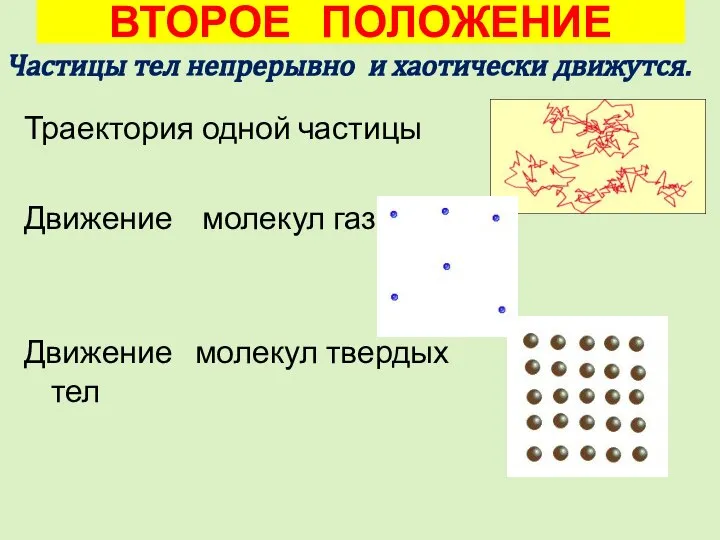
- 8. ВТОРОЕ ПОЛОЖЕНИЕ Траектория одной частицы Движение молекул газа Движение молекул твердых тел Частицы тел непрерывно и
- 9. Косвенное: Диффузия – самопроизвольное перемешивание молекул разных веществ . Чем больше температура, тем быстрее протекает диффузия!
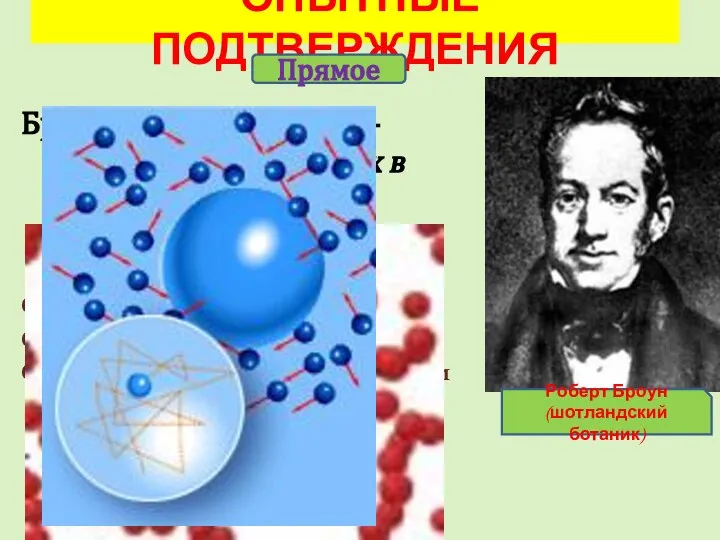
- 10. Броуновское движение – движение взвешенных в жидкости частиц Открыто в 1827г. Броуном. Объяснено в 1905г.Эйнштейном Опытно
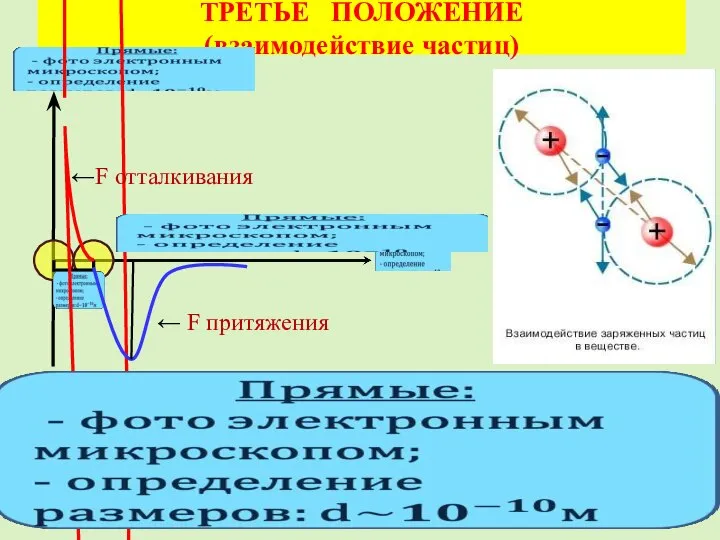
- 11. ОПЫТНЫЕ ПОДТВЕРЖДЕНИЯ ТРЕТЬЕ ПОЛОЖЕНИЕ Частицы тел взаимодействуют друг с другом: притягиваются и отталкиваются. Косвенные: - смачивание;
- 12. ТРЕТЬЕ ПОЛОЖЕНИЕ (взаимодействие частиц) ←F отталкивания ← F притяжения
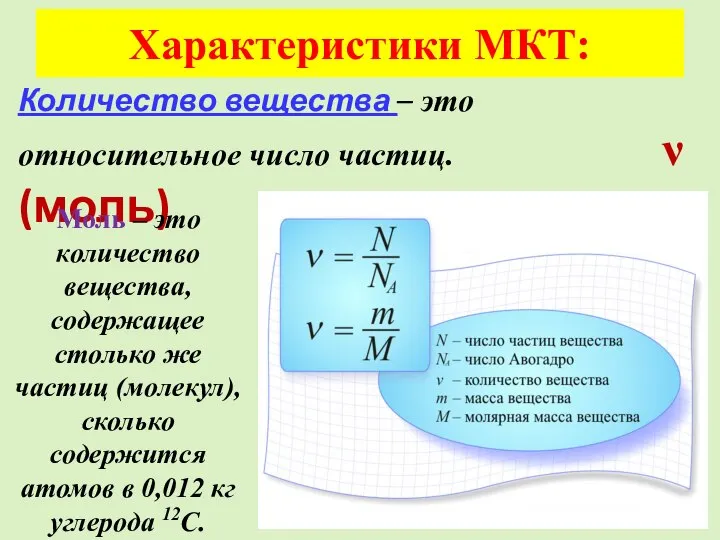
- 13. Характеристики МКТ: Количество вещества – это относительное число частиц. ν (моль) Моль – это количество вещества,
- 14. В единице массы, 1 килограмме вещества, находится разное количество структурных единиц – атомов, молекул. Зависит это
- 15. Характеристики МКТ: m0 (кг) – Масса молекулы М – молярная масса NА – число Авогадро N
- 16. Молярная масса- это масса вещества, взятого в количестве 1 моль. Все газы двухатомны, кроме инертных: М(Н2)
- 17. ЗАДАЧИ 1. Рассчитать массу молекулы Н2SО4. Дано: Решение: М(Н)=1г/моль М(Н2SО4) = (2·1 + 32 + 16·4)
- 18. 2. Сколько молекул содержится в 50г Аℓ? М(Аℓ) = 27г/моль N = νNA ν = m/M
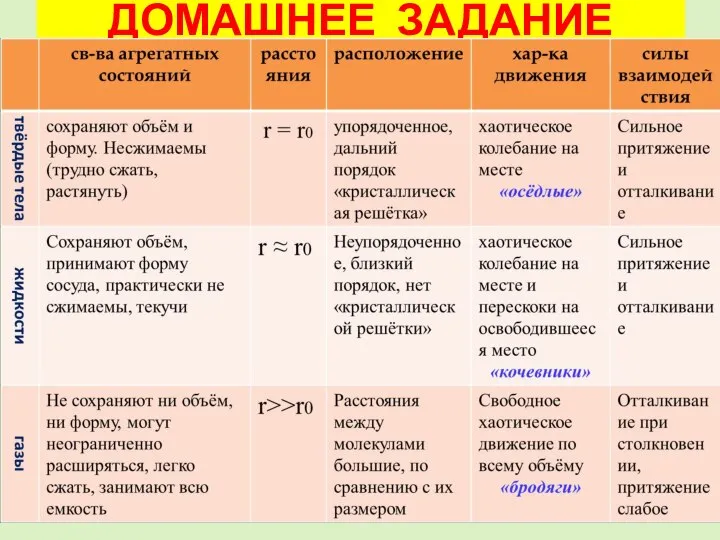
- 19. ДОМАШНЕЕ ЗАДАНИЕ
- 20. Домашнее задание: (решите задачи) 1. Определите массу 50моль углекислого газа. Малярную массу рассчитайте по таблице Менделеева.
- 22. Скачать презентацию













 ИГЭС 2 семестр-Волны Лекция 2
ИГЭС 2 семестр-Волны Лекция 2 Презентация на тему Решение задач импульс, работа. энергия
Презентация на тему Решение задач импульс, работа. энергия  Виды зубчатых передач
Виды зубчатых передач Преломление света. Дисперсия. Цвета тел. (6 класс)
Преломление света. Дисперсия. Цвета тел. (6 класс) Презентация на тему Строение атома Квантовая физика
Презентация на тему Строение атома Квантовая физика  Состав ядра атома. Энергия связи атомных ядер. Дефект масс
Состав ядра атома. Энергия связи атомных ядер. Дефект масс Электрический ток в различных средах
Электрический ток в различных средах Методы регистрации заряженных частиц
Методы регистрации заряженных частиц Физика твердой Земли. Стационарное тепловое поле
Физика твердой Земли. Стационарное тепловое поле Постоянный ток и его основные законы
Постоянный ток и его основные законы Назначение, классификация и конструкция колесных пар локомотива
Назначение, классификация и конструкция колесных пар локомотива Сложение сил
Сложение сил Волновая оптика
Волновая оптика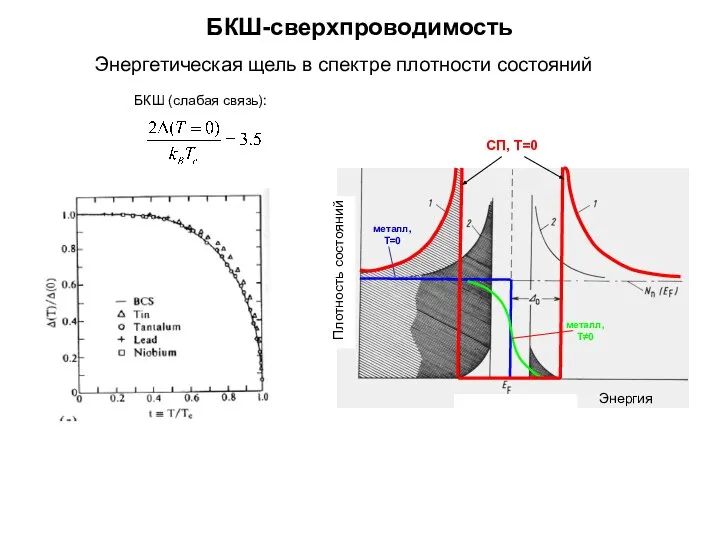 БКШ-сверхпроводимость. Терагерцовая оптика
БКШ-сверхпроводимость. Терагерцовая оптика Презентация на тему Скорость света
Презентация на тему Скорость света  Презентация на тему Закон Ома
Презентация на тему Закон Ома  Основы расчетов на жесткость деталей машин. Лекция 7
Основы расчетов на жесткость деталей машин. Лекция 7 tormoznaya_sistema_TO
tormoznaya_sistema_TO 540576.pptx
540576.pptx Основы термодинамики
Основы термодинамики Фотоядерные реакции. (Тема 2.5)
Фотоядерные реакции. (Тема 2.5) Поляризация диэлектриков
Поляризация диэлектриков Ножницы как рычаг
Ножницы как рычаг Ламповый генератор
Ламповый генератор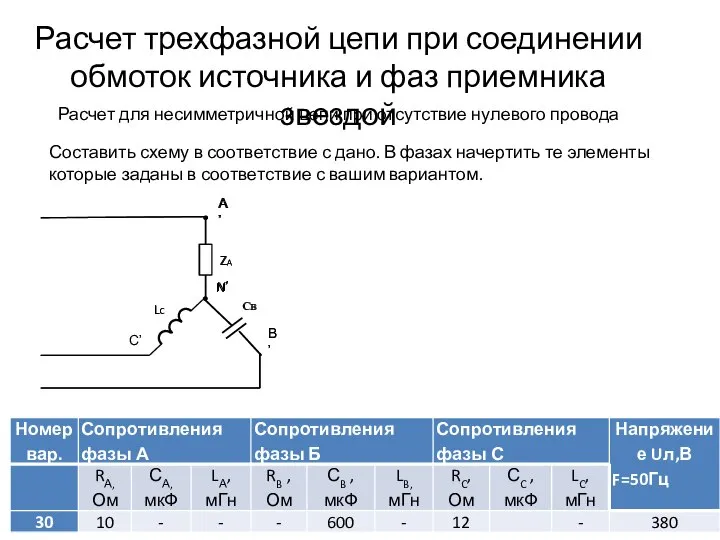 Расчет трехфазной цепи при соединении обмоток источника и фаз приемника звездой
Расчет трехфазной цепи при соединении обмоток источника и фаз приемника звездой Период полураспада. Закон радиоактивного распада
Период полураспада. Закон радиоактивного распада Квазихимический метод описания дефектов
Квазихимический метод описания дефектов Цепи переменного тока с последовательным соединением элементов
Цепи переменного тока с последовательным соединением элементов