Содержание
- 2. Термодинамика – теория тепловых процессов, в которой не учитывается молекулярное строение тел. Термодинамика была создана в
- 3. Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) тела и
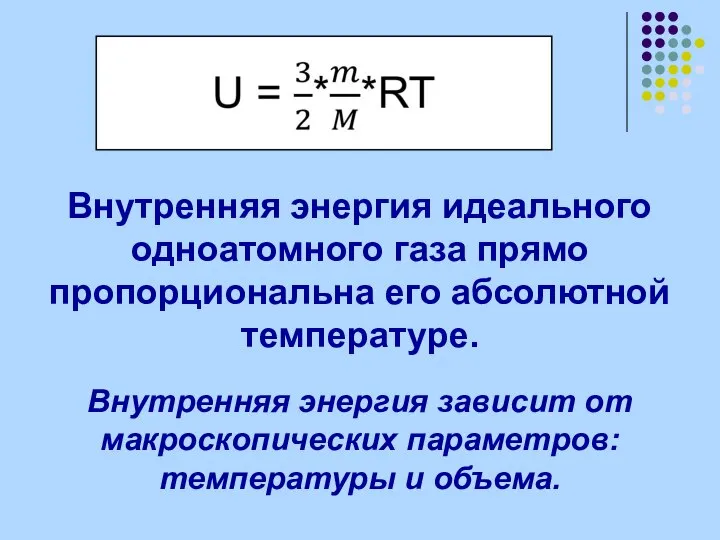
- 4. Внутренняя энергия идеального одноатомного газа прямо пропорциональна его абсолютной температуре. Внутренняя энергия зависит от макроскопических параметров:
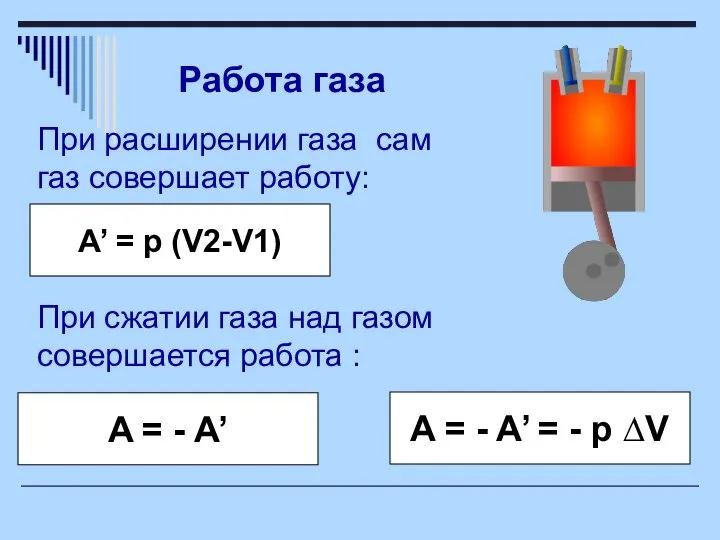
- 5. При расширении газа сам газ совершает работу: Работа газа A’ = p (V2-V1) При сжатии газа
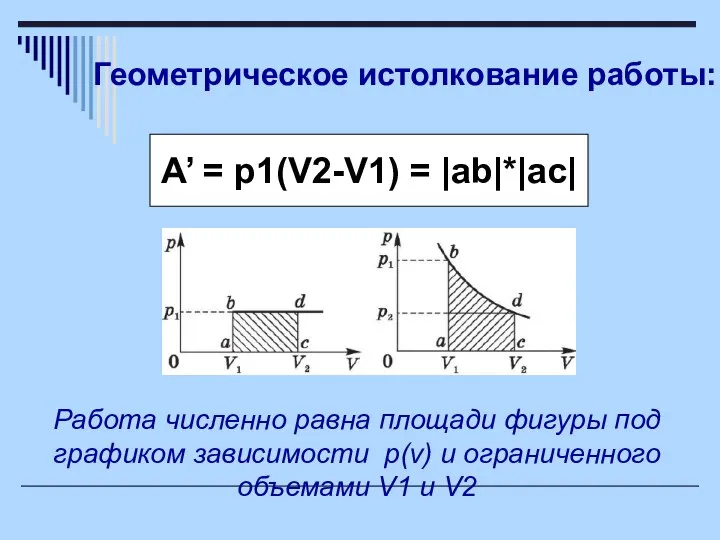
- 6. Геометрическое истолкование работы: A’ = p1(V2-V1) = |ab|*|ac| Работа численно равна площади фигуры под графиком зависимости
- 7. ЗАКОНЫ ТЕРМОДИНАМИКИ
- 8. I Закон термодинамики: Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно
- 9. Изобарный процесс: Q = ∆ U + A’; Передаваемое газу количество теплоты идет на изменение его
- 10. Изохорный процесс: ∆ U = Q; Если газ нагревается, то Q>0 и ∆ U>0, при охлаждении
- 11. Изотермический процесс: Q = A’; Если газ получает теплоту (Q>0), то A’>0, газ отдает теплоту окружающей
- 12. Адиабатный процесс: Адиабатный процесс – процесс в теплоизолированной системе. Q = 0, ∆ U = A;
- 14. Скачать презентацию








 Характеристика и свойства электромагнитных волн
Характеристика и свойства электромагнитных волн Методика организации лабораторных и экспериментальных работ учащихся на уроках физики
Методика организации лабораторных и экспериментальных работ учащихся на уроках физики Современное состояние прецизионной кварцевой стабилизации частоты применительно к задачам частотно-временного обеспечения
Современное состояние прецизионной кварцевой стабилизации частоты применительно к задачам частотно-временного обеспечения Колебания
Колебания Между двумя точечными заряженными телами сила электрического взаимодействия
Между двумя точечными заряженными телами сила электрического взаимодействия Условная структура атома
Условная структура атома Лейденская банка. Опыт
Лейденская банка. Опыт Магнитное поле. Магнитостатика. Электромагнетизм
Магнитное поле. Магнитостатика. Электромагнетизм Тепловые явления
Тепловые явления Ученые-физики
Ученые-физики Постоянные магниты Урок 33
Постоянные магниты Урок 33 Физика космоса кружок
Физика космоса кружок Движение тела по наклонной плоскости. Решение задач
Движение тела по наклонной плоскости. Решение задач Расчёт количества теплоты при плавлении и кристаллизации тел
Расчёт количества теплоты при плавлении и кристаллизации тел Основы гидравлики
Основы гидравлики Моделирование и экспериментальное исследование разрушения сферической полистироловой микрочастицы в лазерном пучке
Моделирование и экспериментальное исследование разрушения сферической полистироловой микрочастицы в лазерном пучке Изучение движения тела, брошенного горизонтально
Изучение движения тела, брошенного горизонтально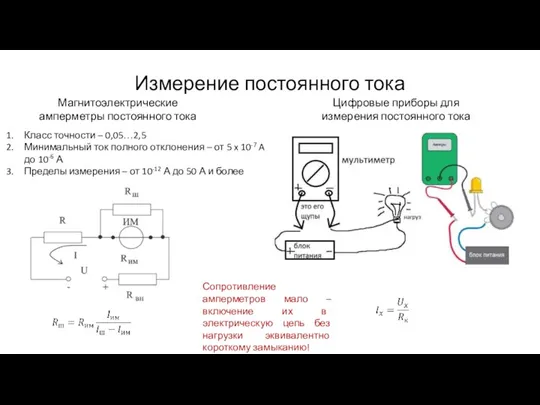 Измерение постоянного тока
Измерение постоянного тока Скорость движения
Скорость движения Механические колебания
Механические колебания Устройство, назначение, принцип действия подвески автомобиля
Устройство, назначение, принцип действия подвески автомобиля Презентация на тему Звук
Презентация на тему Звук  Закон Ома для участка цепи
Закон Ома для участка цепи Основы термодинамики
Основы термодинамики Презентация на тему Импульс
Презентация на тему Импульс  Тест
Тест Коаксиальный кабель
Коаксиальный кабель Фундаментальные опыты в механике: Галилей, Нютон
Фундаментальные опыты в механике: Галилей, Нютон