Содержание
- 2. Атомная гипотеза – вещество состоит из частиц, то есть имеет внутреннюю структуру. Свойства этих частиц определяют
- 3. Джозеф Дж. Томсон – создатель современной экспериментальной атомной физики
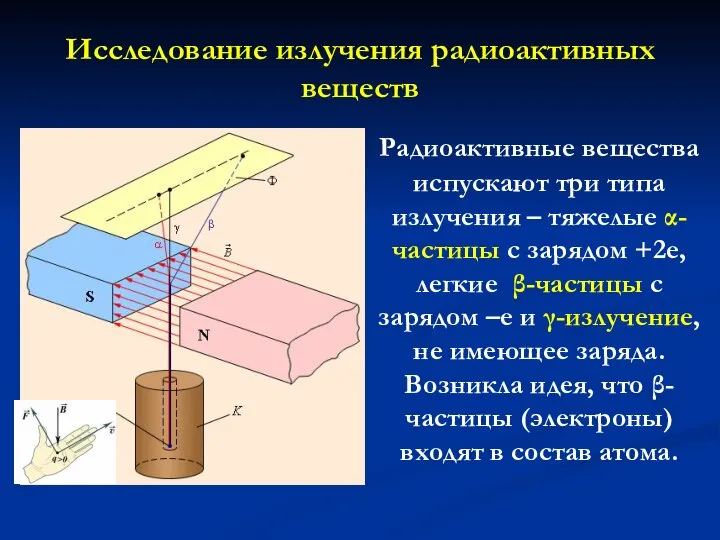
- 4. Исследование излучения радиоактивных веществ Радиоактивные вещества испускают три типа излучения – тяжелые α-частицы с зарядом +2е,
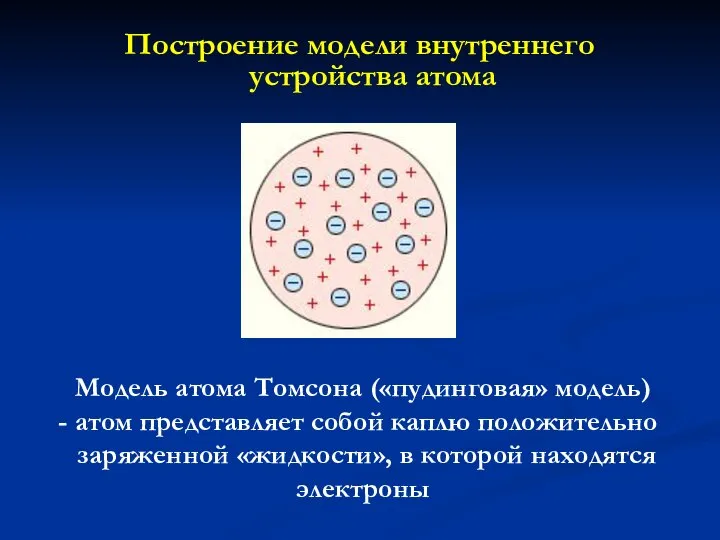
- 5. Построение модели внутреннего устройства атома Модель атома Томсона («пудинговая» модель) атом представляет собой каплю положительно заряженной
- 6. Эрнест Резерфорд 30.08.1871 – 10.10.1937 «Резерфорду и его школе принадлежит центральное место в исследованиях, заложивших основу
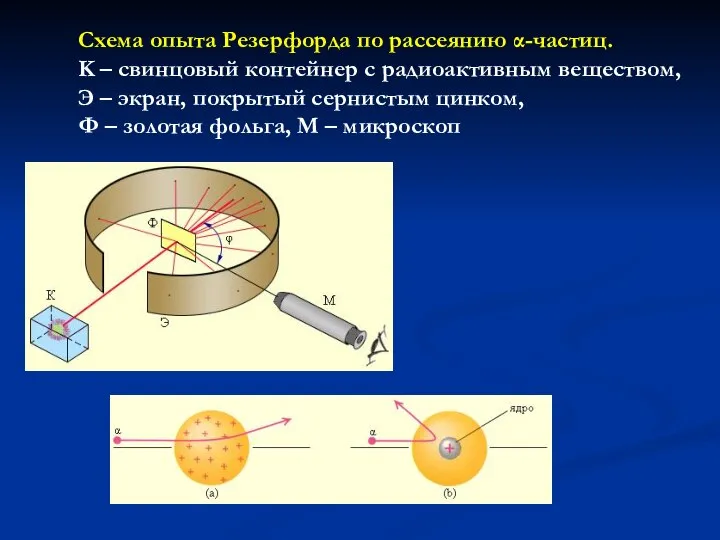
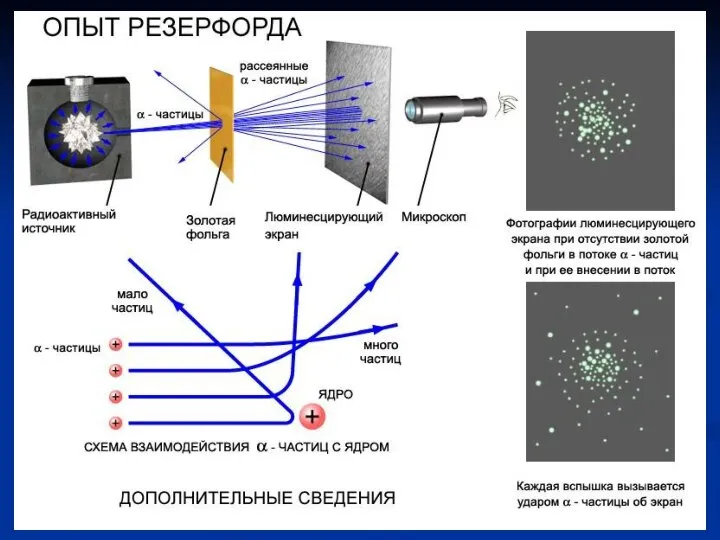
- 7. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран,
- 9. Резерфорд в лаборатории Резерфорд в те годы был больше похож на спортсмена или агронома, проводящего время
- 10. Модель атома Резерфорда, 1911 г («планетарная модель») Практически вся масса атома сосредоточена в очень малой центральной
- 11. Резерфорд прекрасно понимал, что его модель противоречит классической электродинамике. Движущийся по окружности электрон должен непрерывно излучать
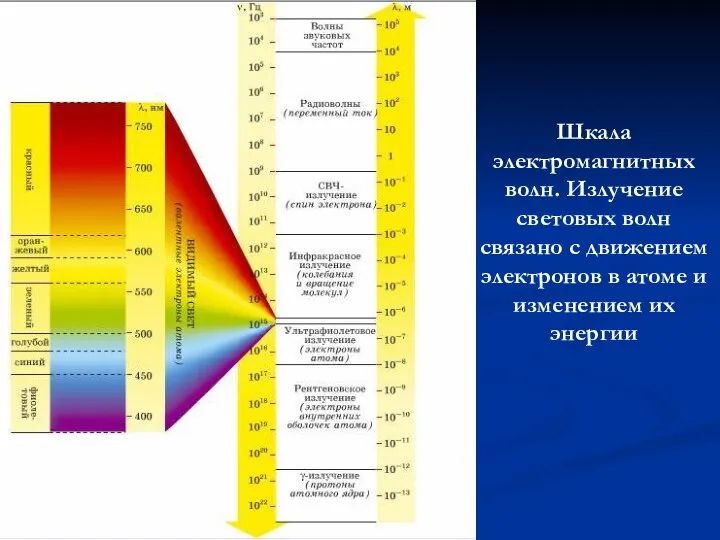
- 12. Шкала электромагнитных волн. Излучение световых волн связано с движением электронов в атоме и изменением их энергии
- 13. Видимый свет имеет определенную структуру, которая может быть получена разложением его в спектр с помощью призмы
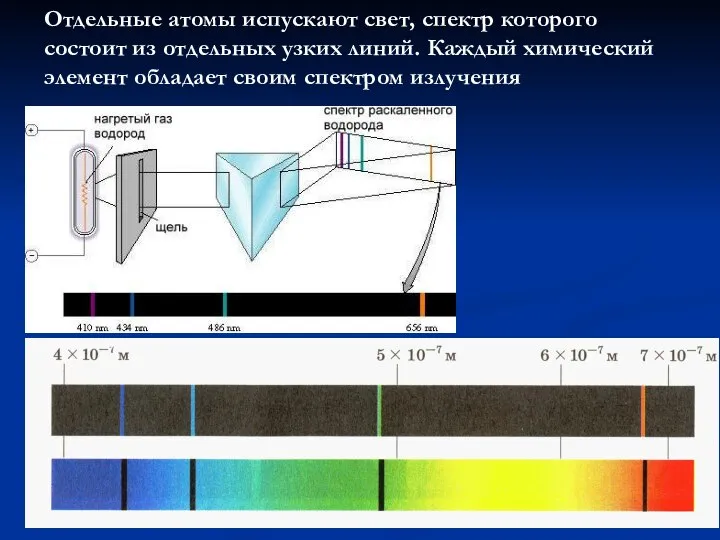
- 14. Отдельные атомы испускают свет, спектр которого состоит из отдельных узких линий. Каждый химический элемент обладает своим
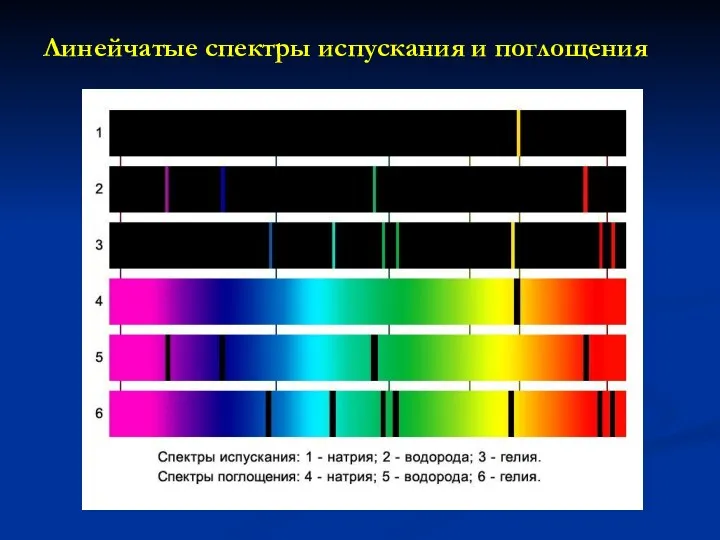
- 15. Линейчатые спектры испускания и поглощения
- 16. Создатели Квантовой теории Макс Планк Нильс Бор Альберт Эйнштейн Вернер Гейзенберг Эрвин Шредингер Вольфганг Паули
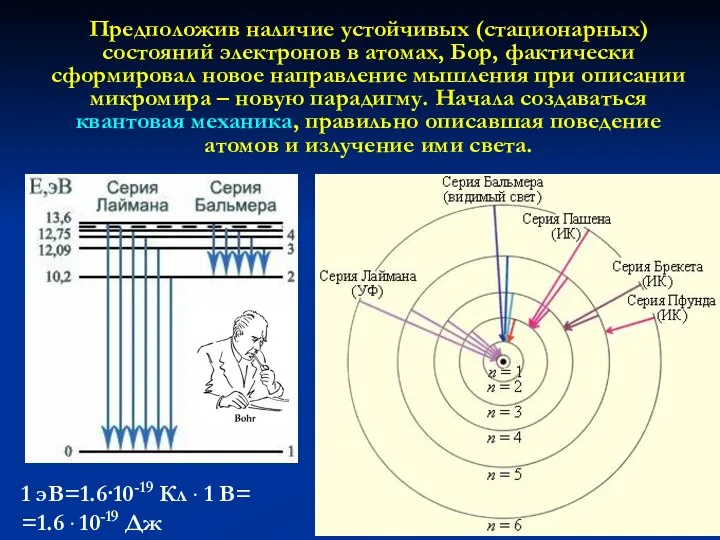
- 17. Предположив наличие устойчивых (стационарных) состояний электронов в атомах, Бор, фактически сформировал новое направление мышления при описании
- 18. Электрон в атоме может находиться лишь в определенных стационарных состояниях, каждому из которых соответствует определенная энергия.
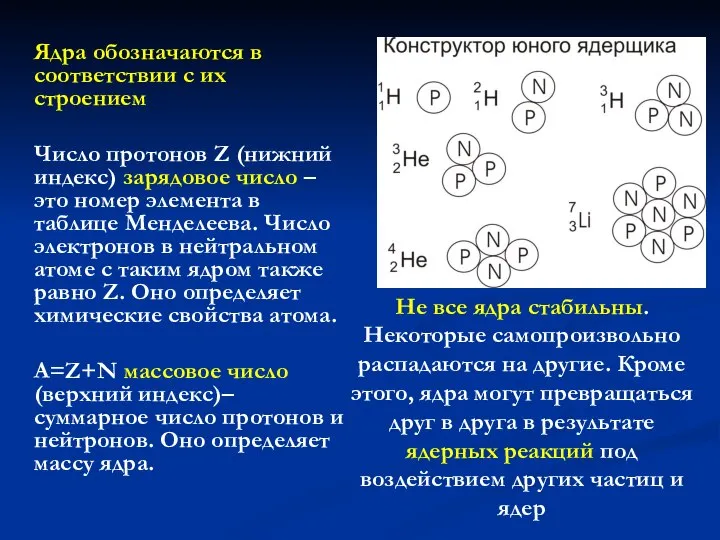
- 19. Имеет ли атомное ядро внутреннюю структуру?
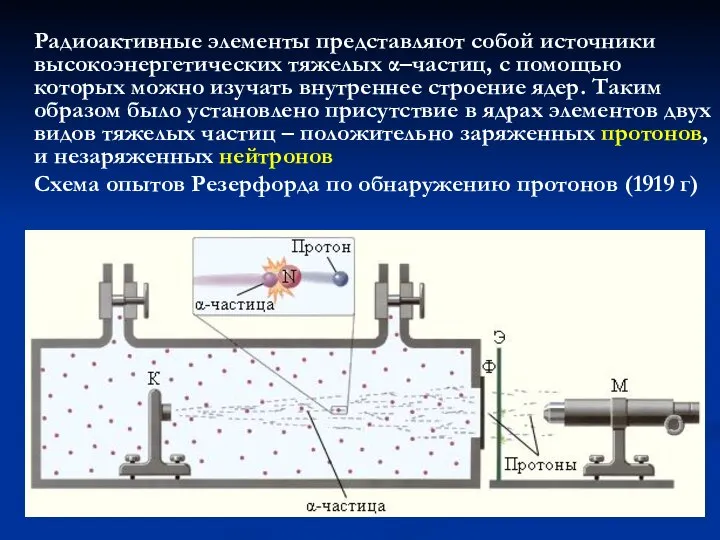
- 20. Радиоактивные элементы представляют собой источники высокоэнергетических тяжелых α–частиц, с помощью которых можно изучать внутреннее строение ядер.
- 21. Не все ядра стабильны. Некоторые самопроизвольно распадаются на другие. Кроме этого, ядра могут превращаться друг в
- 22. Ядерные реакции Ядерная реакция – превращение одних ядер в другие самопроизвольно или под действием других элементарных
- 23. Наиболее известны реакции деления тяжелых ядер и слияния легких (синтеза) Реакция деления ядра урана Реакция термоядерного
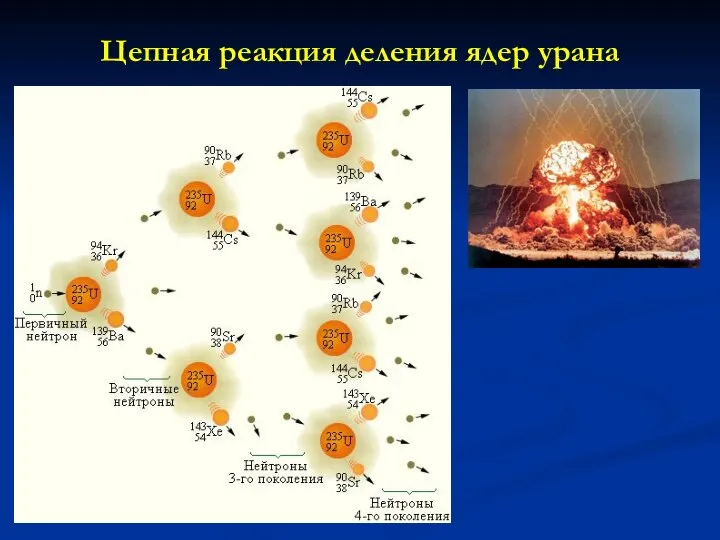
- 24. Цепная реакция деления ядер урана
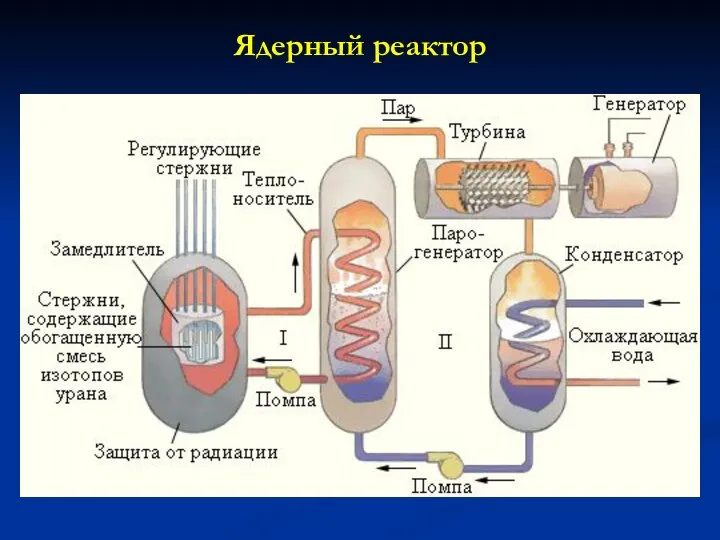
- 25. Ядерный реактор
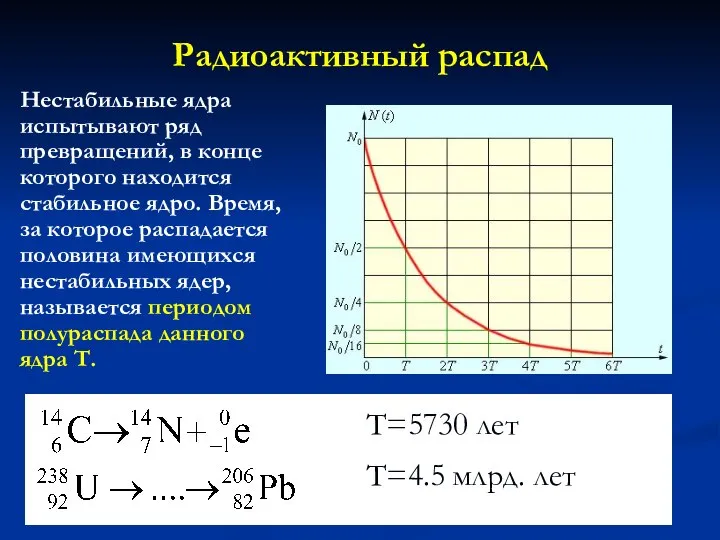
- 26. Радиоактивный распад Нестабильные ядра испытывают ряд превращений, в конце которого находится стабильное ядро. Время, за которое
- 28. Скачать презентацию












 Вакуумная, компрессорная техника и пневмосистемы
Вакуумная, компрессорная техника и пневмосистемы Опыт, позволивший обнаружить сложный состав радио - активного излучения
Опыт, позволивший обнаружить сложный состав радио - активного излучения Техническая эксплуатация автомобиля Камаз 4310. Ремонт сцепления автомобиля
Техническая эксплуатация автомобиля Камаз 4310. Ремонт сцепления автомобиля Лекция 7. Расчет статически неопределимых систем методом сил
Лекция 7. Расчет статически неопределимых систем методом сил Движение частиц в экспериментах ЯМР
Движение частиц в экспериментах ЯМР Проводник и контур с током в магнитном поле. Лекция № 7
Проводник и контур с током в магнитном поле. Лекция № 7 Презентация на тему Единица электрического заряда
Презентация на тему Единица электрического заряда  Равнодействующая сила
Равнодействующая сила Построение зубчатого зацепления вручную карандашом
Построение зубчатого зацепления вручную карандашом Мэгэриф хэм фэн
Мэгэриф хэм фэн Фотоны. Давление света. Корпускулярно-волновой дуализм
Фотоны. Давление света. Корпускулярно-волновой дуализм Сверхпроводи́мость
Сверхпроводи́мость Дифракционная решетка
Дифракционная решетка Презентация на тему Короткое замыкание
Презентация на тему Короткое замыкание  Механические волны
Механические волны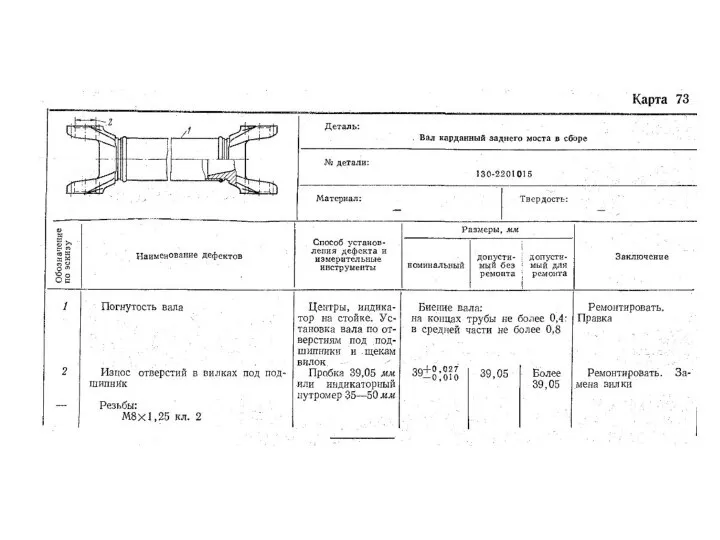 Ремонт автомобилей. Детали
Ремонт автомобилей. Детали Внутренняя энергия. Агрегатные состояния вещества. Занятие 1. Часть 1
Внутренняя энергия. Агрегатные состояния вещества. Занятие 1. Часть 1 Основы электричества. Электрическая цепь
Основы электричества. Электрическая цепь Двигатель. Классификация двигателей
Двигатель. Классификация двигателей Закон Бойля-Мариотта
Закон Бойля-Мариотта 00082e78-475de346
00082e78-475de346 Визначення питомого опору провідника
Визначення питомого опору провідника Плавание тел
Плавание тел Измерение объёма тела
Измерение объёма тела Программируемые сопротивления
Программируемые сопротивления Что такое электричество?
Что такое электричество? Правила безопасности в кабинете физики
Правила безопасности в кабинете физики Тепловое действие электрического тока
Тепловое действие электрического тока