Содержание
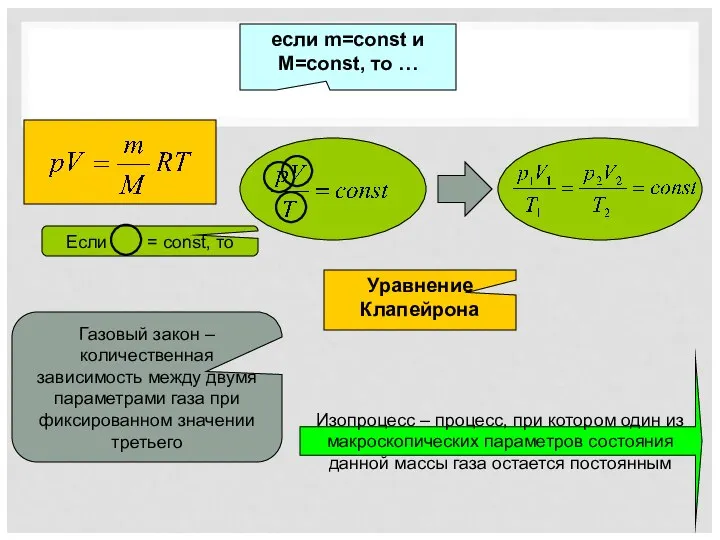
- 2. если m=const и M=const, то … Уравнение Клапейрона Газовый закон – количественная зависимость между двумя параметрами
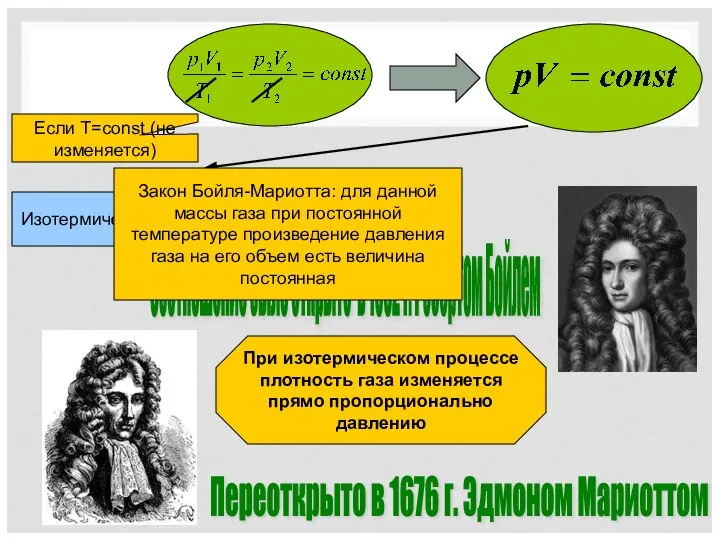
- 3. Соотношение было открыто в 1662 г. Робертом Бойлем Переоткрыто в 1676 г. Эдмоном Мариоттом Если T=const
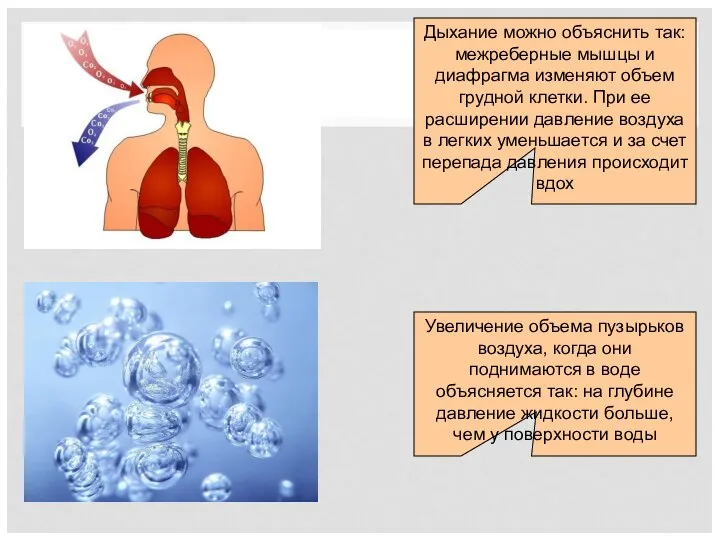
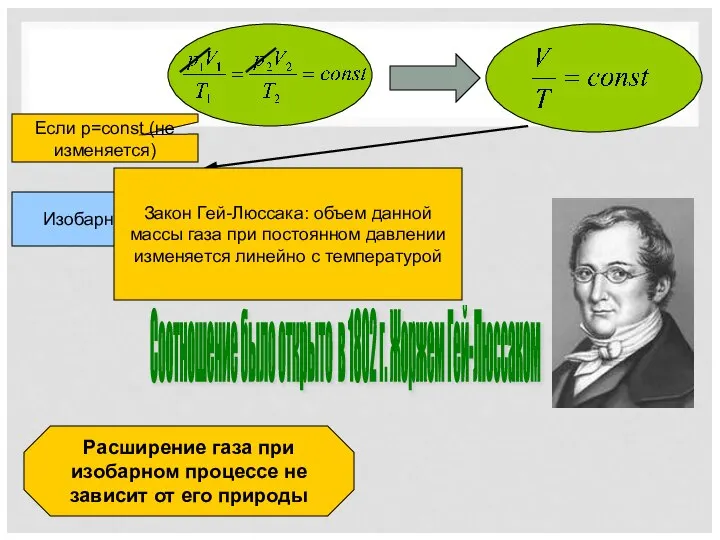
- 4. Дыхание можно объяснить так: межреберные мышцы и диафрагма изменяют объем грудной клетки. При ее расширении давление
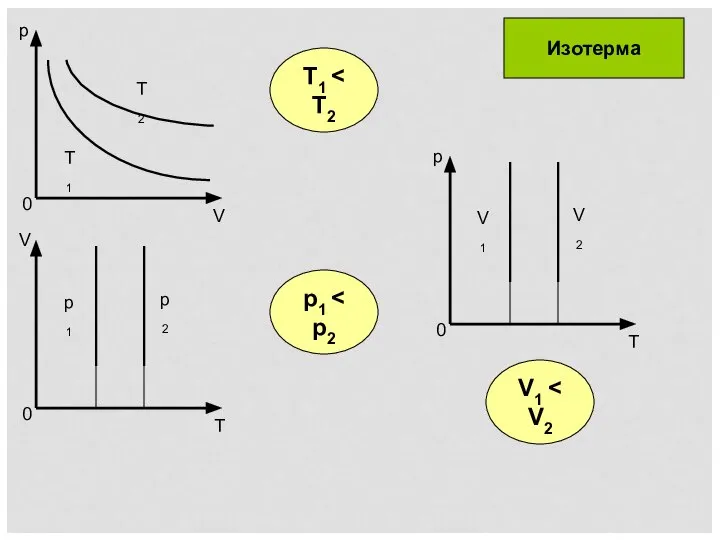
- 5. T1 p1 V1 Изотерма
- 6. Соотношение было открыто в 1802 г. Жоржем Гей-Люссаком Если p=const (не изменяется) Изобарный процесс Расширение газа
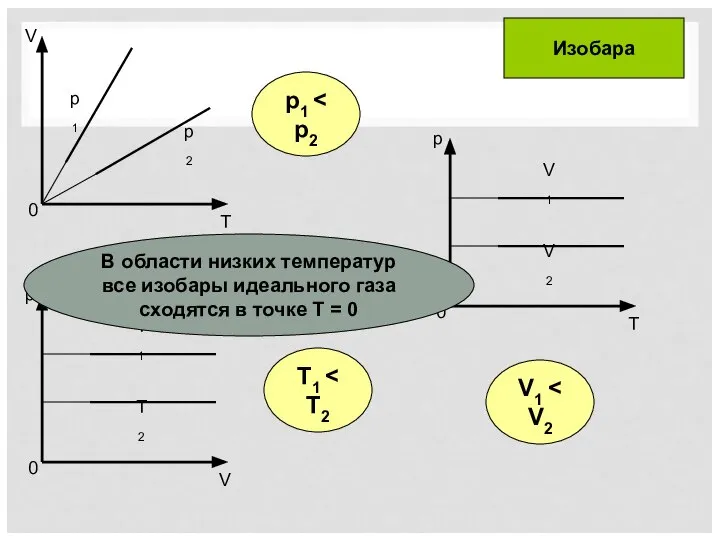
- 7. T1 p1 V1 Изобара В области низких температур все изобары идеального газа сходятся в точке Т
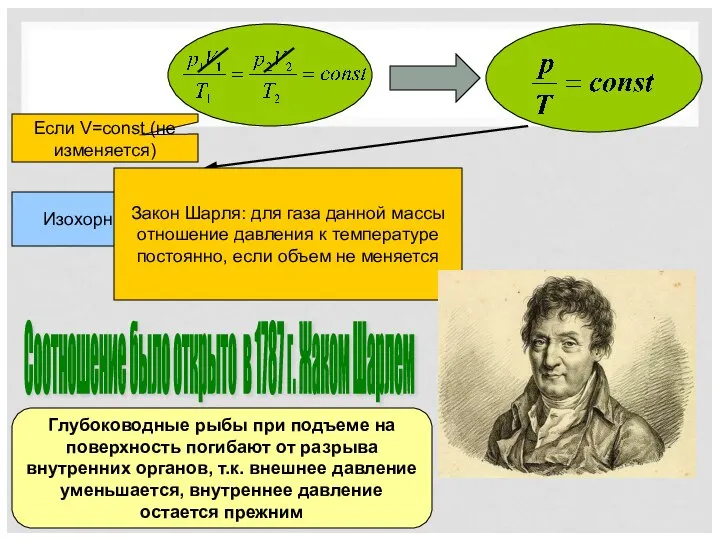
- 8. Соотношение было открыто в 1787 г. Жаком Шарлем Если V=const (не изменяется) Изохорный процесс Глубоководные рыбы
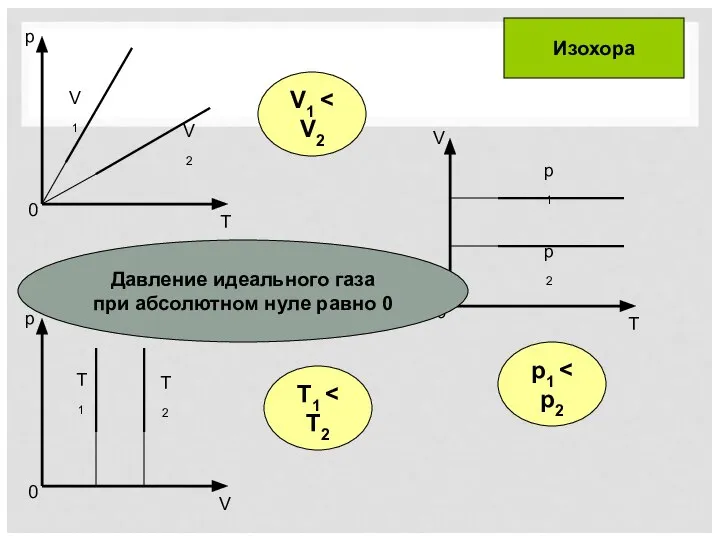
- 9. T1 p1 V1 Изохора Давление идеального газа при абсолютном нуле равно 0
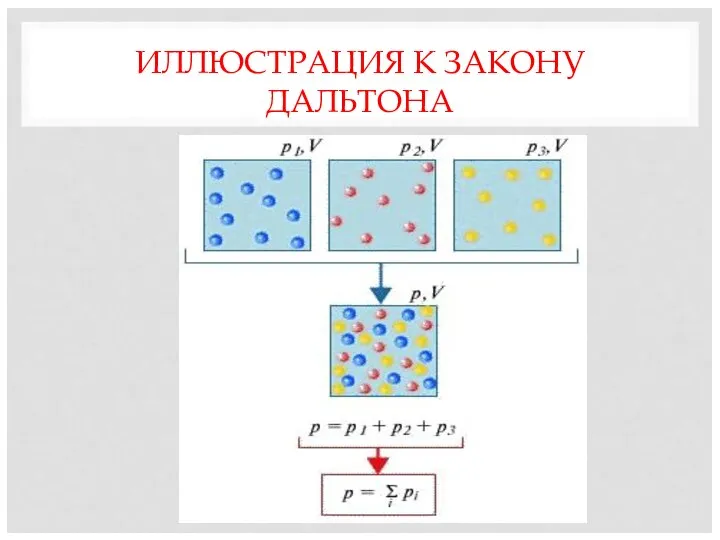
- 10. ЗАКОН ДАЛЬТОНА Если идеальный газ является смесью нескольких газов, давление смеси идеальных газов равно сумме парциальных
- 11. ИЛЛЮСТРАЦИЯ К ЗАКОНУ ДАЛЬТОНА
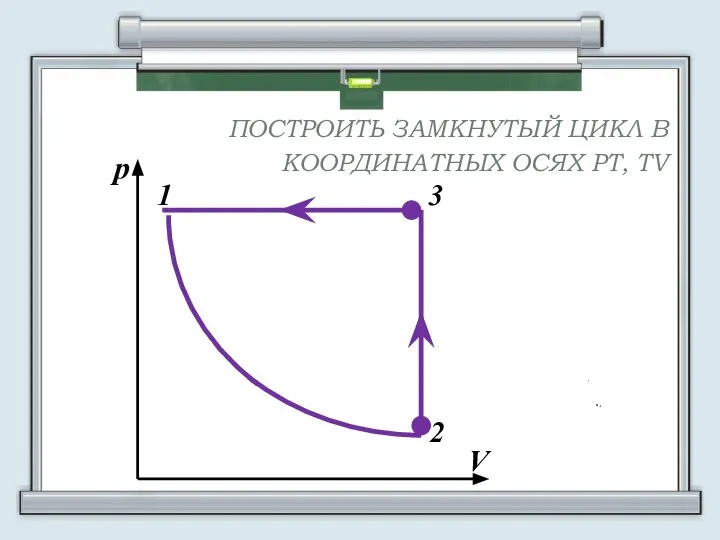
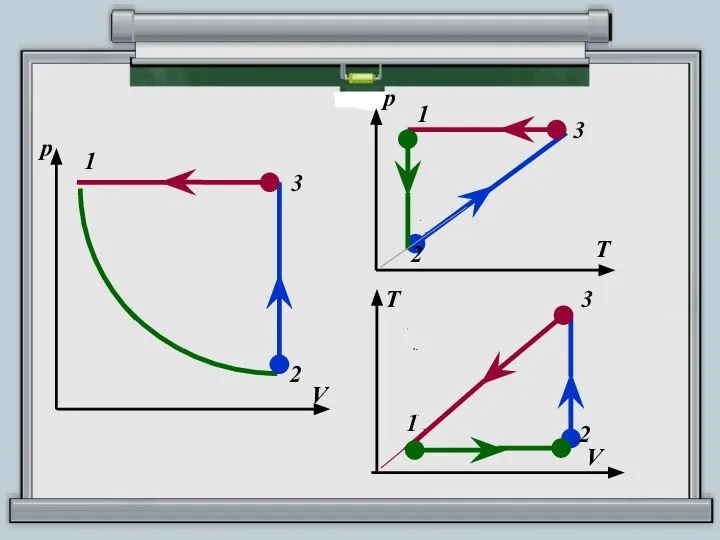
- 12. ПОСТРОИТЬ ЗАМКНУТЫЙ ЦИКЛ В КООРДИНАТНЫХ ОСЯХ РТ, TV
- 13. АЛГОРИТМ ПОСТРОЕНИЯ 1. Определите процесс, соответствующий данному участку графика, по виду этого участка (изотерма, изобара, изохора).
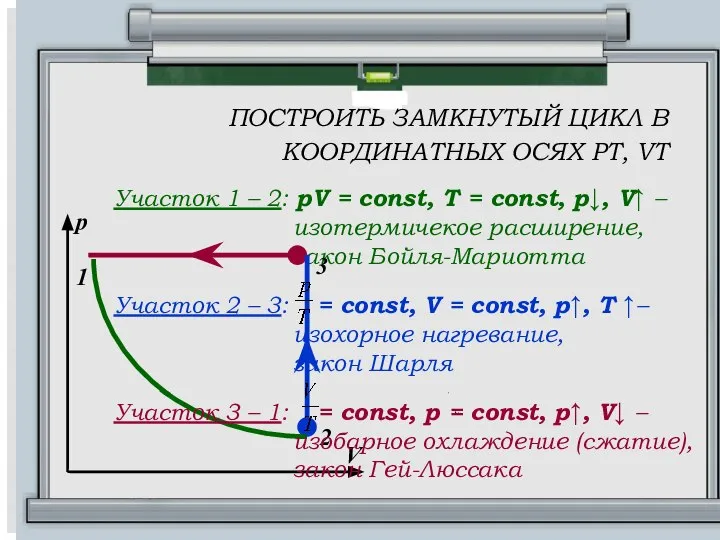
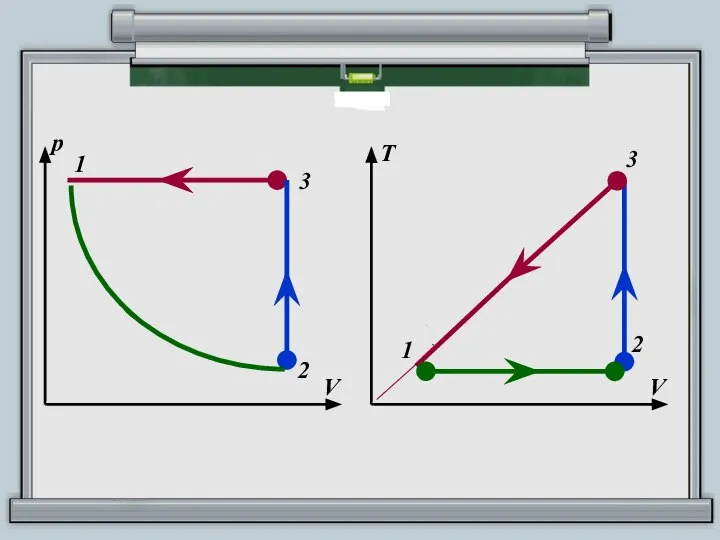
- 14. ПОСТРОИТЬ ЗАМКНУТЫЙ ЦИКЛ В КООРДИНАТНЫХ ОСЯХ РТ, VT Участок 1 – 2: pV = const, T
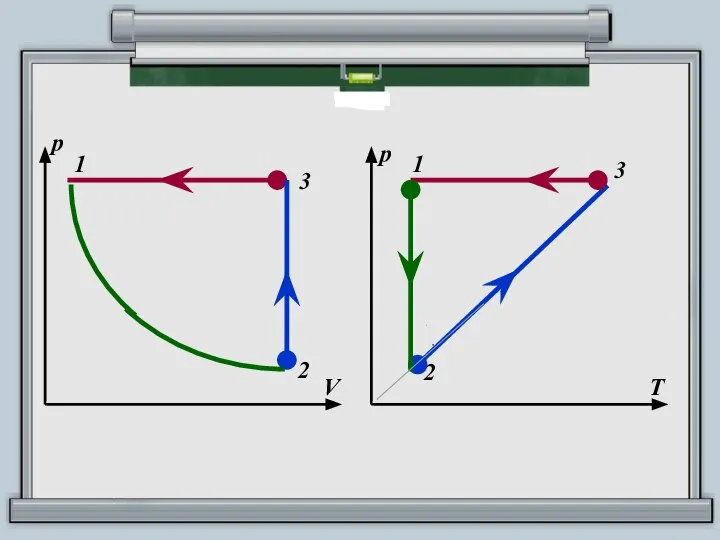
- 15. 1 р V 3 2 1 р Т 3 2
- 16. 1 р V 3 2 1 T V 3 2
- 19. Скачать презентацию


 Основные понятия кинематики. Простейшие движения твердого тела
Основные понятия кинематики. Простейшие движения твердого тела Конденсатор. Энергия заряженного конденсатора
Конденсатор. Энергия заряженного конденсатора Электромагнитные волны
Электромагнитные волны Курс физики. Введение
Курс физики. Введение Тепловые двигатели
Тепловые двигатели Система питания дизельного двигателя
Система питания дизельного двигателя Макроскопическая намагниченность, прецессия
Макроскопическая намагниченность, прецессия Колебательное движение
Колебательное движение Действие жидкости и газа на погружённое в них тело. Сила Архимеда
Действие жидкости и газа на погружённое в них тело. Сила Архимеда Радиоактивность. Открытие
Радиоактивность. Открытие Ускорение свободного падения на земле и других планетах
Ускорение свободного падения на земле и других планетах Система смазки карбюраторного двигателя
Система смазки карбюраторного двигателя Мирный атом
Мирный атом Классификация и краткое описание основных спектроскопических методов исследования поверхности и наноструктур
Классификация и краткое описание основных спектроскопических методов исследования поверхности и наноструктур Полупроводники. Собственная проводимость полупроводников
Полупроводники. Собственная проводимость полупроводников Применение векторов при решении задач и доказательстве теорем
Применение векторов при решении задач и доказательстве теорем Лекция 9. Выпаривание
Лекция 9. Выпаривание Система охлаждения
Система охлаждения Инфракрасное и ультрафиолетовое излучения
Инфракрасное и ультрафиолетовое излучения Каты җисемнәр,сыеклыклар һәм газларның басымы
Каты җисемнәр,сыеклыклар һәм газларның басымы Решение задач на одновременное движение всех видов
Решение задач на одновременное движение всех видов Презентация на тему Рентгеновское излучение
Презентация на тему Рентгеновское излучение  Самоіндукція. Індуктивність. Енергія магнітного поля
Самоіндукція. Індуктивність. Енергія магнітного поля Драйвер двигателя постоянного тока. Вспомогательные функции
Драйвер двигателя постоянного тока. Вспомогательные функции Электромагнитная природа света
Электромагнитная природа света Энергия волны. Вектор Умова. Колебания и волны. 11
Энергия волны. Вектор Умова. Колебания и волны. 11 Закон сохранения импульса. Законы Ньютона
Закон сохранения импульса. Законы Ньютона Система допусков ИСО на линейные размеры. Практическая работа
Система допусков ИСО на линейные размеры. Практическая работа