Содержание
- 2. СОДЕРЖАНИЕ Цель Первые понятия о железе Значение Физические свойства Химические свойства(с простыми веществами) Химические свойства(со сложными
- 3. ЦЕЛИ Содержание Формирование понятий о железе: Изучение химических и физических свойств; Решение практических задач и уравнений
- 4. Ковкий, вязкий металл серебристо-белого цвета. Гидротермальный источник с железистой водой. Оксиды железа окрашивают воду в бурый
- 5. ЗНАЧЕНИЕ Железо — один из самых используемых металлов, на него приходится до 95 % мирового металлургического
- 6. Физические свойства Цвет : серебристо-белый Блеск : блестящий Пластичность : очень пластичный, легко куется, прокатывается, штампуется
- 7. Химические свойства Взаимодействие с простыми веществами-неметаллами 2) С кислородом 3Fe + 2O2 —>Fe3O4 Содержание 1) С
- 8. Химические свойства Взаимодействие со сложными веществами Содержание 1) С водой 2) С солями 3) С кислотами
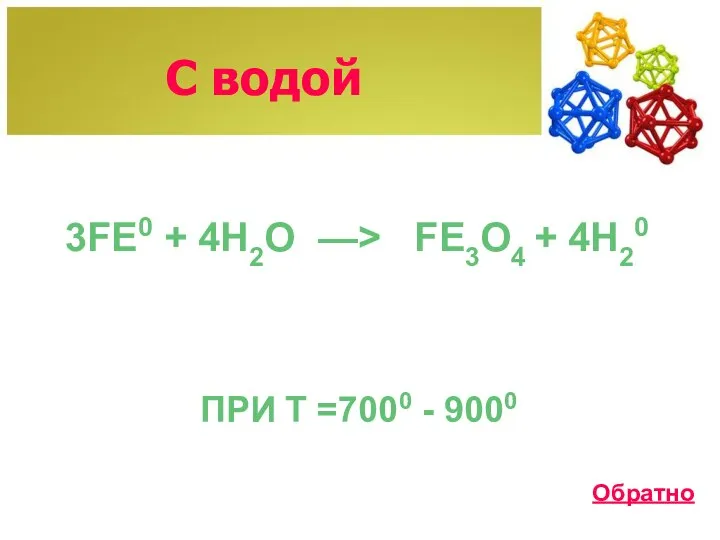
- 9. С водой 3FE0 + 4H2O ПРИ T =7000 - 9000 —> FE3O4 + 4H20 Обратно
- 10. С солями ОПЫТ: осуществите реакцию между порошком железа и раствором хлорида меди (II). Fe + CuCl2
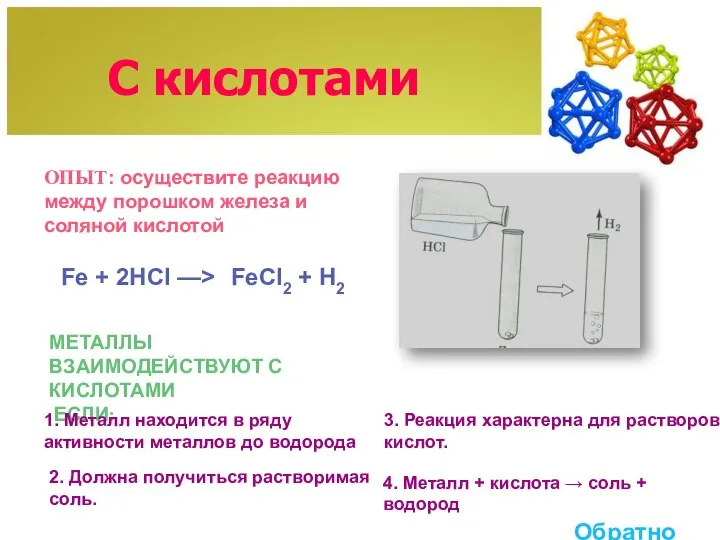
- 11. С кислотами ОПЫТ: осуществите реакцию между порошком железа и соляной кислотой Fe + 2HCl —> МЕТАЛЛЫ
- 12. Интересные факты А количество железа, равное всему добытому человечеством золоту, извлекается из недр земного шара примерно
- 13. Нахождение в природе Железо является также одним из наиболее распространенных элементов в природных водах, где среднее
- 14. Важнейшие источники Содержание
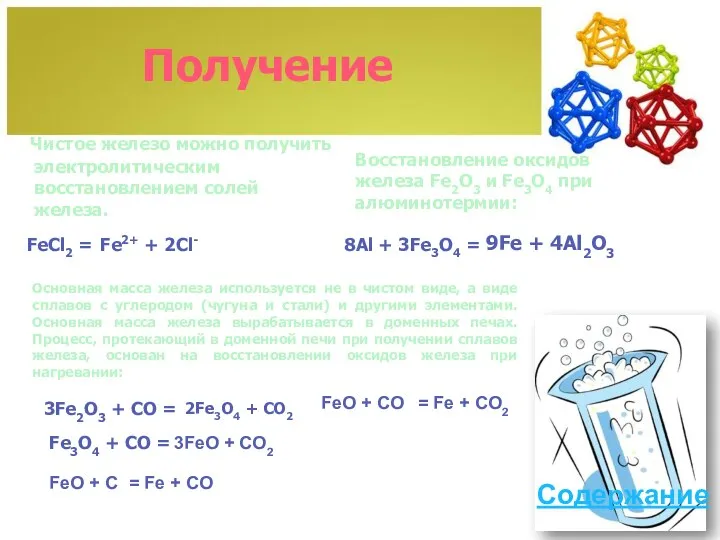
- 15. Получение Чистое железо можно получить электролитическим восстановлением солей железа. Содержание FeCl2 = Fe2+ + 2Cl- Восстановление
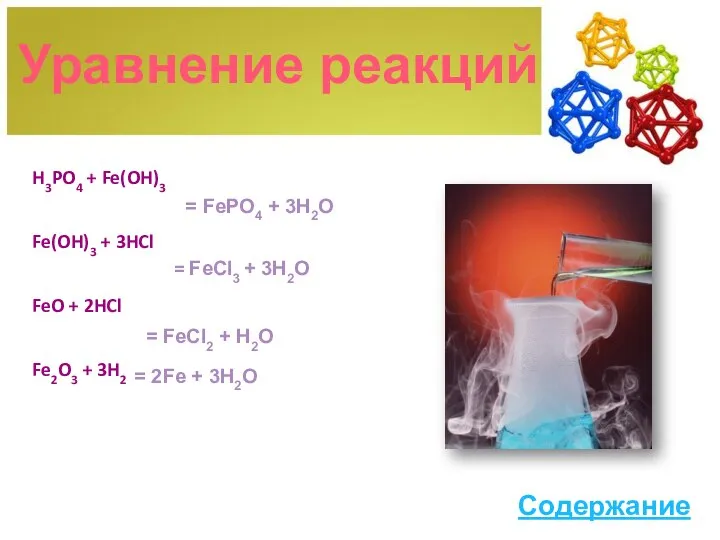
- 16. H3PO4 + Fe(OH)3 Fe(OH)3 + 3HCl FeO + 2HCl Fe2O3 + 3H2 Уравнение реакций = FePO4
- 17. Вывод Железо один из самых значимых и известных металлов. Он играет важную роль как и в
- 19. Скачать презентацию












 Колебания. Малые гармонические колебания
Колебания. Малые гармонические колебания Сила Лоренца
Сила Лоренца Строительство и эксплуатация зданий и сооружений. Связи и их реакции
Строительство и эксплуатация зданий и сооружений. Связи и их реакции Динамика вязкой жидкости
Динамика вязкой жидкости Исследования зависимости массы сгорающего топлива от времени горения
Исследования зависимости массы сгорающего топлива от времени горения Работа в электрическом поле
Работа в электрическом поле Общий вид стационарной ЭТЛ
Общий вид стационарной ЭТЛ Ядерные реакции. Атом, атомное ядро, атомная энергия (Лекция 2)
Ядерные реакции. Атом, атомное ядро, атомная энергия (Лекция 2) Виды зубчатых передач
Виды зубчатых передач Единая система допусков и посадок деталей и узлов машин, принципы её построения
Единая система допусков и посадок деталей и узлов машин, принципы её построения Взаимодействие ионизирующего излучения с веществом
Взаимодействие ионизирующего излучения с веществом Выпуск первого автомобиля в г. Тольятти
Выпуск первого автомобиля в г. Тольятти Источники света. Прямолинейное распространение света
Источники света. Прямолинейное распространение света ТMM структура. Лекция 1
ТMM структура. Лекция 1 Теоретическая механика. Дифференциальные уравнения движения. Криволинейное движение (задачи)
Теоретическая механика. Дифференциальные уравнения движения. Криволинейное движение (задачи) Что и как изучает физика
Что и как изучает физика Презентация на тему Внутренняя энергия. Способы изменения внутренней энергии
Презентация на тему Внутренняя энергия. Способы изменения внутренней энергии  Презентация на тему Фундаментальные взаимодействия
Презентация на тему Фундаментальные взаимодействия  Преобразование диаграммы условного напряжения - деформация в диаграмму истинного напряжения - деформация в программе Abaqus
Преобразование диаграммы условного напряжения - деформация в диаграмму истинного напряжения - деформация в программе Abaqus Основное уравнение динамики свободных незатухающих колебаний
Основное уравнение динамики свободных незатухающих колебаний Проверка и наладка электрооборудования стационарной сварочной машины №3
Проверка и наладка электрооборудования стационарной сварочной машины №3 Взаимодействие проводника с током и магнитной стрелки
Взаимодействие проводника с током и магнитной стрелки Сила упругости
Сила упругости Сила трения. Викторина
Сила трения. Викторина Изобретение радио Поповым
Изобретение радио Поповым Магнитное взаимодействие. Искусственные и естественные магниты
Магнитное взаимодействие. Искусственные и естественные магниты Закон сохранения импульса и механической энергии
Закон сохранения импульса и механической энергии Сила упругости. Закон Гука
Сила упругости. Закон Гука