Содержание
- 2. АМИНОКИСЛОТЫ. ПЕПТИДЫ И БЕЛКИ Аминокислоты – это гетерофункциональные соединения, имеющие в своих молекулах одновременно две функциональые
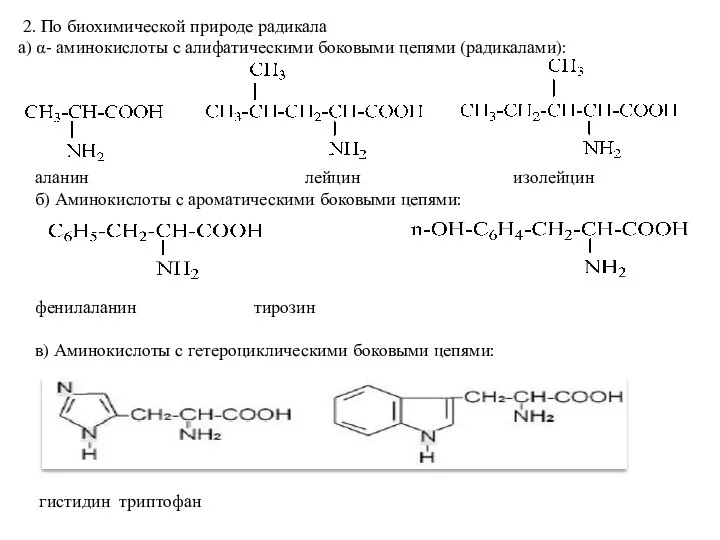
- 3. 2. По биохимической природе радикала а) α- аминокислоты с алифатическими боковыми цепями (радикалами): аланин лейцин изолейцин
- 4. 3. По числу карбоксильных и аминогрупп В зависимости от общего числа карбоксильных и аминогрупп в молекуле,
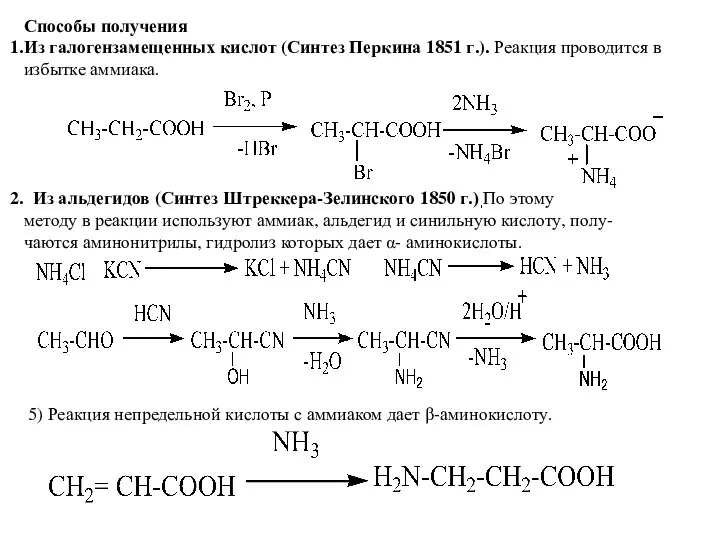
- 5. Способы получения Из галогензамещенных кислот (Синтез Перкина 1851 г.). Реакция проводится в избытке аммиака. Из альдегидов
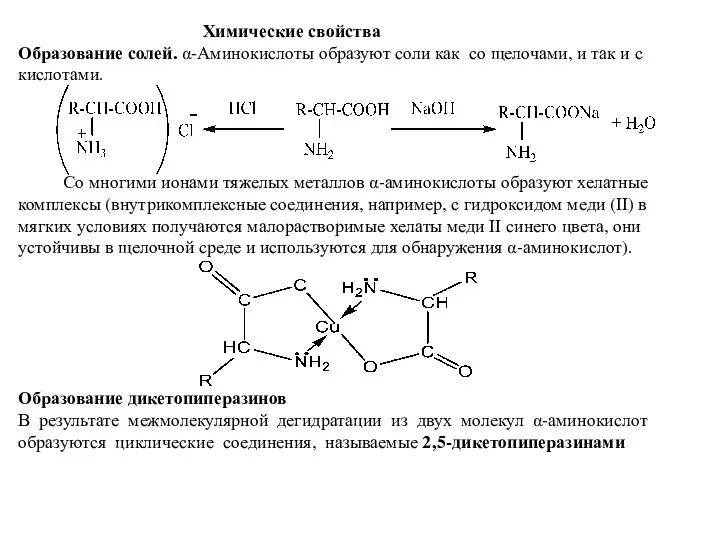
- 6. Химические свойства Образование солей. α-Аминокислоты образуют соли как со щелочами, и так и с кислотами. Со
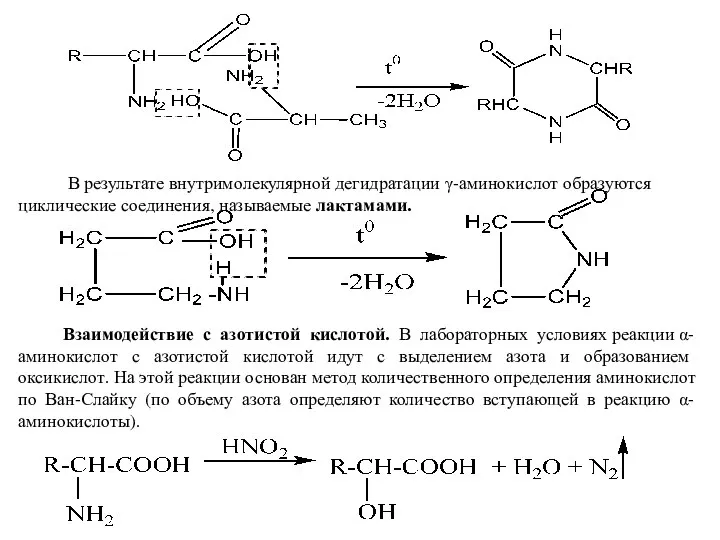
- 7. В результате внутримолекулярной дегидратации γ-аминокислот образуются циклические соединения, называемые лактамами. Взаимодействие с азотистой кислотой. В лабораторных
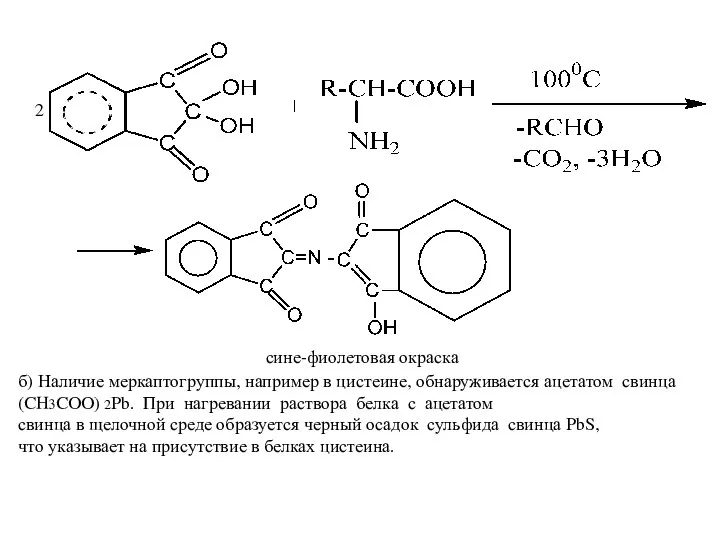
- 8. Взаимодействие с формальдегидом. При взаимодействии α-аминокислот с альдегидами образуются замещенные имины ( основания Шиффа), карбоксильная группа
- 9. сине-фиолетовая окраска 2 б) Наличие меркаптогруппы, например в цистеине, обнаруживается ацетатом свинца (CH3COO) 2Pb. При нагревании
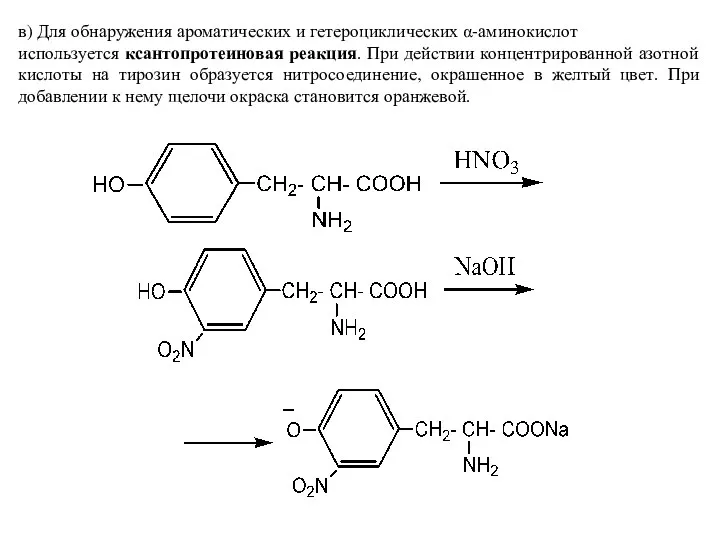
- 10. в) Для обнаружения ароматических и гетероциклических α-аминокислот используется ксантопротеиновая реакция. При действии концентрированной азотной кислоты на
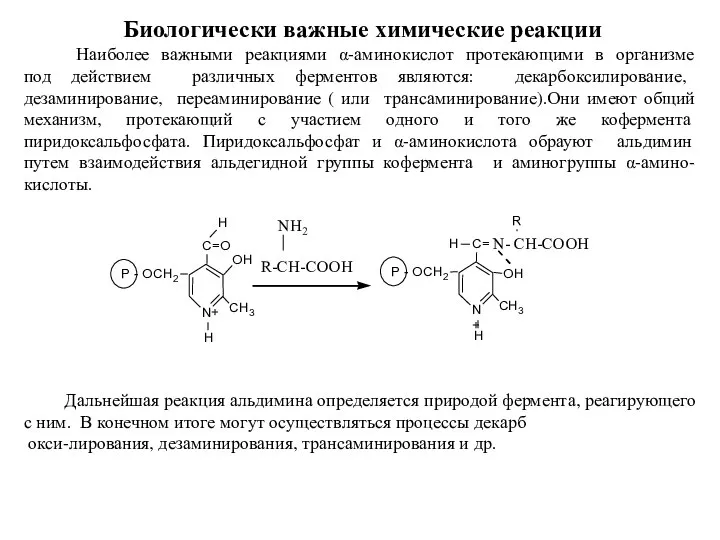
- 11. Биологически важные химические реакции Наиболее важными реакциями α-аминокислот протекающими в организме под действием различных ферментов являются:
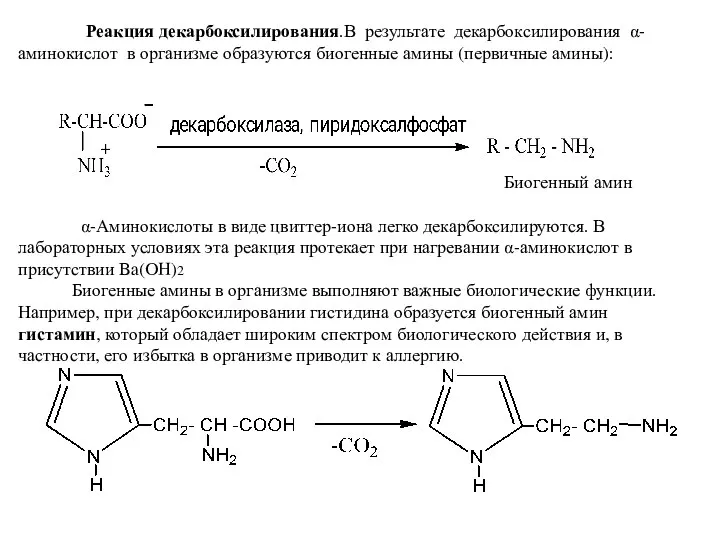
- 12. Реакция декарбоксилирования.В результате декарбоксилирования α-аминокислот в организме образуются биогенные амины (первичные амины): Биогенный амин α-Аминокислоты в
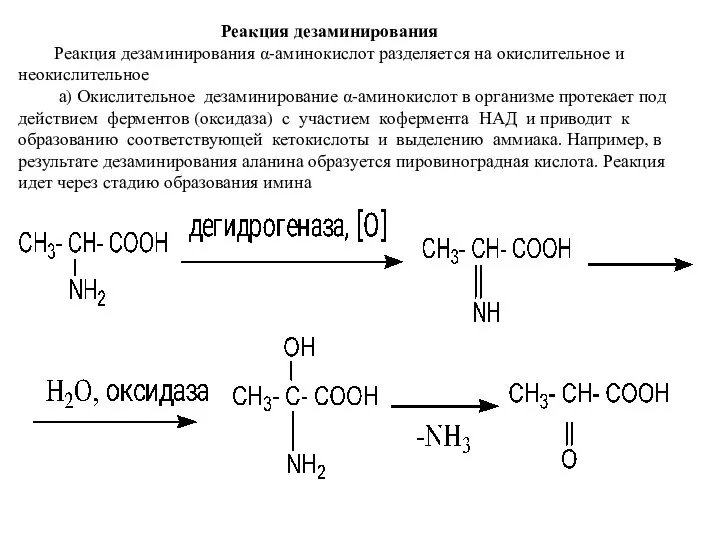
- 13. Реакция дезаминирования Реакция дезаминирования α-аминокислот разделяется на окислительное и неокислительное а) Окислительное дезаминирование α-аминокислот в организме
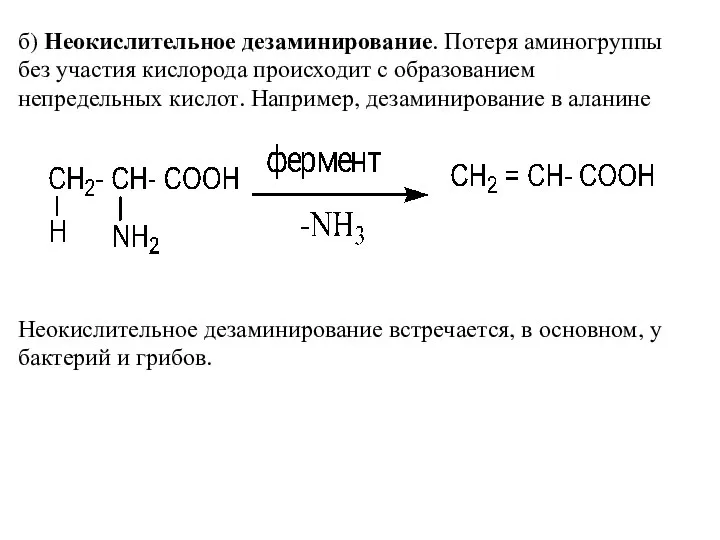
- 14. б) Неокислительное дезаминирование. Потеря аминогруппы без участия кислорода происходит с образованием непредельных кислот. Например, дезаминирование в
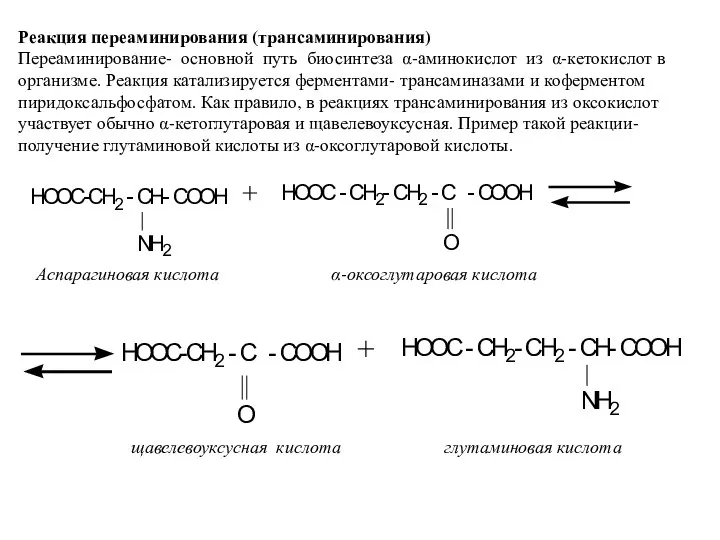
- 15. Реакция переаминирования (трансаминирования) Переаминирование- основной путь биосинтеза α-аминокислот из α-кетокислот в организме. Реакция катализируется ферментами- трансаминазами
- 16. Пептиды и белки. Первичная структура пептидов и белков Аминокислоты способны к поликонденсации, в результате которой образуется
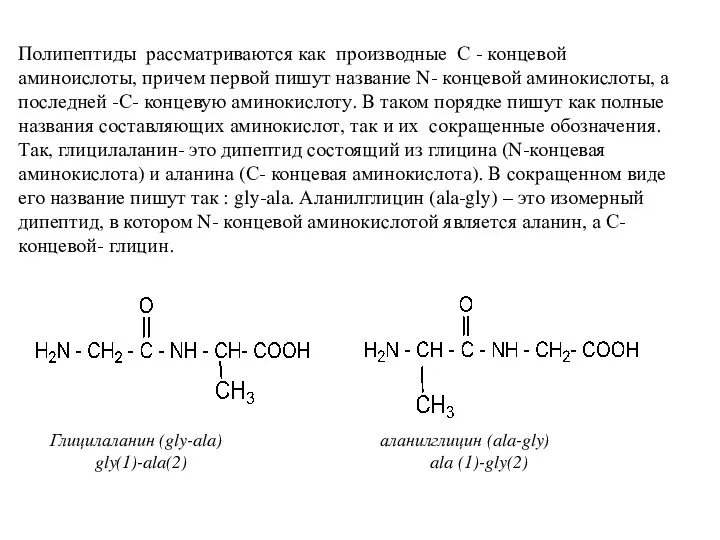
- 17. Полипептиды рассматриваются как производные С - концевой аминоислоты, причем первой пишут название N- концевой аминокислоты, а
- 19. Скачать презентацию




 Презентация на тему Общая характеристика подгруппы углерода
Презентация на тему Общая характеристика подгруппы углерода  Распределение электронов в атоме по энергетическим уровням
Распределение электронов в атоме по энергетическим уровням Скорость химических реакций
Скорость химических реакций Классификация химических реакций. Окислительно-восстановительные реакции
Классификация химических реакций. Окислительно-восстановительные реакции Генетический ряд переходного элемента
Генетический ряд переходного элемента Предмет органической химии. Теория химического строения органических веществ. 9 класс
Предмет органической химии. Теория химического строения органических веществ. 9 класс Генетичні зв’язки між неорганічними речовинами
Генетичні зв’язки між неорганічними речовинами Коррозия металла
Коррозия металла Строение сложного фермента
Строение сложного фермента Молочная кислота
Молочная кислота Органическая химия Жиры
Органическая химия Жиры Алюминий
Алюминий Водород – первый элемент в периодической таблице
Водород – первый элемент в периодической таблице Полімери. Пінополістирол
Полімери. Пінополістирол Изомерия, её виды
Изомерия, её виды Аргентум, или серебро
Аргентум, или серебро Азот
Азот Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Харктеристика металлов
Харктеристика металлов Соли
Соли Кислоты основания и соли как электролиты
Кислоты основания и соли как электролиты Понятие Эффективность. Принцип Ле-Шателье
Понятие Эффективность. Принцип Ле-Шателье Периодическая система
Периодическая система Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год
Презентацию выполнила ученица 10 класса Поликарпова Диана 2010 год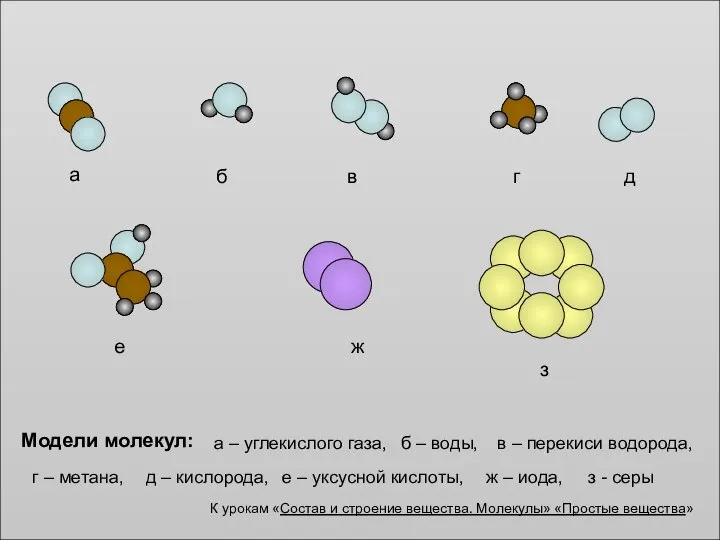 Модели молекул
Модели молекул Алкины. Номенклатура алкинов
Алкины. Номенклатура алкинов Алканы
Алканы Основные понятия органической химии
Основные понятия органической химии