Содержание
- 2. ПЛАН Основные понятия химической термодинамики. Функции состояния системы. Первый закон термодинамики.
- 3. ЦЕЛИ ЛЕКЦИИ ОБУЧАЮЩАЯ: сформировать знания об основах химической термодинамики, первом законе термодинамики. РАЗВИВАЮЩАЯ: расширить кругозор обучающихся
- 4. Термодинамика - это наука, изучающая взаимные превращения различных видов энергии, связанные с переходом энергии в форме
- 5. Основные понятия и термины Термодинамическая система (ТД система) - это любой объект природы, состоящий из достаточно
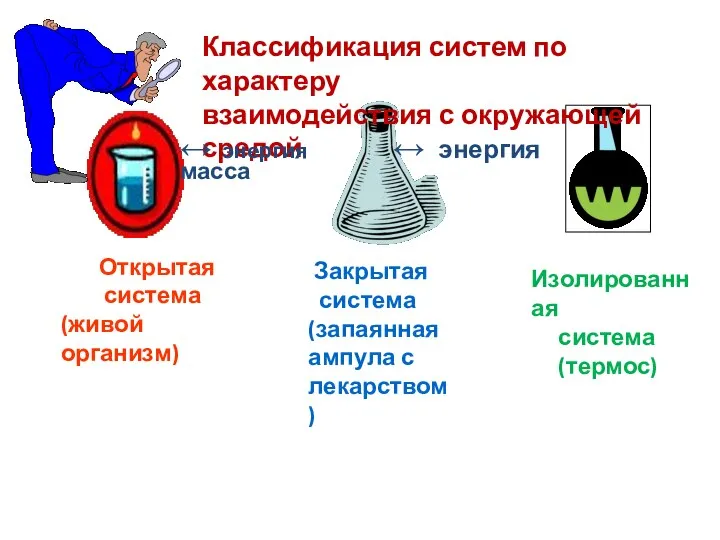
- 6. Основные понятия химической термодинамики Часть объектов природы, не входящих в систему, называется средой. Важными характеристиками системы
- 7. Открытая система (живой организм) Закрытая система (запаянная ампула с лекарством) Изолированная система (термос) Классификация систем по
- 8. Основные понятия химической термодинамики Фаза - это часть системы с одинаковыми физическими и химическими свойствами, отделенная
- 9. Основные понятия химической термодинамики В зависимости от фазового состояния различают: 1. Гомогенные системы. Это системы, в
- 10. Основные понятия химической термодинамики Термодинамическое состояние системы - совокупность всех физических и химических свойств системы. Качественно
- 11. Основные понятия химической термодинамики
- 12. Основные понятия химической термодинамики Термодинамические параметры называются стандартными, если они определяются при стандартных условиях. К стандартным
- 13. Основные понятия химической термодинамики Термодинамический процесс - переход системы из одного равновесного состояния в другое, сопровождающийся
- 14. Основные понятия химической термодинамики В зависимости от того, какой из параметров состояния при протекании термодинамического процесса
- 15. Функции состояния системы В термодинамике для определения изменения энергии системы пользуются различными энергетическими характеристиками, которые называются
- 16. Функции состояния системы К термодинамическим функциям системы относятся: 1. Внутренняя энергия (U). 2. Энтальпия (Н). 3.
- 17. Функции состояния системы 1. Внутренняя энергия (U) Внутренняя энергия системы складывается из кинетической энергии движения молекул
- 18. Внутренняя энергия (U): Абсолютное значение внутренней энергии измерить невозможно, поэтому измеряют ее приращение: ΔUсистемы = Uкон
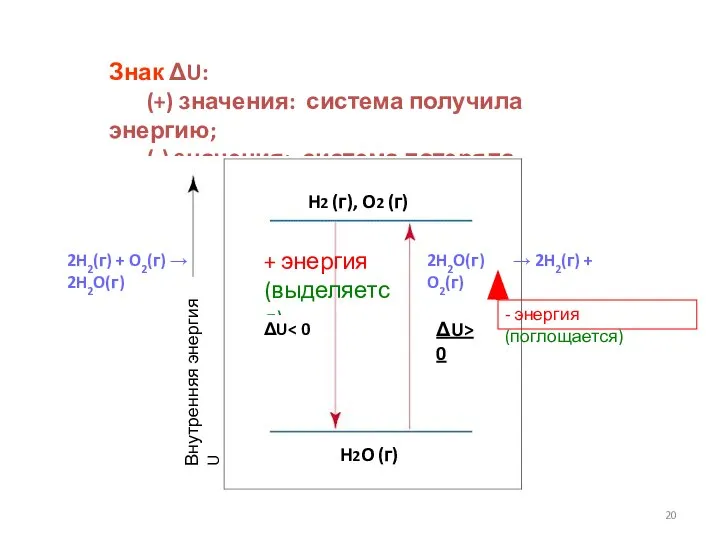
- 19. Знак ΔU: (+) значения: система получила энергию; (-) значения: система потеряла энергию. 2H2O(г) → 2H2(г) +
- 20. Знак ΔU: (+) значения: система получила энергию; (-) значения: система потеряла энергию. 2H2O(г) → 2H2(г) +
- 21. Функции состояния системы ΔU=Q V , где Q V - теплота изохорного процесса. ΔU - кДж/моль
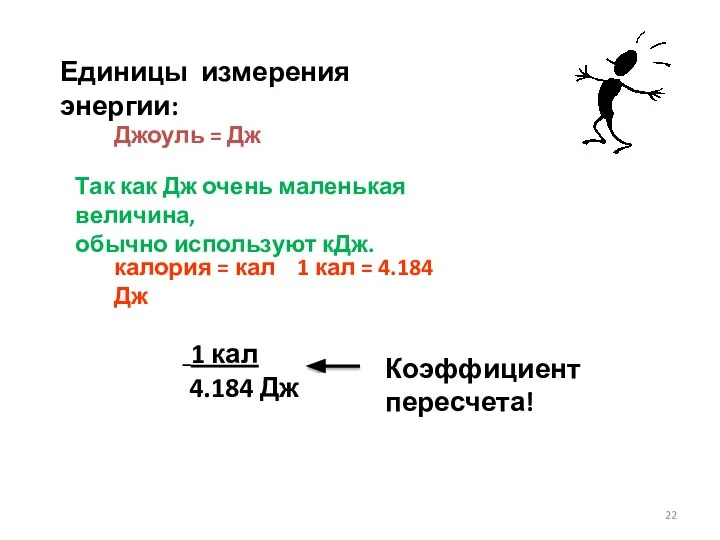
- 22. Единицы измерения энергии: Джоуль = Дж Так как Дж очень маленькая величина, обычно используют кДж. калория
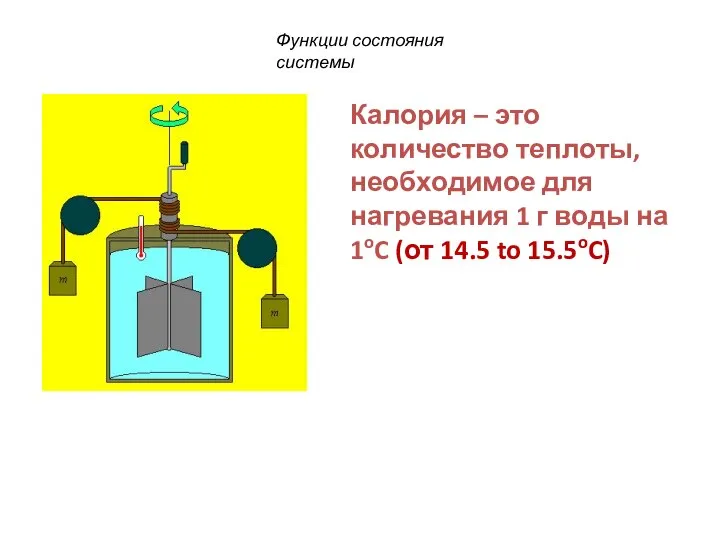
- 23. Калория – это количество теплоты, необходимое для нагревания 1 г воды на 1oC (от 14.5 to
- 24. Первый закон термодинамики Первый закон термодинамики является постулатом: он не может быть доказан логическим путем, а
- 25. Первый закон термодинамики Химические процессы сопровождаются изменением энергии.
- 26. Вечный двигатель первого рода невозможен (работа требует энергии). Первый закон термодинамики
- 27. На что расходуется теплота, подведенная к системе?
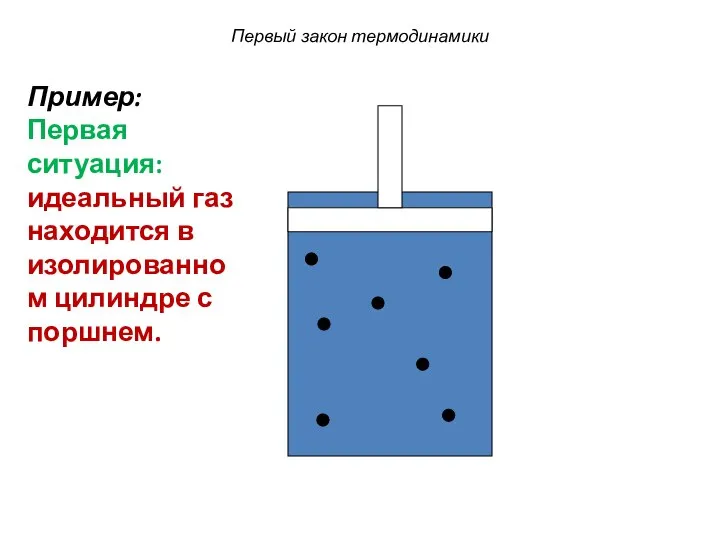
- 28. Первый закон термодинамики Пример: Первая ситуация: идеальный газ находится в изолированном цилиндре с поршнем.
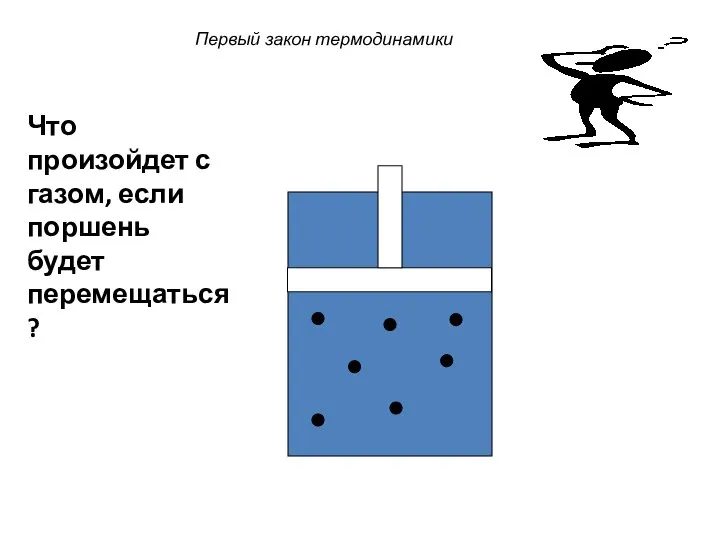
- 29. Первый закон термодинамики Что произойдет с газом, если поршень будет перемещаться?
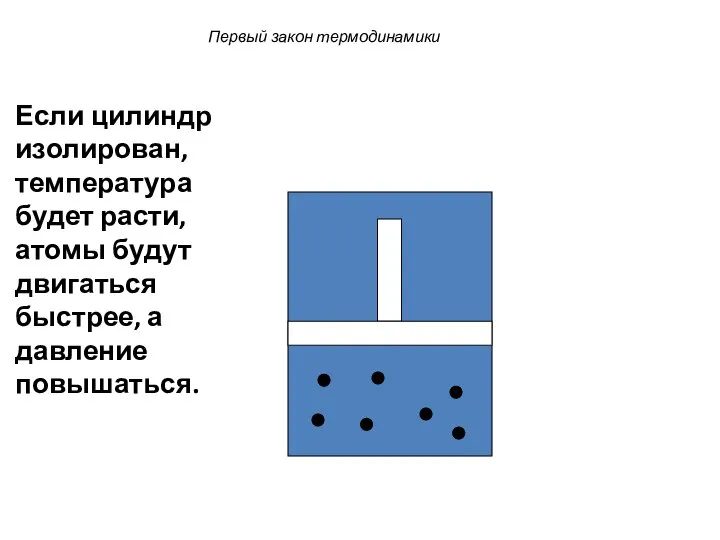
- 30. Первый закон термодинамики Если цилиндр изолирован, температура будет расти, атомы будут двигаться быстрее, а давление повышаться.
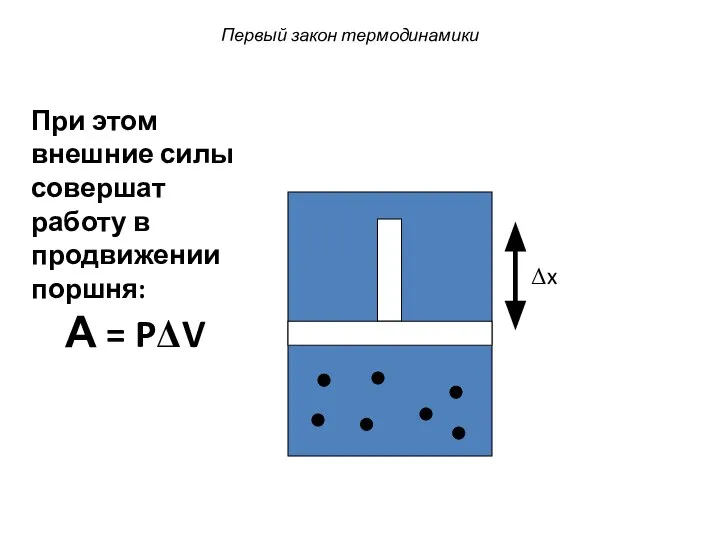
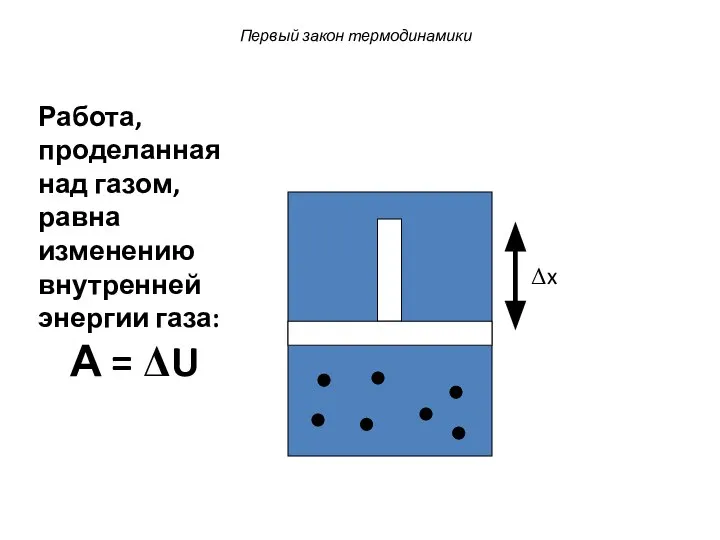
- 31. Первый закон термодинамики Δx При этом внешние силы совершат работу в продвижении поршня: А = PΔV
- 32. Первый закон термодинамики Δx Работа, проделанная над газом, равна изменению внутренней энергии газа: А = ΔU
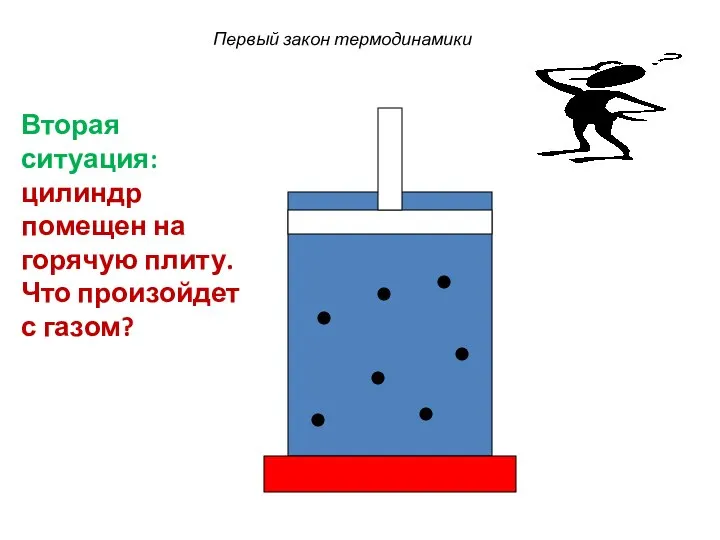
- 33. Первый закон термодинамики Вторая ситуация: цилиндр помещен на горячую плиту. Что произойдет с газом?
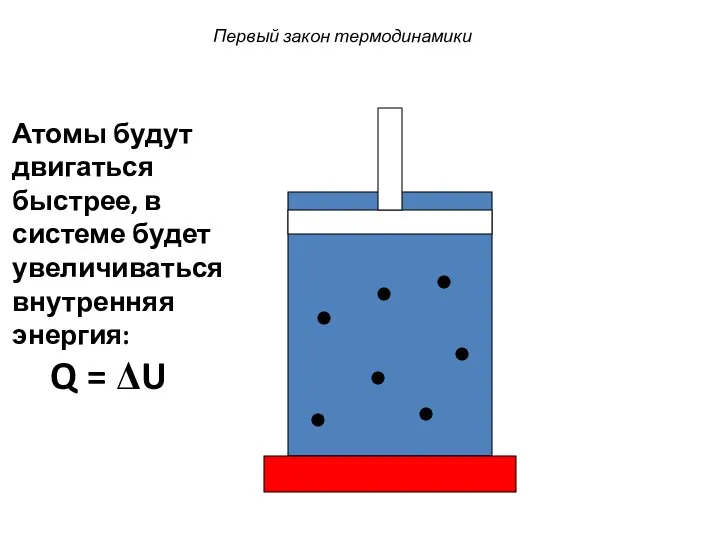
- 34. Первый закон термодинамики Атомы будут двигаться быстрее, в системе будет увеличиваться внутренняя энергия: Q = ΔU
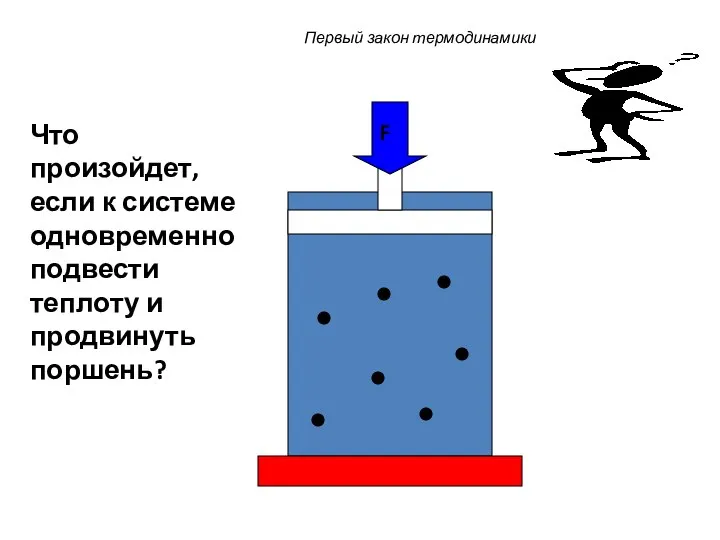
- 35. Первый закон термодинамики F Что произойдет, если к системе одновременно подвести теплоту и продвинуть поршень?
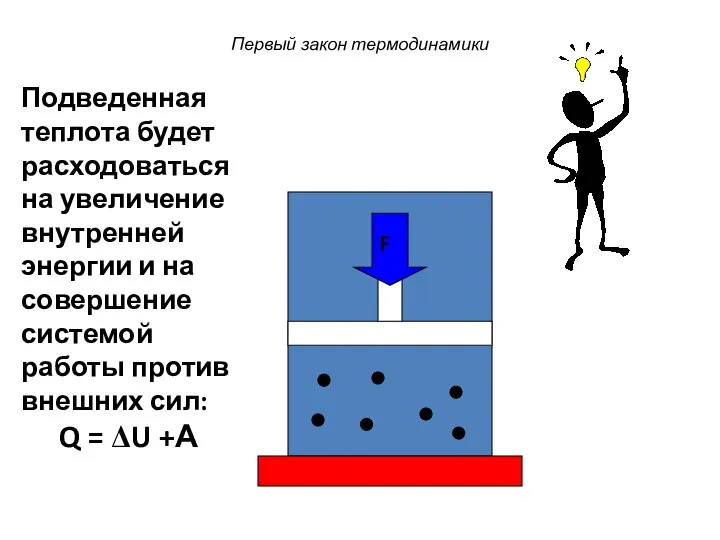
- 36. Первый закон термодинамики F Подведенная теплота будет расходоваться на увеличение внутренней энергии и на совершение системой
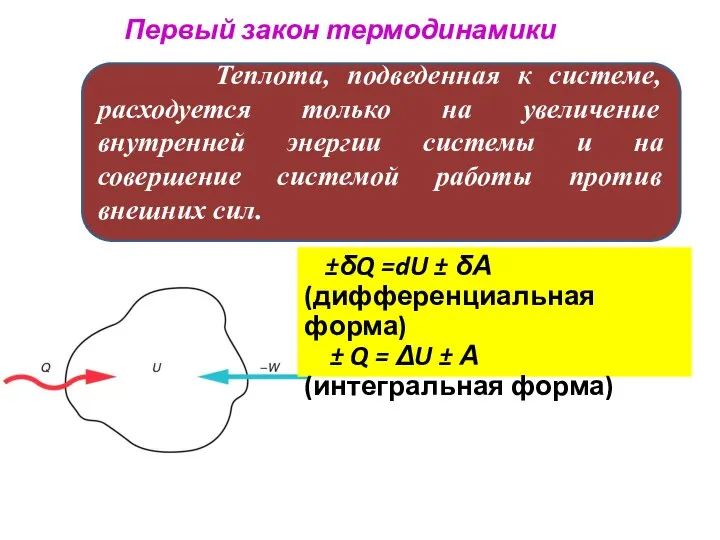
- 37. Первый закон термодинамики Теплота, подведенная к системе, расходуется только на увеличение внутренней энергии системы и на
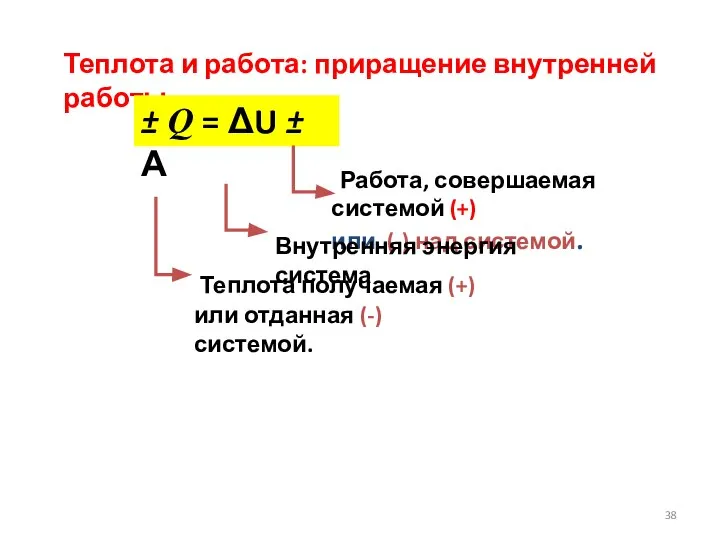
- 38. Теплота и работа: приращение внутренней работы ± Q = ΔU ± А Работа, совершаемая системой (+)
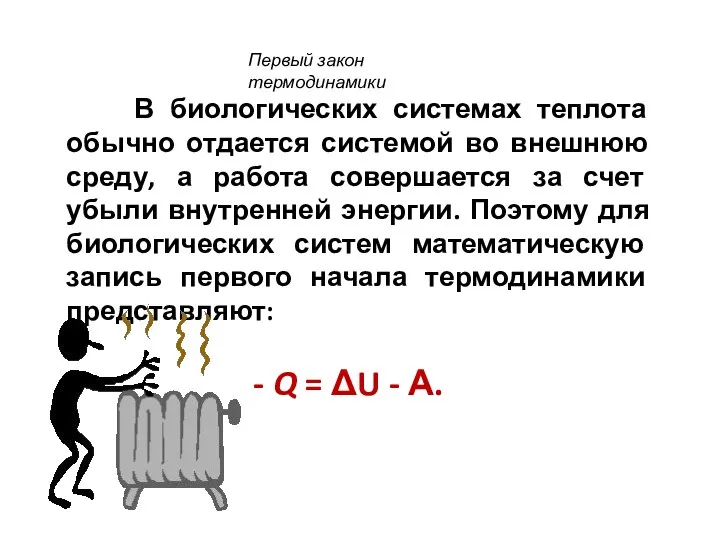
- 39. В биологических системах теплота обычно отдается системой во внешнюю среду, а работа совершается за счет убыли
- 40. Первый закон термодинамики Теплота (Q) - форма передачи энергии, посредством хаотического столкновения частиц соприкасающихся систем, системы
- 41. Первый закон термодинамики Работа (А) - форма передачи энергии от системы в окружающую среду или другой
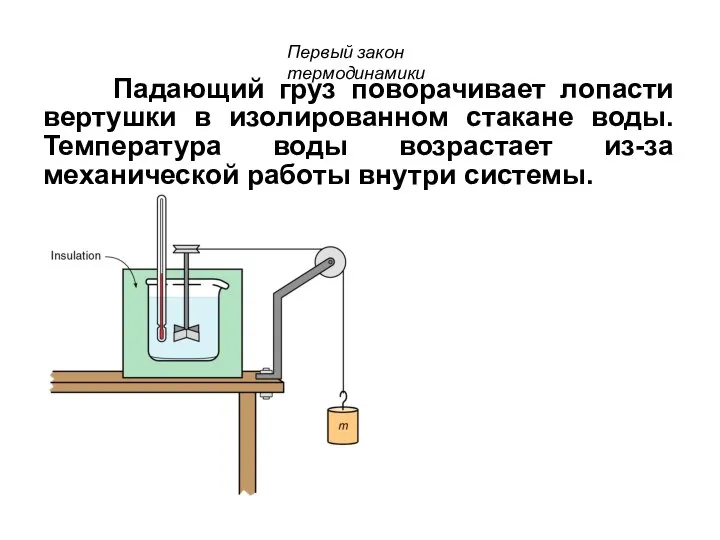
- 42. Падающий груз поворачивает лопасти вертушки в изолированном стакане воды. Температура воды возрастает из-за механической работы внутри
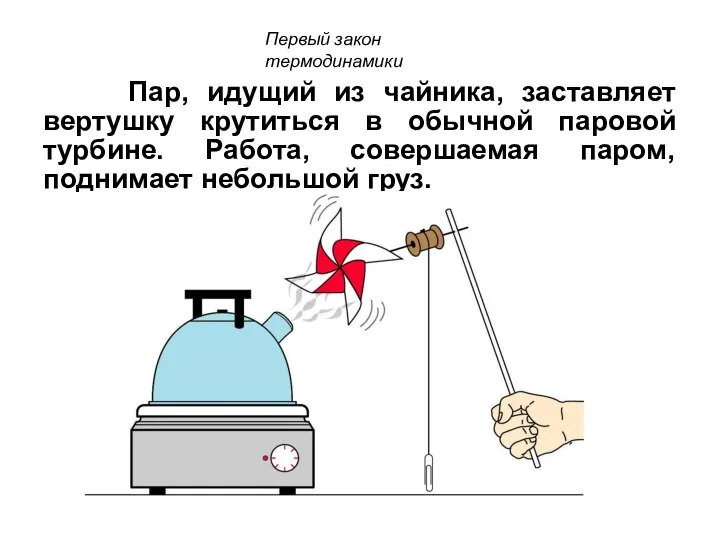
- 43. Пар, идущий из чайника, заставляет вертушку крутиться в обычной паровой турбине. Работа, совершаемая паром, поднимает небольшой
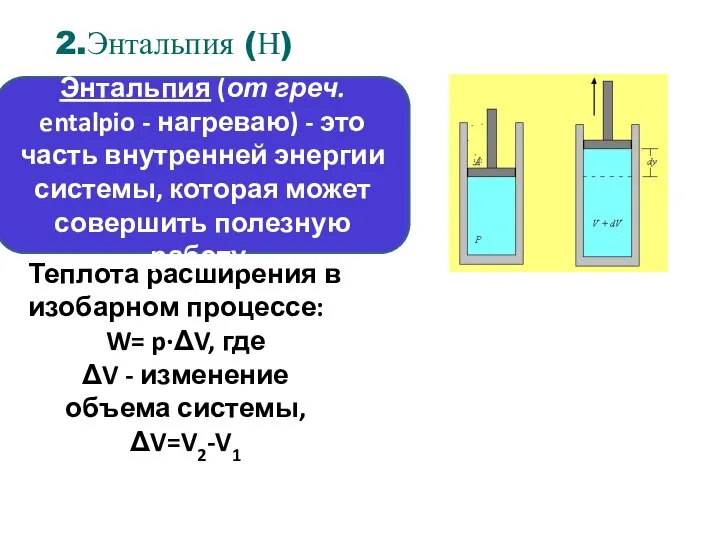
- 44. Теплота расширения в изобарном процессе: W= p·ΔV, где ΔV - изменение объема системы, ΔV=V2-V1 Энтальпия (от
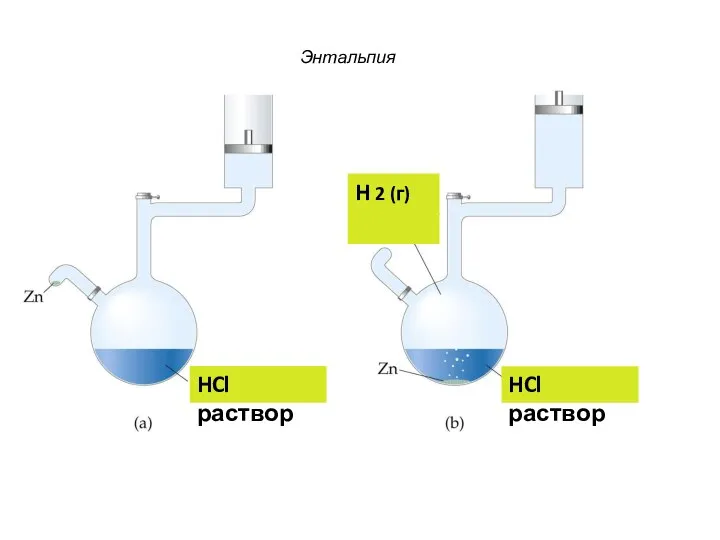
- 45. Энтальпия HCl раствор HCl раствор H 2 (г)
- 46. Функции состояния системы Из первого закона ТД: Q = ΔU + А Qр = ΔU +
- 48. Скачать презентацию

























 Соединения железа
Соединения железа Биогенный элемент. Кобальт (Со)
Биогенный элемент. Кобальт (Со) Кроссворд по теме Металлы
Кроссворд по теме Металлы 01_Osnovnye_ponyatia_i_zakony_khimii
01_Osnovnye_ponyatia_i_zakony_khimii Ковалентная связь
Ковалентная связь Кислоты. Кислоты в животном мире
Кислоты. Кислоты в животном мире ИКТ как средство реализации проблемного обучения на уроках химии
ИКТ как средство реализации проблемного обучения на уроках химии Блок-схема функциональных элементов клеточного метаболизма
Блок-схема функциональных элементов клеточного метаболизма Свойства Н2
Свойства Н2 Органическая химия. Введение
Органическая химия. Введение Кислоты. Химический диктант. 8 класс
Кислоты. Химический диктант. 8 класс Полимерные материалы
Полимерные материалы Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12
Лиофильные и лиофобные дисперсные системы. Свойства лиофильных систем. Лекция 12 Применение муравьиного спирта
Применение муравьиного спирта Классификация неорганический веществ
Классификация неорганический веществ Презентация на тему Валентность и степень окисления (8 класс)
Презентация на тему Валентность и степень окисления (8 класс)  Юный химик. Интерактивная интеллектуальная игра
Юный химик. Интерактивная интеллектуальная игра Hydroxidy. Vlastnosti
Hydroxidy. Vlastnosti Круговорот азота в природе
Круговорот азота в природе Кислоты и соли
Кислоты и соли Физические свойства минералов
Физические свойства минералов Углеводы. Классификация углеводов
Углеводы. Классификация углеводов Ұнтақтар - дәрілік түр ретінде
Ұнтақтар - дәрілік түр ретінде Спирты. Классификация, изомерия
Спирты. Классификация, изомерия Виды автомобильного топлива
Виды автомобильного топлива Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Щелочноземельные металлы
Щелочноземельные металлы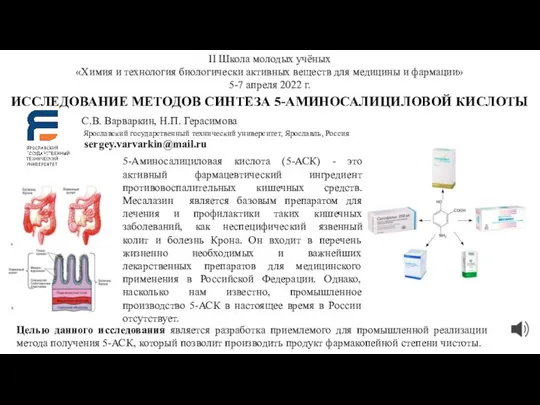 Исследование методов синтеза 5-аминосалициловой кислоты
Исследование методов синтеза 5-аминосалициловой кислоты