Слайд 2ДЛЯ ЭКСПЕРИМЕНТА ПОНАДОБИТСЯ
Реактивы: вода , сахарная пудра , серная кислота
Посуда: химический стакан
Оборудование:

стеклянная палочка
Слайд 3В химический стакан насыпаем сахарную пудру.

Слайд 5Перемешиваем сахарную пудру и воду.

Слайд 6Добавляем концентрированную серную кислоту.

Слайд 7Перемешиваем стеклянной палочкой до начала бурной экзотермической реакции.

Слайд 9Как это происходит, и почему из белоснежного сахара и прозрачной жидкости образуется
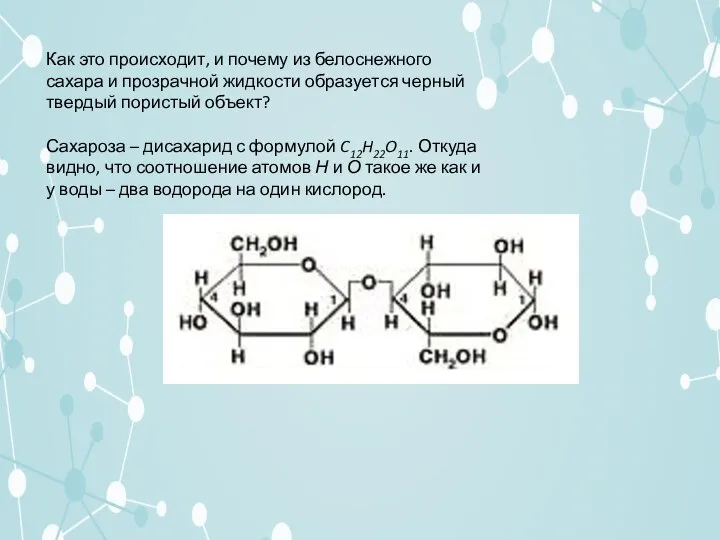
черный твердый пористый объект?
Сахароза – дисахарид с формулой C12H22O11. Откуда видно, что соотношение атомов Н и О такое же как и у воды – два водорода на один кислород.
Слайд 10Концентрированная серная кислота поглощает воду из сахара, а оставшийся углерод выделяется в

виде угля.
Как и большинство реакций серной кислоты, эта реакция экзотермическая, то есть проходит с выделением теплоты. Поэтому вода испаряется, и остается только сухой твердый остаток.
2С12Н22О11 + 2Н2SО4 = 23С + СО2 + + 2SО2 + 24Н2О
Газы, образующиеся в процессе, вспенивают углерод, и он становится пористым.
Зрелищно. Жаль только, что углерод выделяется в виде графита, а не в другой его модификации – алмаза.









 Химические равновесия в растворах. Лекция 2. Часть 1
Химические равновесия в растворах. Лекция 2. Часть 1 Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу
Көміртекті Нанотүтікшелерді синтездеу үшін нанокатализаторлар алу Протолитическая теория кислот и оснований. Буферные растворы
Протолитическая теория кислот и оснований. Буферные растворы Determination of optical properties of pentacoordinated silicon complexes using DFT method
Determination of optical properties of pentacoordinated silicon complexes using DFT method Малотоннажные термопласты
Малотоннажные термопласты Строение атома
Строение атома Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Химические знания - в жизнь. Основы нутрициологии
Химические знания - в жизнь. Основы нутрициологии Peek. Сферы применения
Peek. Сферы применения Типы химических реакций
Типы химических реакций Svins. Iegūšana
Svins. Iegūšana Применение серы, хлора, углерода
Применение серы, хлора, углерода Радиоакивные металлы
Радиоакивные металлы Понятие о сплавах и методах их получения
Понятие о сплавах и методах их получения Алкины
Алкины Кислоты, их состав и название
Кислоты, их состав и название Мезомерный эффект
Мезомерный эффект Презентация на тему Физические и химические явления 8 класс
Презентация на тему Физические и химические явления 8 класс  Сера
Сера Моделирование фазовых систем. Тройные взаимные системы
Моделирование фазовых систем. Тройные взаимные системы Химическое равновесие и способы его смещения
Химическое равновесие и способы его смещения Презентация на тему Эфиры и жиры
Презентация на тему Эфиры и жиры  Металлы. Контрольная работа
Металлы. Контрольная работа Получение армированных фотополимерных композиций
Получение армированных фотополимерных композиций Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Презентация на тему Карбонаты
Презентация на тему Карбонаты  строение атома обуч-контр прогр
строение атома обуч-контр прогр