Содержание
- 2. Качественные реакции
- 3. Признаки, по которым одно вещество отличается от другого: Внешний вид. Характерный запах. Цвет. Плотность. Растворимость в
- 4. Признаки химических реакций: Изменение цвета. Выделение газа. Выпадение осадка. Растворение осадка. Появление запаха. Характерный звук. Выделение
- 5. Распознавание веществ, не имеющих запаха, невидимых. Как Вы думаете? Как узнать, в каком сосуде находятся кислород
- 6. Качественные реакции – это химические превращения, сопровождающиеся характерными признаками, с помощью которых проводят распознавание веществ. Явления
- 7. РЕАКТИВ. Вещество, с помощью которого проводят качественную реакцию, называется реактивом на определяемое вещество. Известковая вода –
- 8. Аналитический сигнал на определённый реактив должен появляться только при взаимодействии с одним или, по крайней мере
- 9. Определение состава пищевых продуктов проводят с помощью качественных реакций. Наличие кислот – с помощью веществ –
- 10. Реактив на крахмал. Наличие крахмала в продуктах определяют реактивом на крахмал - раствором йода.
- 11. Лабораторный опыт. С помощью йодной настойки из аптечки проведите обнаружение крахмала в картофеле, хлебе, макаронных изделиях.
- 12. Где же применяются качественные реакции? В медицине: при приготовлении лекарств, проведении анализов на содержание различных веществ
- 13. ТИТРИМЕТРИЧЕСКИЙ МЕТОД АНАЛИЗА
- 14. Основные понятия и их суть: Титриметрический метод анализа – метод количественного анализа, основанный на точном измерении
- 15. Основные понятия и их суть: Титрование - медленное прибавление (небольшими порциями) титрованного (стандартного, титранта, рабочего) раствора
- 16. Основные понятия и их суть: Конечная точка титрования (КТТ) - это точка (момент) титрования устанавливаемая экспериментально
- 17. Основные понятия и их суть: Аликвотная доля (аликвота) − точно известная часть анализируемого раствора, взятая для
- 18. Требования к реакции в титриметрии: 1) Вещества, которые вступают в реакцию, должны реагировать в строго определенных
- 19. Способы титрования Метод отдельных навесок взвешивают на аналитических весах точную навеску m(A) стандартного вещества А, переносят
- 20. Метод пипетирования - в мерной колбе готовят раствор стандартного вещества с известной концентрацией (по точной навеске
- 21. Оптические методы анализа
- 22. Оптические методы анализа основаны на способности атомов и молекул вещества испускать, поглощать или рассеивать электромагнитное излучение.
- 23. Оптические методы 1. Молекулярно-абсорбционный спектральный анализ. 2. Атомная спектроскопия. 3. Рефрактометрический анализ. 4. Люминесцентный анализ. 5.
- 24. Основана на измерении поглощения света окрашенными растворами в видимой части спектра. Используют химические реагенты, которые образуют
- 25. Визуальная колориметрия Проводится измерение интенсивности окраски раствора. Сравнение интенсивности окрашивания растворов проводят невооруженным глазом.
- 26. Визуальные колориметрические методы 1. Метод стандартных серий; 2. Метод колориметрического титрования; 3. Метод уравнивания; 4. Метод
- 27. 1. Метод стандартных серий (метод цветной шкалы) Сравнивают интенсивность полученной окраски исследуемого и стандартных растворов. Визуальные
- 28. 2. Метод колориметрического титрования (метод дублирования). По совпадению интенсивности окрасок стандартного и исследуемого растворов определяют содержание
- 29. 3. Метод уравнивания Основан на том, что, изменяя толщину слоя двух растворов с различной концентрацией одного
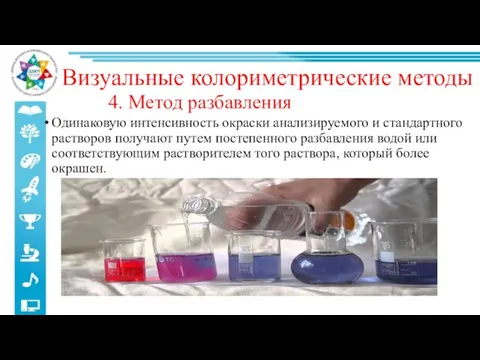
- 30. 4. Метод разбавления Одинаковую интенсивность окраски анализируемого и стандартного растворов получают путем постепенного разбавления водой или
- 32. Скачать презентацию




























 Кремний и его соединения
Кремний и его соединения Химические элементы
Химические элементы Соли. Определение, состав, классификация, физические свойства, применение
Соли. Определение, состав, классификация, физические свойства, применение Введение в органическую химию. Состав и структура органических веществ
Введение в органическую химию. Состав и структура органических веществ Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Каучук. Строение и применение
Каучук. Строение и применение Загадочный фосфор
Загадочный фосфор Logo кроссворд первоначальные понятия. 8 класс
Logo кроссворд первоначальные понятия. 8 класс металлы
металлы Физические свойства минералов
Физические свойства минералов Серная кислота и ее соли
Серная кислота и ее соли Химические реакции
Химические реакции Презентация на тему Вычисления массовой доли растворенного вещества
Презентация на тему Вычисления массовой доли растворенного вещества  Введение в дисциплину Процессы и аппараты химической технологии
Введение в дисциплину Процессы и аппараты химической технологии Кремний – химический элемент или природный дар
Кремний – химический элемент или природный дар Хром
Хром Вода знакомая и не знакомая
Вода знакомая и не знакомая Башня плотности
Башня плотности Классификация реакций. Теория-кинетика
Классификация реакций. Теория-кинетика Марганец. Химия элементов. Кислородосодержащие соединения
Марганец. Химия элементов. Кислородосодержащие соединения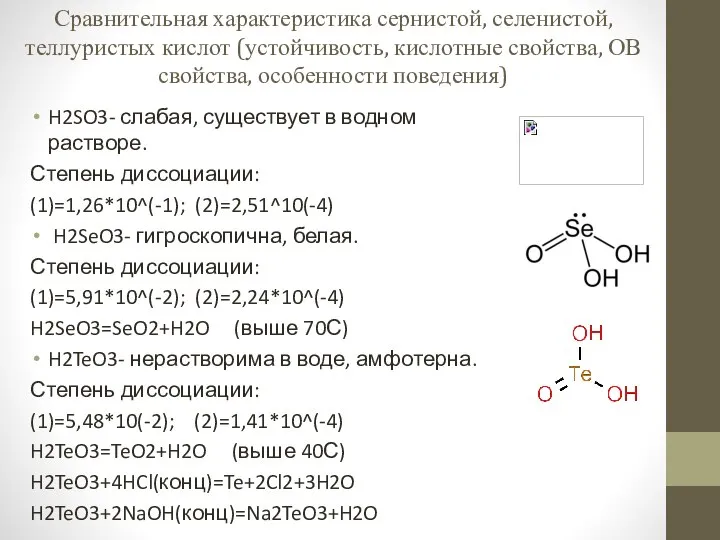 Сравнительная характеристика сернистой, селенистой, теллуристых кислот
Сравнительная характеристика сернистой, селенистой, теллуристых кислот Химия в быту
Химия в быту Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Спирты. Методы получения
Спирты. Методы получения Теория радиационной деформации в некубических металлах: явление анизотропной диффузии
Теория радиационной деформации в некубических металлах: явление анизотропной диффузии Автоматизация процесса сушки миксера печи СКН
Автоматизация процесса сушки миксера печи СКН Скорость химической реакции
Скорость химической реакции Лабораторное оборудование. Тесты
Лабораторное оборудование. Тесты