Содержание
- 2. Имеют ли вес атомы и как его измерить? Джон Дальтон (1766-1844) английский физик и химик ,
- 3. Массы атомов ничтожно малы Масса самого лёгкого атома водорода 0,000 000 000 000 000 000 000
- 4. Абсолютная и относительная масса Иногда используются не абсолютные , а относительные величины ; например, диетологи ,
- 5. Эталон для сравнения атомных масс Учёные пытались сопоставить во сколько раз массы атомов одних элементов тяжелее
- 6. Атомная единица массы m(1 а.е.м.)=0,00000000000000000000000000166кг=1,66 ×10 -27кг ma(H)=1 а.е.м. ma(He)=4 а.е.м.
- 7. Относительная атомная масса -Аr Аr показывает во сколько раз масса атома элемента больше 1/12 части массы
- 8. Как определить Аr по таблице Д. И. Менделеева
- 9. Значения относительных атомных масс некоторых химических элементов водород 1 1,00797 кислород углерод 15,9994 12,01115 8 6
- 10. Дробное значение Аr хлор 17 35,454 В расчётах используют значения относительных атомных масс , округлённые до
- 11. Что означают записи: ma(Al)=27 a.e.м. ma(S)=32 a.e.м. Аr(Al)=26,9815≈27 Ar(S)=32,064≈32 Напишите округлённые значения относительных атомных масс элементов
- 12. Относительная молекулярная масса -Мr показывает во сколько раз масса молекулы вещества больше 1/12 массы атома углерода
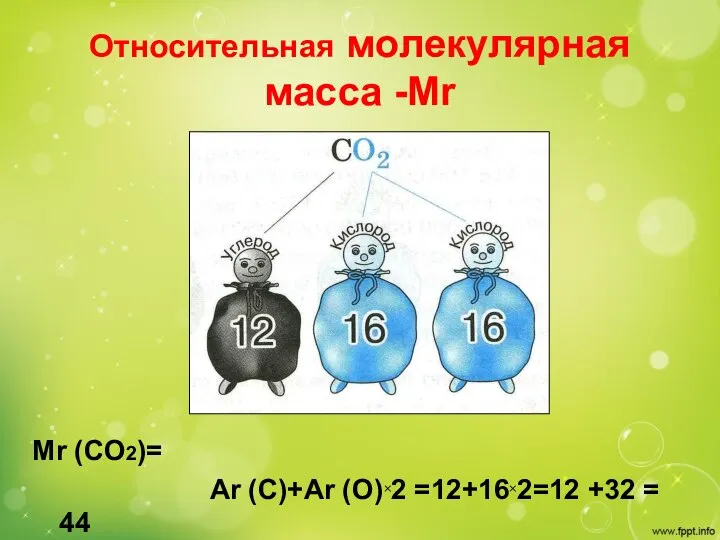
- 13. Относительная молекулярная масса -Мr Mr (CO2)= Ar (C)+Ar (O)×2 =12+16×2=12 +32 = 44
- 14. Рассчитайте Мr (H2) = Mr (СаСl2) = Mr (CaCO3) = Мr (Ca(OH)2)= Mr (СН3СООН)= Мr (Ca3(PO4)2)=
- 15. Химический диктант I вариант Мr(SO3) = Mr(NO2) = Mr(Al2S3) = Mr(Cl2) = Mr(K 2CO3) = Mr(Al(OH)3)
- 16. IV. Массовая доля элемента в веществе. * I. Массовая доля - w w(Э) = n Ar(Э)
- 18. Скачать презентацию














 Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Полезные ископаемые
Полезные ископаемые Химические средства защиты растений. Последствия применения пестицидов
Химические средства защиты растений. Последствия применения пестицидов Открытие Менделеева Д. И
Открытие Менделеева Д. И Изомерия и ее виды
Изомерия и ее виды Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов
Положение металлов в периодической системе Д.И. Менделеева и особенности строения их атомов Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи
Классификация простейших неорганических соединений. Свойства оксидов. Кислоты. Щёлочи Сутек өндірісінің болашақ технологиясы - фотокатализ
Сутек өндірісінің болашақ технологиясы - фотокатализ Современные оборудования в лаборатории
Современные оборудования в лаборатории Зонная структура металлов, диэлектриков и полупроводников
Зонная структура металлов, диэлектриков и полупроводников Мыло и синтетические моющие средства
Мыло и синтетические моющие средства СПИРТЫ, ФЕНОЛЫ
СПИРТЫ, ФЕНОЛЫ Углеводы, 2 часть. Лекция 15
Углеводы, 2 часть. Лекция 15 Электролиты и неэлектролиты. Электролитическая диссоциация
Электролиты и неэлектролиты. Электролитическая диссоциация ОВР. Реакции
ОВР. Реакции Турнир Деда Мороза. Викторина по химии
Турнир Деда Мороза. Викторина по химии Презентация на тему Удобрения и их классификация
Презентация на тему Удобрения и их классификация  Характеристика галогенов
Характеристика галогенов Изомерия, её виды
Изомерия, её виды Изучение фотокатализа в химии
Изучение фотокатализа в химии Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Fyzikálne a chemické deje
Fyzikálne a chemické deje Алканы и алкены
Алканы и алкены Періодична система хімічних елементів
Періодична система хімічних елементів Классификация химических реакций
Классификация химических реакций Слідство ведуть знавці
Слідство ведуть знавці Действие активированного угля
Действие активированного угля Оксосоединения. Альдегиды и кетоны
Оксосоединения. Альдегиды и кетоны