Содержание
- 2. «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются» Д.И. Менделеев
- 3. План: Открытие периодического закона Периодический закон и строение атома Периодическая система и строение атома Значение закона
- 4. Дмитрий Иванович Менделеев (1834 – 1907 г.г.)
- 5. Расположение карточек по возрастанию атомного веса химического элемента Н 1 Li 7 Be 9
- 6. 1 марта 1869 года Менделеев сформулировал Периодический закон “Свойства элементов, а также образуемых ими простых и
- 7. Д.И. Менделеев «Периодическому закону будущее не грозит разрушением, а только надстройка и развитие обещаются»
- 8. Современная формулировка периодического закона “Свойства элементов, а также образуемых ими простых и сложных веществ находятся в
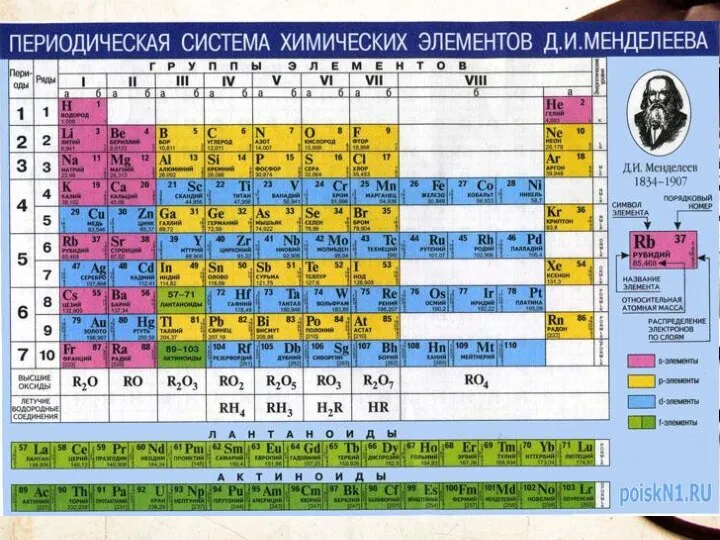
- 9. Периодическая система химических элементов (ПСХЭ) - это графическое изображение закона, каждое обозначение отражает какую либо особенность
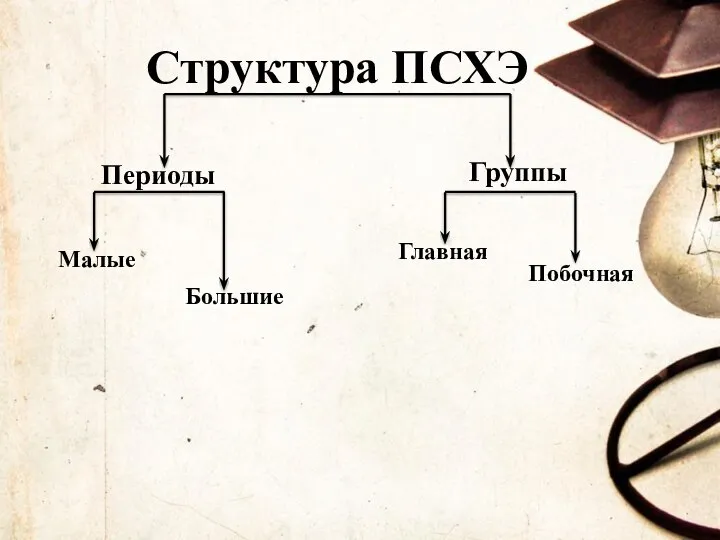
- 11. Структура ПСХЭ Периоды Группы Малые Большие Главная Побочная
- 12. Периоды - горизонтальные ряды элементов, в пределах которых свойства элементов изменяются последовательно. Группы- это вертикальные столбцы
- 13. В периодах СЛЕВА НАПРАВО металлические свойства ослабевают, а неметаллические усиливаются. а) увеличиваются заряды атомных ядер; б)
- 14. В группах главных подгруппах СВЕРХУ ВНИЗ металлические свойства элементов усиливаются, а неметаллические ослабевают. а) увеличиваются заряды
- 15. S – это символ элемента СЕРА – это название элемента 32,064 – это атомная масса 16
- 16. 1. В главных подгруппах периодической системы химических элементов Д.И.Менделеева с увеличением заряда ядра радиус атомов, как
- 17. 3. В периодах периодической системы химических элементов Д.И.Менделеева с увеличением заряда ядер атомов не изменяется: 1)
- 19. Скачать презентацию














 Алкадиены
Алкадиены Обмен жиров в организме млекопитающего
Обмен жиров в организме млекопитающего Бинарные соединения – оксиды и летучие водородные соединения. 8 класс
Бинарные соединения – оксиды и летучие водородные соединения. 8 класс Научно-познавательное шоу Юный химик
Научно-познавательное шоу Юный химик Расчет по химическим уравнениям
Расчет по химическим уравнениям Презентация на тему Влияние пищевых добавок на здоровье человека
Презентация на тему Влияние пищевых добавок на здоровье человека  Презентация на тему Биография Д. И. Менделеева
Презентация на тему Биография Д. И. Менделеева  Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака
Изучение микроклимата коровника с целью создания системы очистки воздуха от аммиака Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Химия жиров (липидов)
Химия жиров (липидов) Основи масообміну
Основи масообміну География. Уральские самоцветы
География. Уральские самоцветы Общие химические свойства неметаллов
Общие химические свойства неметаллов Кислоты. Строение, классификации и свойства неорганических кислот
Кислоты. Строение, классификации и свойства неорганических кислот Химическая лаборатория
Химическая лаборатория Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Возможности модернизации совместного производства фенола и ацетона кумольным способом
Возможности модернизации совместного производства фенола и ацетона кумольным способом Карбоновые кислоты
Карбоновые кислоты Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Химическая коррозия
Химическая коррозия Общие способы получения металлов
Общие способы получения металлов 11 типы связей
11 типы связей Соединения азота
Соединения азота Биохимия крови
Биохимия крови Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача
Презентация по Химии "Использование исследовательских и информационно-коммуникационных технологий в обучении химии" - скача Гидролиз солей
Гидролиз солей Самородные металлы
Самородные металлы Презентация на тему Алканы
Презентация на тему Алканы