Содержание
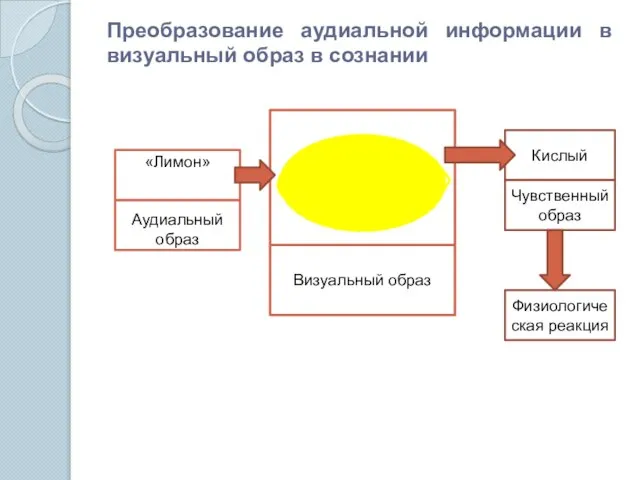
- 2. Преобразование аудиальной информации в визуальный образ в сознании «Лимон» Аудиальный образ Визуальный образ Кислый Чувственный образ
- 3. Стратегия «выдвижения гипотез» в решении задач на «избыток-недостаток» Согласно концепции модернизации образования, сегодня «общеобразовательная школа должна
- 4. 1-й способ: через количество вещества 1) Рассчитать количество вещества по формулам: 2) Соотнести полученные количества веществ
- 5. 4) Определить количество продукта реакции по веществу, взятому в недостатке т.е. по MgCl2: 0,5 моль 0,5
- 6. 2-й способ: метод пропорции 1) Из наличия в условии задачи масс двух реагирующих веществ сделать вывод
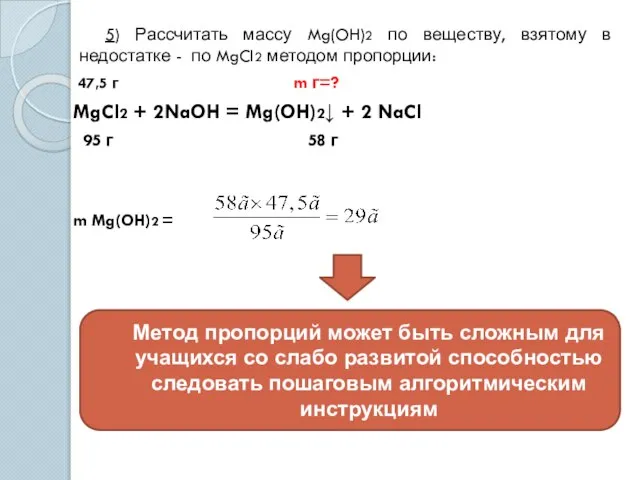
- 7. 5) Рассчитать массу Mg(OH)2 по веществу, взятому в недостатке - по MgCl2 методом пропорции: 47,5 г
- 8. 3-й способ является следствием закона постоянства состава веществ 1) Записать уравнение реакции. Проставить массы, данные в
- 9. 4-й способ: стратегия «ВЫДВИЖЕНИЯ ГИПОТЕЗ» 1) Необходимо посмотреть задачу с позиции конечного результата. Выдвинуть две гипотезы:
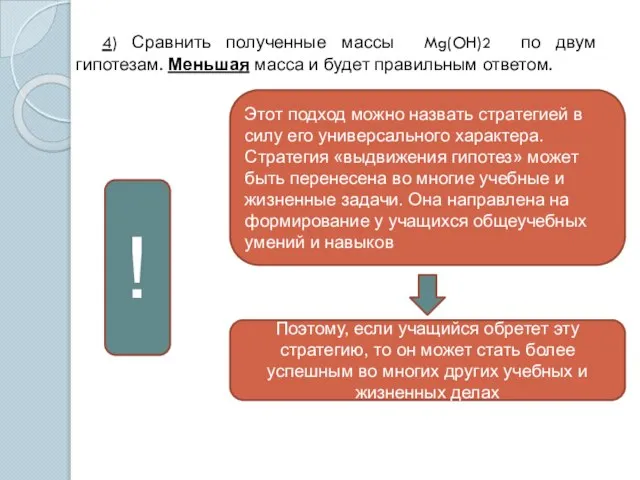
- 10. 4) Сравнить полученные массы Mg(OH)2 по двум гипотезам. Меньшая масса и будет правильным ответом. Этот подход
- 11. Примеры решения задач методом заполнения таблиц Задача №1. Смешали 100г 10%-го р-ра NaOH и 100г 10%-го
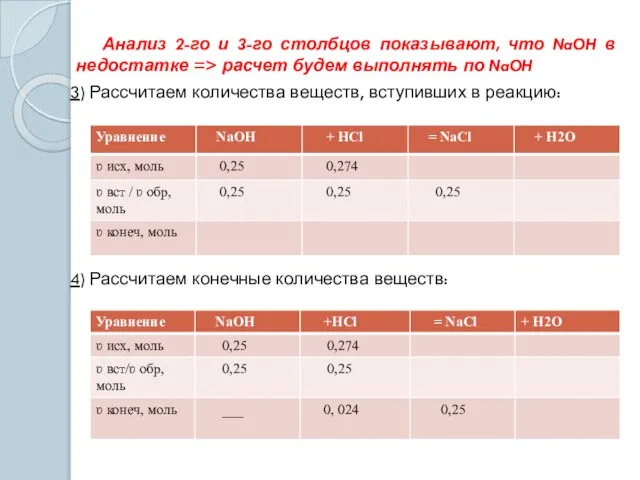
- 12. Анализ 2-го и 3-го столбцов показывают, что NaOH в недостатке => расчет будем выполнять по NaOH
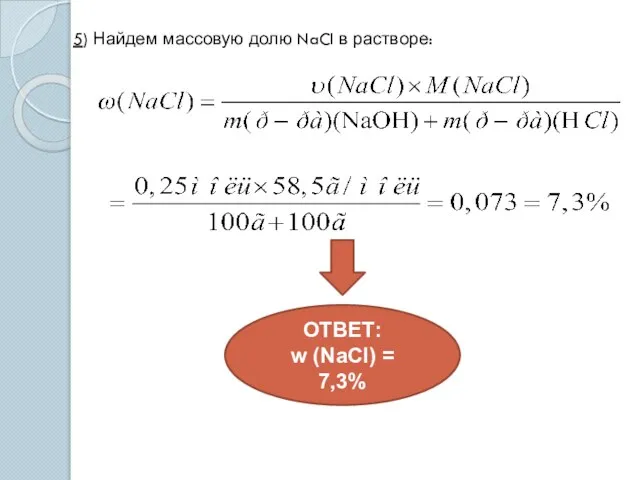
- 13. 5) Найдем массовую долю NaCl в растворе: ОТВЕТ: w (NaCl) = 7,3%
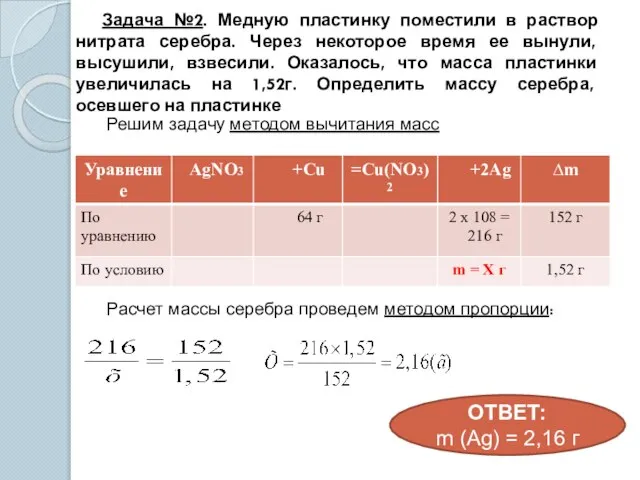
- 14. Задача №2. Медную пластинку поместили в раствор нитрата серебра. Через некоторое время ее вынули, высушили, взвесили.
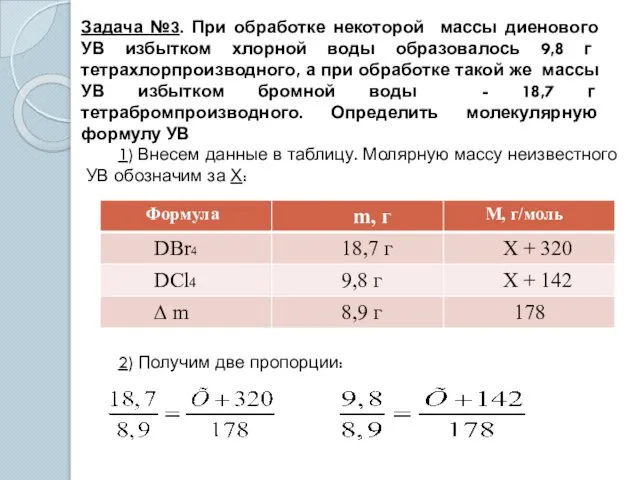
- 15. Задача №3. При обработке некоторой массы диенового УВ избытком хлорной воды образовалось 9,8 г тетрахлорпроизводного, а
- 16. При решении любой пропорции Х = 54 3) Исходя из общей формулы алкадиена CnH2n-2, составим уравнение:
- 17. Задача №4. Масса смеси оксидов углерода равна 44 г, объем смеси 28 л(н.у.). Найти соотношение между
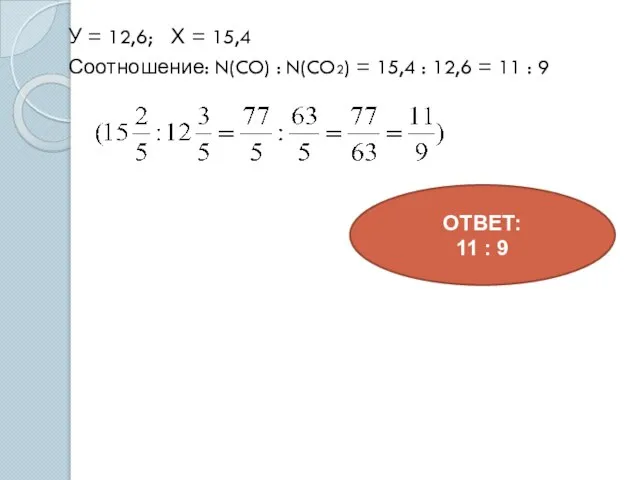
- 18. У = 12,6; Х = 15,4 Соотношение: N(CO) : N(CO2) = 15,4 : 12,6 = 11
- 19. Спасибо за внимание!
- 21. Скачать презентацию










 Кислород и озон
Кислород и озон Ароматические углеводороды. Взаимное влияние радикалов в молекуле толуола
Ароматические углеводороды. Взаимное влияние радикалов в молекуле толуола Химические свойства амфотерных оксидов и гидроксидов
Химические свойства амфотерных оксидов и гидроксидов Соли. Составление формул и номенклатура
Соли. Составление формул и номенклатура Презентация на тему Угольная кислота и её соли (9 класс)
Презентация на тему Угольная кислота и её соли (9 класс)  Презентация на тему Железо 9 класс
Презентация на тему Железо 9 класс  Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок
Фізика гірських порід і процесів. Хімічні зв'язки в мінералах. Іонний зв'язок Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Получение и реакции пиразина
Получение и реакции пиразина Понятие о веществе. Свойства веществ
Понятие о веществе. Свойства веществ Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Алкины. Строение алкинов
Алкины. Строение алкинов Классификация спиртов
Классификация спиртов Реакционная способность химических соединений. Лекция 9
Реакционная способность химических соединений. Лекция 9 Отрасли химии
Отрасли химии Водород – топливо будущего
Водород – топливо будущего Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Углеводы
Углеводы Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1
Особенности растворов высокомолекулярных соединений (ВМС). Вязкость растворов ВМС. Набухание. Рубежный контроль №1 Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения
Строение атома. Связь основных характеристик атома с его положением в таблице Д.И. Менделеева. Способы изображения строения Чему равно общее количество электронов в атоме?
Чему равно общее количество электронов в атоме? Чистые вещества и смеси
Чистые вещества и смеси Сульфиты. Виды сульфидов
Сульфиты. Виды сульфидов Классификация и номенклатура ОС
Классификация и номенклатура ОС Кинетика химических и биохимических процессов. Часть 1
Кинетика химических и биохимических процессов. Часть 1 Презентация по Химии "Законы газового состояния вещества"
Презентация по Химии "Законы газового состояния вещества"  Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов
Биологически важные реакции монофункциональных соединений. Реакционная способность спиртов, фенолов, тиолов, аминов Электронное строение атомов бора и фосфора
Электронное строение атомов бора и фосфора