Содержание
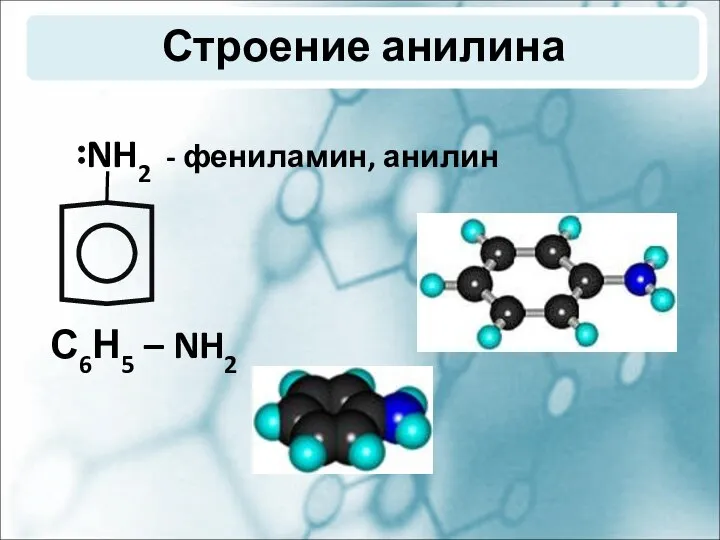
- 2. Строение анилина NH2 - фениламин, анилин С6Н5 – NH2
- 3. Физические свойства Анилин – бесцветная маслянистая жидкость, малорастворимая в воде, со слабым характерным запахом. Тяжелее воды.
- 4. Химические свойства Бензольное ядро оттягивает свободную электронную пару от азота на себя. На атоме азота уменьшается
- 5. Химические свойства С6Н5–NH2 + HCl С6Н5–NH3 Cl хлорид фениламмония – хорошо растворим в воде, при добавлении
- 6. Химические свойства Аминогруппа подает электронную плотность на бензольное кольцо. В результате этого происходит поляризация единого 6-р-электронного
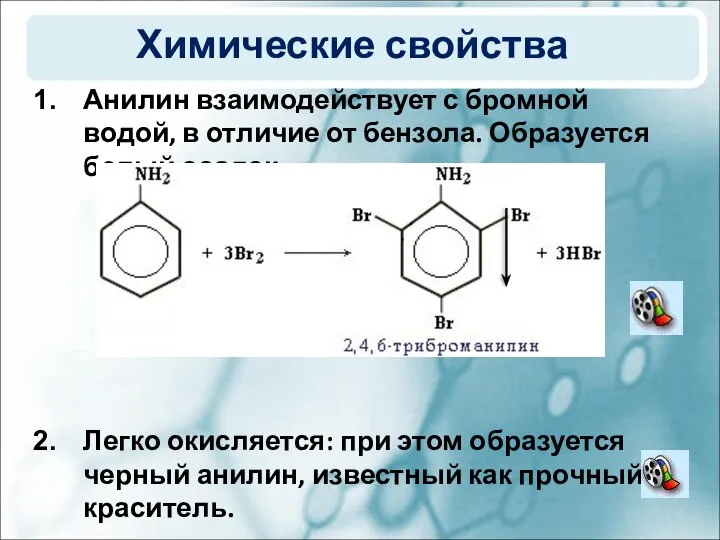
- 7. Химические свойства Анилин взаимодействует с бромной водой, в отличие от бензола. Образуется белый осадок. Легко окисляется:
- 8. Химические свойства Качественная реакция на анилин – реакция с хлорной известью Са(Cl)OCl – появляется характерное фиолетовое
- 10. Получение анилина Реакция Зинина – восстановление нитробензола водородом при t = 3000C C6H5 – NO2 +
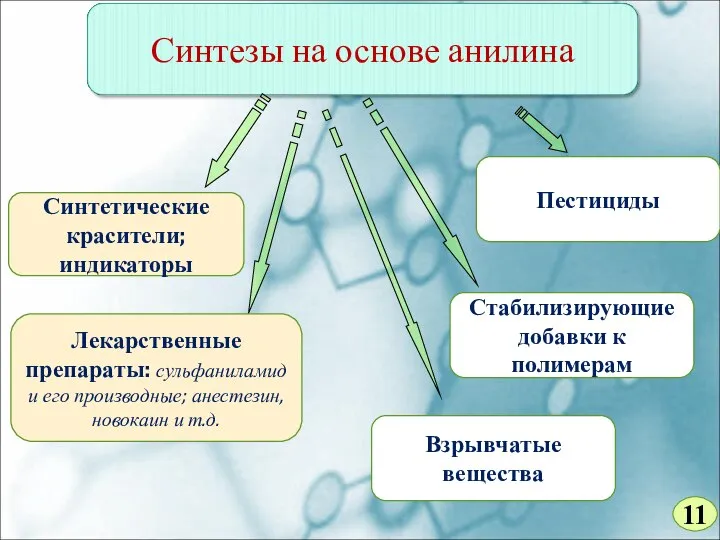
- 11. Синтетические красители; индикаторы Лекарственные препараты: сульфаниламид и его производные; анестезин, новокаин и т.д. Взрывчатые вещества Пестициды
- 13. Скачать презентацию






 Растворы. 8 класс
Растворы. 8 класс 10В Циклоалканы (1)
10В Циклоалканы (1) Буферные системы
Буферные системы Процессы переработки нефти
Процессы переработки нефти Лабораторное оборудование, посуда и средства защиты
Лабораторное оборудование, посуда и средства защиты Химия нефти и газа
Химия нефти и газа Алкины
Алкины Поверхность потенциальной энергии и расчет сил, действующих на ионы
Поверхность потенциальной энергии и расчет сил, действующих на ионы Серная кислота
Серная кислота Алюминий. Применение
Алюминий. Применение Красители vs пигменты
Красители vs пигменты Способы разделение смесей. 7 класс
Способы разделение смесей. 7 класс Гравиметрический анализ. Лекция №11
Гравиметрический анализ. Лекция №11 Арены. Бензол. 9 класс
Арены. Бензол. 9 класс Альдегиды (номенклатура и изомерия)
Альдегиды (номенклатура и изомерия) Сахароза
Сахароза Использование информационных технологий на уроках химии Радченко Н.В. учитель химии МОУ ПСОШ №3
Использование информационных технологий на уроках химии Радченко Н.В. учитель химии МОУ ПСОШ №3 Тела и вещества. Химический диктант
Тела и вещества. Химический диктант Классы неорганических соединений
Классы неорганических соединений Защитить кабель. Задача 9
Защитить кабель. Задача 9 Презентация на тему Фолиевая кислота
Презентация на тему Фолиевая кислота  Азотная кислота
Азотная кислота Углеводы
Углеводы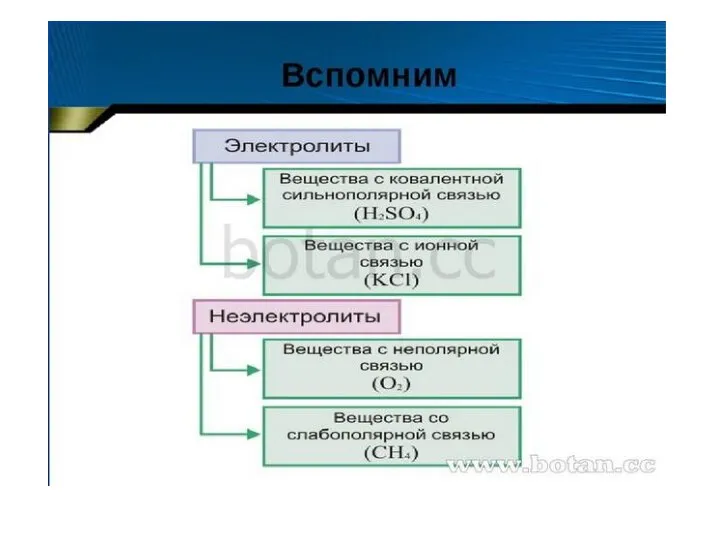 Диссоциация кислот, щелочей солей
Диссоциация кислот, щелочей солей Алкадиены
Алкадиены Презентация на тему Применение этанола и влияние его на человека
Презентация на тему Применение этанола и влияние его на человека  Электролитическая диссоциация
Электролитическая диссоциация Мыльная история
Мыльная история